تمرکز مطالبی که دربارهی پتانسیل عمل گفته خواهد شد، بر کانالهای یونی دریچهدار ولتاژی است. این کانالها هستند که پتانسیل عمل را به وجود آورده و ویژگیهای کلی آن را تعیین میکنند. قبل از مطالعهی این مقاله باید اطلاعات اولیهای از مفهوم پتانسیل غشا در ذهن داشته باشید.
پتانسیل عمل چهار ویژگی عمده دارد که برای پیامرسانی عصبی ضروری اند
- اول این که آستانهای برای شروع آن نیاز است. همانطور که شاید خوانده باشید، سلول عصبی را معادل یک مدار ساده در نظر میگیرند که غشا در آن مقاومت محسوب میشود. ولتاژ این غشا با افزایش قدم به قدم جریان، به صورت درجهبندی شده افزایش مییابد. فرمول محاسبهی این جریان همان معادلهی اُهم (V = ∆I · R∆) میباشد. با رسیدن ولتاژ غشا به ولتاژ آستانه که معمولاً چیزی در حدود ۵۰– میلیولت است، پتانسیل عمل آغاز خواهد شد.
- دوم آن که پتانسیل عمل واقعهای صفر و یک است. اندازه و شکل پتانسیل عملی که با یک جریان دپلاریزهکنندهی بزرگ شروع میگردد با اندازه و شکل پتانسیل عملی که توسط جریانی فقط به اندازهی آستانه تحریک میشود، یکیست. در واقع اندازه و شکل پتانسیل عمل به ویژگیهای غشا، غلظت یونها، دما و چیزهای دیگر بستگی دارد نه به میزان جریانی که به غشا میدهیم.
- سوم این که پتانسیل عمل کاهش نمییابد. در فواصلی قابل توجه نیز ویژگیهای بازتولیدی وجود دارد که دامنهی پتانسیل عمل را ثابت نگه میدارد.
- چهارم هم ویژگی دورهی تحریکناپذیری نورون است. مدت بسیار مختصری پس از پایان پتانسیل عمل، نمیتوان سلول را دوباره تحریک کرد. این ویژگی فرکانس و در نتیجهی ظرفیت انتقال اطلاعات نورون را محدود میکند.
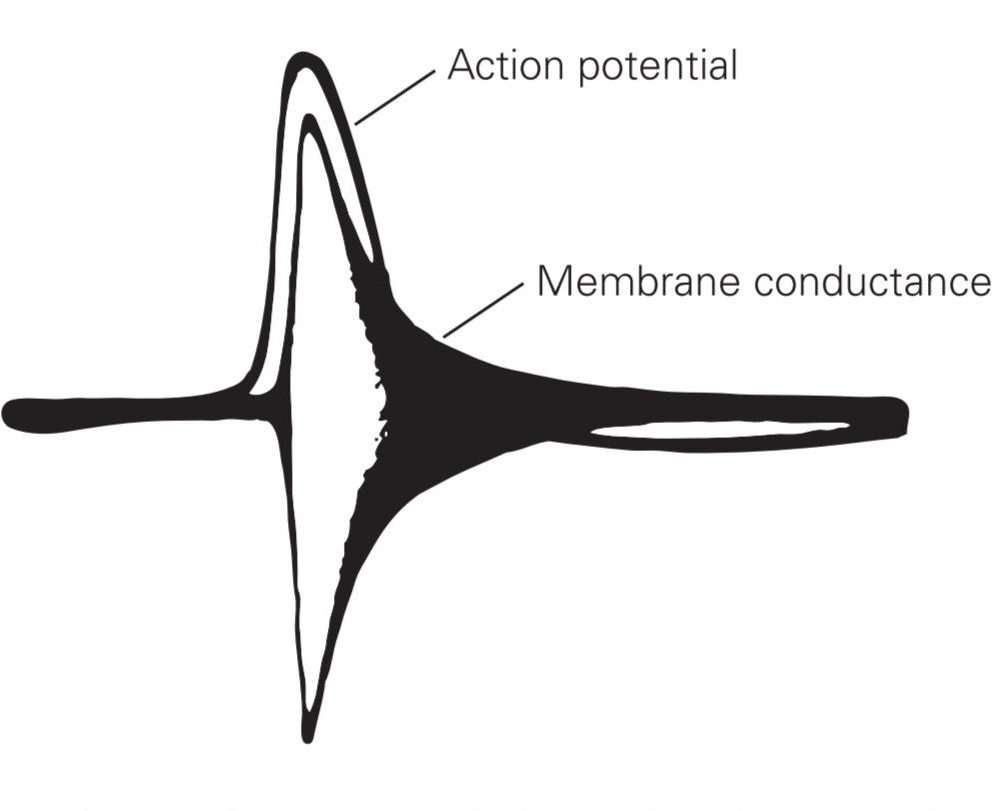
این چهار ویژگی؛ یعنی آستانهی شروع، خاصیت صفر و یک، هدایت بدون کاهش و دورهی تحریکناپذیری چیزی نبود که بتوان در دنیای زیستشناسی آن را توجیه کرد. از زمان اولین اندازهگیری پتانسیل عمل در میانههای قرن نوزدهم، حدود ۱۰۰ سالی طول کشید تا این که بالاخره اَلن هوجکین، اندرو هاکسلی و برنارد کاتز اولین دیدگاه کمّی را نسبت به مکانیسم پایهای پتانسیل عمل ارائه دادند.
پتانسیل عمل حاصل جریان یونها از خلال کانالهای ولتاژی است
آزمایش مهمی که مقدمات شناخت پتانسیل عمل را فراهم ساخت، به یک ماهی مرکب مربوط میشود (Kenneth Cole and Howard Curtis). در این آزمایش مشاهده شد که هدایت (conductance) یونی از عرض غشا در طول پتانسیل عمل به صورت معناداری افزایش مییابد. از این شواهد نتیجه گرفته شد که پتانسیل عمل حاصل جریان یونی از کانالهای غشایی است. در این مرحله دو سؤال پیش میآمد:
- چه یونهایی مسئول ایجاد پتانسیل عمل اند؟
- هدایت از غشا چگونه تنظیم میشود؟
هوجکین و کاتز مشاهده نمودند که با کاهش غلظت یون سدیم در بیرون از سلول، دامنهی پتانسیل کم میشود. بنابراین نتیجه این شد که جریان رو به داخل سدیم مسئول فاز بالاروندهی پتانسیل عمل است.
پس فرضیه این شد که هنگام شروع پتانسیل عمل نفوذپذیری غشا نسبت به یون سدیم به مدت کوتاهی بر نفوذپذیری اغلب غالب پتاسیم میچربد. اطلاعات آن زمان همچنین پیشنهاد میکرد که فاز پائینروندهی پتانسیل عمل نیز بر اثر افزایش نفوذپذیری بعدی نسبت به پتاسیم است.
جریانهای سدیم و پتاسیم
با یافتههایی که به آنها اشاره کردیم، هاکسلی و کاتز پرسش دیگری را نیز مطرح کرده و برای آن فرضیهای ساختند. چه مکانیسمی مسئول تنظیم نفوذپذیری غشا نسبت به یونهاست؟
فرضیهی آنها این بود که ولتاژ غشا مستقیماً مسئول تنظیم این نفوذپذیری است. برای آزمایش این فرضیه آنها به طور سیستماتیک ولتاژ غشای آکسون بزرگ ماهی مرکب را تغییر داده و در همان حین تغییرات حاصله را در هدایت یونها اندازهگیری نمودند. برای این کار به تکنیک جدیدی نیاز داشتند؛ چیزی به اسم ولتاژ کلامپ.
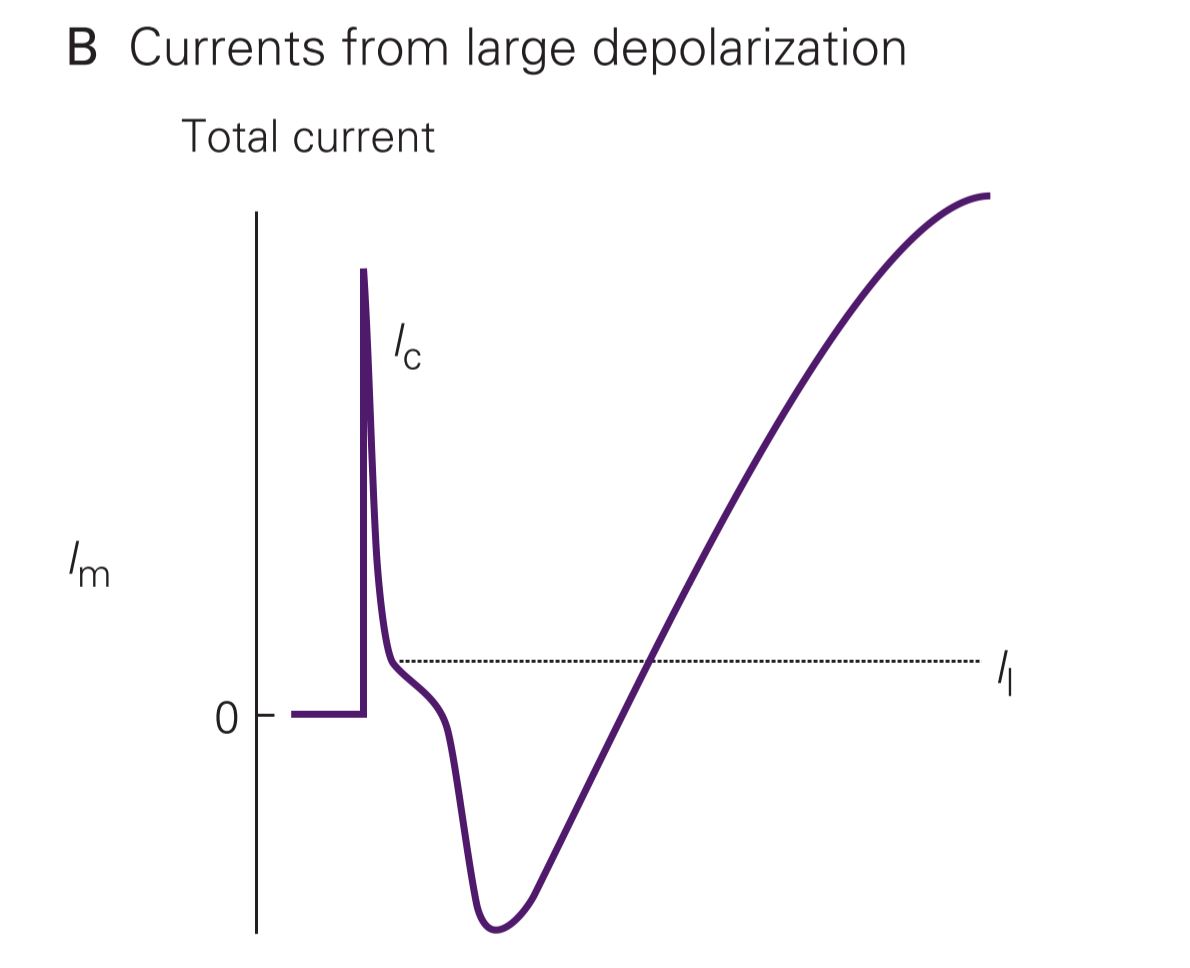
قبل از ابداع دستگاه ولتاژ کلامپ اندازهگیری هدایت یونها از عرض غشا بسیار محدود بود. فرض کنید تحریک نورون شروع شده و مقداری یون سدیم به سلول وارد میشود. این جریانِ رو به داخل باعث دپلاریزاسیون بیشتر غشا شده، کانالهای بیشتری باز کرده و چرخه آنقدر ادامه مییابد تا به قلهی پتانسیل عمل برسیم. بنابراین وضعیت ثابتی برای آزمایش وجود ندارد. همین وضعیت برای یون پتاسیم نیز صادق است.
در واقع ولتاژ کلامپ بین پتانسیل غشا و باز و بسته شدن کانالهای یونی قرار میگیرد. این دستگاه جریانی را به آکسون میدهد که معادل جریان کانالهای دریچهدار است. جریانی که دستگاه ولتاژ کلامپ استفاده میکند، معادل همان جریانی خواهد بود که از عرض غشا میگذرد.
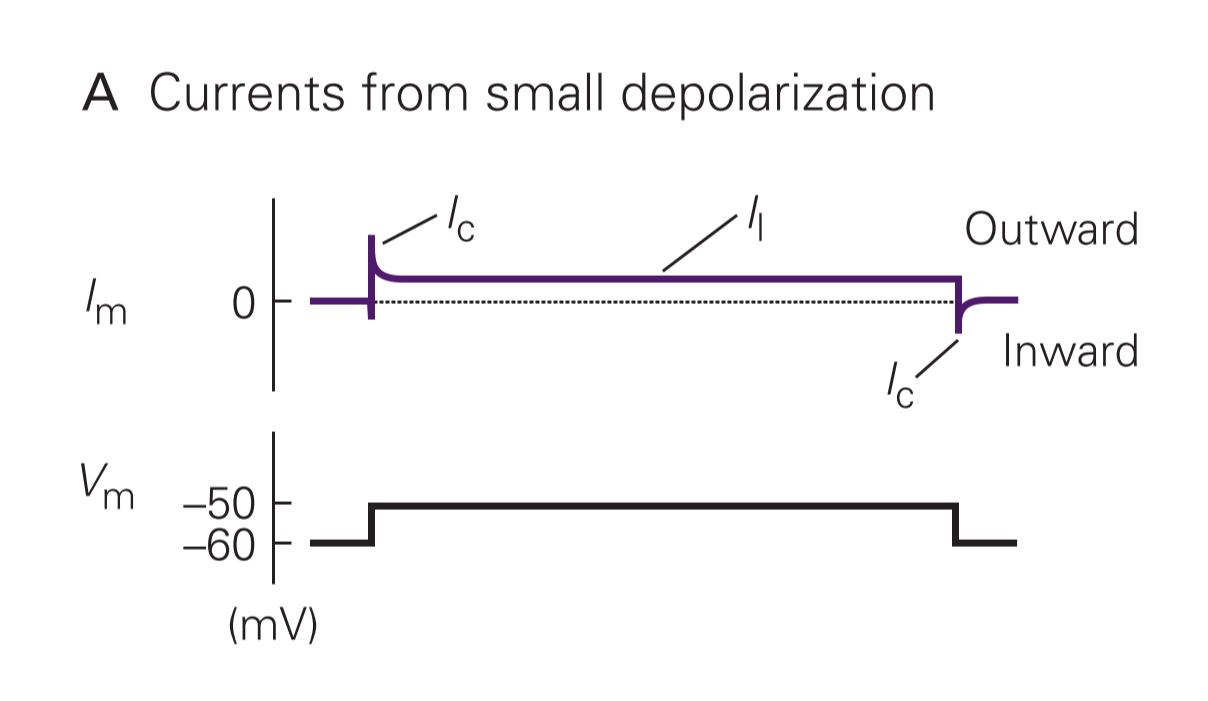
یکی از مزایای روش ولتاژ کلامپ امکان بررسی جداگانهی اجزای ظرفیتی و یونی غشاست. پتانسیل غشا (Vm) با بارِ (Qm) روی غشا بر ظرفیت آن (Cm) نسبت دارد (باید به یاد قوانین خازنها بیفتید). اگر پتانسیل غشا تغییر نکند، تغییر بار بر زمان (Qm/∆t∆) هم نخواهد بود که جریان به وجود بیاید. بنابراین اگر خودمان تغییری سریع در پتانسیل غشا ایجاد کنیم، جریان ظرفیتی فقط در ابتدا و انتهای تغییر به وجود خواهد آمد. بخاطر آنی بودن جریان ظرفیتی، میتوان به صورت جداگانه جریانهای هر یون را اندازه گرفت. اندازهگیری جریانی که یونها به وجود میآورند، برای فهمیدن ویژگی کانالها ضروریست.
آزمایش ولتاژ کلامپ با پتانسیلی از غشا به اندازهی پتانسیل آرامش آن آغاز میشود. وقتی ۱۰ میلیولت به Vm اضافه شود، جریان رو به خارج مختصری به وجود میآید که جریان ظرفیتی (Ic) است. جریان دیگری که همیشه هست و به پتانسیل غشا ارتباطی ندارد مربوط به کانالهای بدون دریچهی نشتی (Il) میباشد. در پایان هم جریان ظرفیتی دیگری رو به داخل به اندازهی جریان اولی ایجاد شده و کل جریان غشا را صفر میکند.
هوجکین و هاکسلی ابتدا به فکر جایگزین کردن یکی از یونها افتادند؛ مثلاً استفاده از یون هیدروژن H+ به جای سدیم Na+. بعداً با اکتشاف داروهایی که به طور انتخابی این کانالها را بلوک میکنند، کار راحتتر شد. تترادوتوکسین، سمی از نوعی ماهی بادکنکی اقیانوس آرام، به طور بسیار مؤثری کانالهای ولتاژی سدیم را مسدود میکند (مصرف چند میلیگرم تترادوتوکسین از ماهی بادکنکی در سوشی ژاپنی که خوب آماده نشده، میتواند کشنده باشد). کاتیون تترا اتیل آمونیوم هم کانالهای ولتاژی پتاسیم آکسون ماهی مرکب را مسدود مینماید.
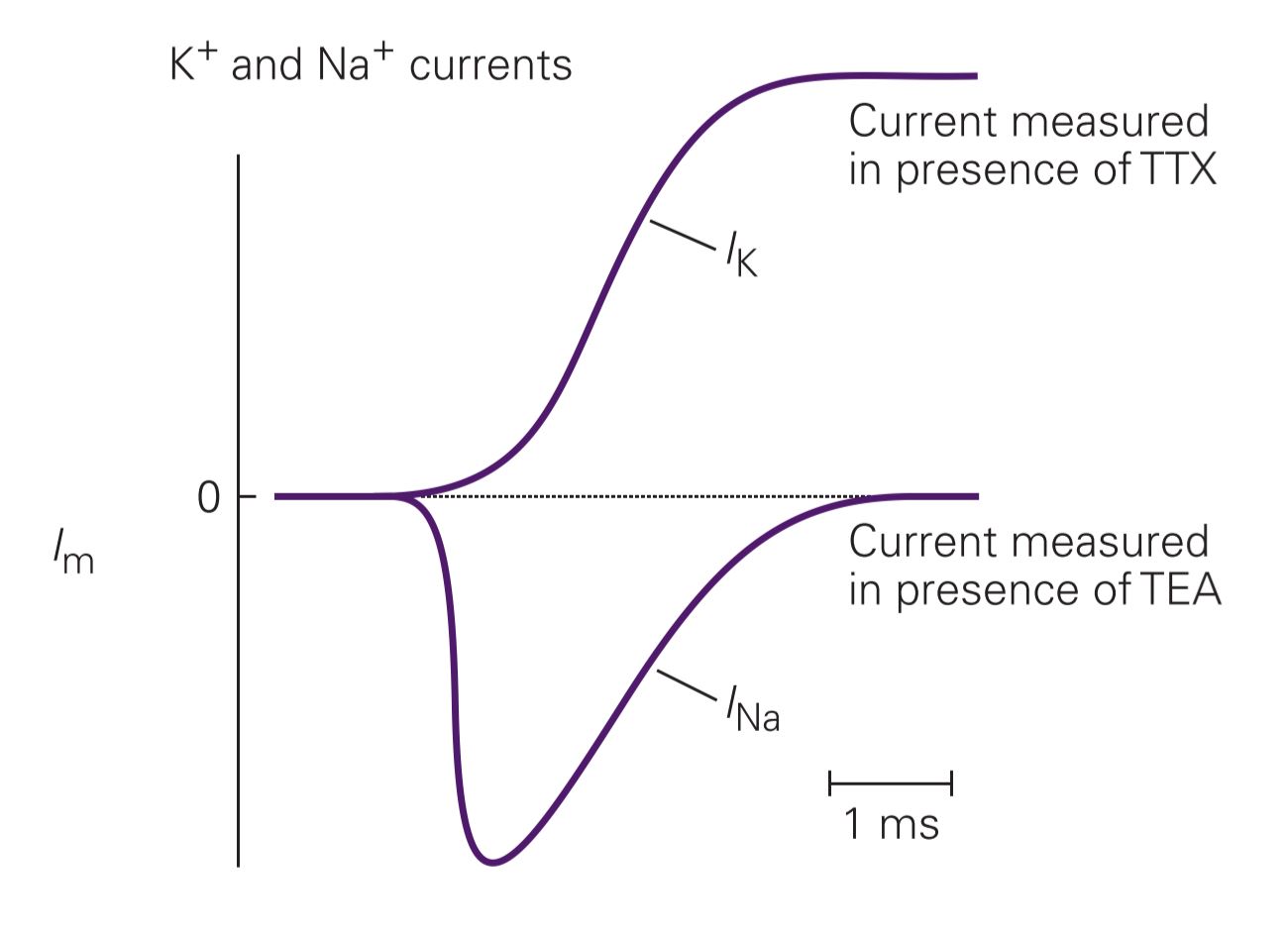
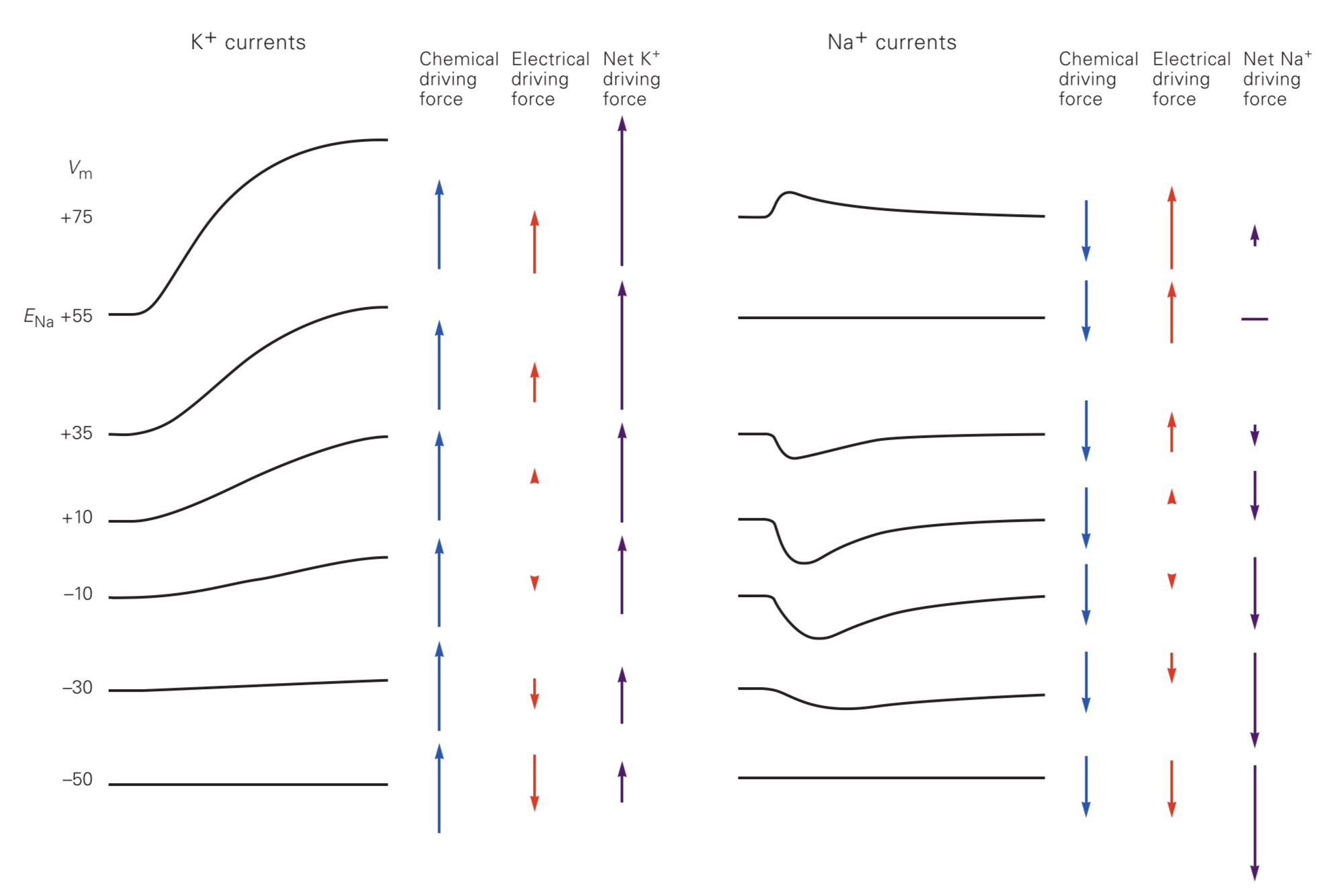
با آزمایشهای انجام گرفته مشخص شد که نیروی انتقالدهندهی پتاسیم از همان آغاز پتانسیل عمل رو به خارج میباشد؛ چون با مثبت شدن پتانسیل غشا هم تعداد کانالهای باز آن افزایش مییابد. هم شیب الکتریکی آن مثل شیب شیمیاییاش، رفتهرفته رو به خارج میشود.
اما در مورد سدیم اینگونه نیست. با مثبتتر شدن پتانسیل غشا تا حدود ۵۵+ میلیولت، شیب شیمیایی رو به داخل است و شیب الکتریکی بعد از صفر به آن نمیچربد. ولی بالای ۵۵+ میلیولت شیب کلی دیگر مثل پتاسیم رو به خارج میشود.
 رسانایی کانالهای ولتاژی از جریان آنها بدست میآید
رسانایی کانالهای ولتاژی از جریان آنها بدست میآید
با محاسباتی که هوجکین و هاکسلی به گونهای که دیدیم، انجام دادند، هدایت یونهای سدیم و پتاسیم (gNa و gK) معلوم شد. چون هم نیروهای الکتروشیمیایی معلوم بود و هم جریان اندازهگیری شد. بدین ترتیب دیدگاه ما نسبت به تأثیر ولتاژ غشا بر باز و بسته شدن کانالهای یونی بازتر گشت؛ چون هدایت یونها با تعداد کانالهای یونی باز ارتباط داشت.
اندازهگیری هدایت یونی Na و K از غشا دو شباهت و دو تفاوت را بین این دو نوع کانال بیان میکرد. هر دو کانال با دپلاریزاسیون باز میشوند. همچنین احتمال و شدت باز شدن هر دو کانال با افزایش اندازهی دپلاریزاسیون، افزایش مییابد. اما تفاوتها اینجاست؛ شدت باز شدن این دو نوع کانال و همچنین پاسخ آنها به دپلاریزاسیون طولانی با هم تفاوت دارند.
در تمام سطوح دپلاریزاسیون، کانالهای سدیمی نسبت به کانالهای پتاسیمی سریعتر باز میشوند. وقتی دپلاریزاسیون مدتی ثابت ماند، کانالهای سدیمی شروع به بسته شدن میکنند. غیرفعالسازی کانالهای سدیمی باعث اُفت جریان ورودی آن میشود. بنابراین دپلاریزاسیون باعث به وجود آمدن سه حالت در کانالهای سدیمی میشود؛ استراحت، فعالشده و غیرفعالشده. همارز با این حالتها، سه تغییر کانفورماسیونی نیز در ساختار پروتئینی کانالها ایجاد خواهد شد.
کانالهای پتاسیمی، برخلاف کانالهای سدیمی، تا زمانی که دپلاریزاسیون پابرجاست غیرفعال نمیشوند؛ حداقل به مدت چند ده میلیثانیهای که با آزمایشهای ولتاژ کلامپ معلوم شده است. در حالت غیرفعالسازی شده، هیچ چیزی نمیتواند دوباره کانالهای سدیمی را باز کند، مگر رپلاریزاسیون و برگشت دوباره به حالت استراحت. این فعالسازی دوباره کمی طول خواهد کشید؛ چون فرآیند آهستهای است.
این اثرات متغیر و وابسته به زمان دپلاریزاسیون روی هدایت یون سدیم، مدیون شکل خاص کانال آن است. دو دریچه در انتهاهای هر کانال وجود دارد؛ دریچهی فعالسازی در طول پتانسیل استراحت بسته است و با شروع دپلاریزاسیون باز میشود. دریچهی غیرفعالسازی در طول پتانسیل استراحت باز است و پس از پاسخ به دپلاریزاسیون بسته میشود. رپلاریزاسیون زمانیست که کانالها برای برگشت به حالت اولیه لازم دارند. زمان دپلاریزاسیون خیلی کم است ولی شدت جریان یونی از کانالها بسیار بالاست که آن را جبران میکند؛ چیزی در حدود ۱۰ میلیون یون بر ثانیه.