پنج سال پیش دانشمندان در گزارشهای مهیجی اعلام کردند تکنولوژی کریسپر توانایی ویرایش دقیق و بهینهی ژنوم در سلولهای یوکاریوتی را دارد. از آن زمان تاکنون صدها مؤسسهی تحقیقاتی بودجههای عظیمی برای بررسی کارکرد این تکنولوژی در علوم گوناگون از جمله پزشکی و کشاورزی صرف کردهاند. اکنون بهسختی میتوان انقلابی را در علم یافت که زیستشناسی را به اندازهی کریسپر تحت تأثیر قرار داده باشد. تنها چند سال قبل دانشمندان اعلام کردند سیستمی که توسط باکتریها علیه تهاجم ویروسی مورد استفاده قرار میگیرد قابلیت هدفگیری نقاط خاصی از DNA را داشته و میتوان از آن برای ویرایش ژنوم سلولهای یوکاریوتی از جمله پستانداران استفاده نمود.
در مدتی کوتاه پس از کشف این مکانیسم، کارکردهای فراوانی برای آن ابداع شد. از جملهی مهمترینِ آنها، ساخت مدلهای حیوانی پیچیده از بیماریهای وراثتی انسانی و سرطانها بود. همچنین اسکنهای ژنومیِ سلولهای انسان جهت یافتن میزان بیان ژن از دستاوردهای مهم انقلاب کریسپر به شمار میآید. با این حال پیشرفتهای حاصل شده در این حوزه موضوعات اخلاقی فراوانی را به پیش کشیده است.
کشف کریسپر
داستان کریسپر در کاستا بلانکای اسپانیا کلید میخورد. فرانسیسکو موجیکا (Francisco Mojica) در سال ۱۹۸۹ تحصیلات دورهی دکترای خود را در دانشگاه آلیکانته (Alicante) آغاز کرده و در آزمایشگاهی مشغول پژوهش بر روی آرکیباکتری مقاوم به نمک در مردابهای محلی شد.
استاد راهنمای موجیکا دریافت، غلظت نمک موجود در محیط کشت باکتری بر روی فعالیت برشدهندهی آنزیمهای محدودکننده تأثیر میگذارد. موجیکا در ادامه به بررسی قطعات تغییریافته پرداخت. در اولین قطعهی DNA مورد بررسی، نسخههای متعدد و کاملی از توالیهای بهشدت پالیندرومیک و نادر با طول ۳۰ باز یافت شد. این توالیها بین گروه دیگری از توالیهای فاصلهانداز با طول ۳۶ باز قرار گرفته بودند. موجیکا این یافتهها را بسیار عجیب و جذاب یافت و دهههای بعدی پژوهش خود را به پردهبرداری از راز این پدیده اختصاص داد.
مدتی بعد موجیکا توالیهای مشابه دیگری را در باکتری H.volcanii و سایر آرکیباکتریهای نمکدوست کشف کرد. همزمان با یافتههای موجیکا، گروهی دیگر از پژوهشگران در ژاپن (۱۹۸۷) توالیهای مشابه دیگری در باکتری E.Coli کشف نمودند. موجیکا وجود این تناوبهای شدیداً حفظ شده در گونههای باکتریایی دور را نشانهای بر عملکرد کلیدی آنها طی تکامل دانسته و مقالهای مبنی بر کشف کلاس جدیدی از تناوبها در سال ۱۹۹۵ منتشر نمود.
موجیکا به دلیل کمبود بودجه و مشکلات محیط آزمایشگاهی در آلیکانته، پژوهشهای خود را معطوف به بیوانفورماتیک و بررسی توالیهای ناشناس کرده و نام آنرا «تکرارهای کوتاه با فاصلههای منظم» یا SRSR گذاشت. نام این توالیها بعداً به تکرارهای پالیندروم کوتاه با فاصلههای منظم یا به اختصار CRISPR تغییر یافت. تا سال ۲۰۰۰ موجیکا موفق به کشف لوکوسهای کریسپر در ۲۰ میکروب مختلف از جمله باکتری عامل طاعون و سل شد. دو سال پس از این اکتشافات سایر دانشمندان موفق به کشف ژنهای مرتبط با کریسپر (CRISPR associated genes) یا cas در مناطق اطراف آن شدند.
اما سؤال اساسی این بود که کاربرد کریسپر چیست؟ گمانهای فراوانی در آن زمان مطرح میشد. از جملهی آنها کاربرد در تنظیم بیان ژن و تعمیر DNA بود. اما نادرستی تکتک ادعاهای مطرح شده در زمان کوتاهی اثبات میشد.
کریسپر، یک سیستم ایمنی ذاتی است
موجیکا در سال ۲۰۰۳ پژوهش خود را بهجای بررسی توالیهای حفظ شده، بر روی توالیهای فاصلهانداز میان آنها معطوف کرد. او با کمک برنامهی BLAST که شباهت توالیهای DNA را مورد بررسی قرار میدهد، به مقایسهی توالیهای فاصلهانداز پرداخت. در یافتهای تاریخی، یکی از لوکوسهای کریسپر در باکتری E.Coli مورد بررسی، با توالی باکتریوفاژ P1 که اکثر سویههای E.Coli را آلوده میکند مطابقت داشت.
همچنین سویهای که موجیکا موفق یه یافتن توالی فاصلهاندازه مشابه با فاژ P1 شده بود، به این ویروس مقاومت نشان میداد.
وی پس از کشف این مورد به بررسی ۴۵۰۰ توالی فاصلهانداز دیگر پرداخت. نتایج نشان میداد، دو سوم از ۸۸ توالی فاصلهاندازی که موردی مشابه از آن در بانک اطلاعاتی ثبت شده بود، مربوط به ژنوم ویروسها و یا پلازمیدهای کونژوگه است. این نتایج سبب شد تا موجیکا عملکرد این سری از تناوبها را به عنوان سیستم ایمنی ذاتی باکتریها در نظر گیرد.
در مدتی کوتاه موجیکا مقالهای تدارک دید و با توجه به اهمیت فراوان آن به ژورنال Nature ارسال نمود. در نوامبر ۲۰۰۳، ژورنال مذکور بدون درخواست هیچگونه بازبینیای مقاله را به علت تکراری بودن ایدهی اصلی رد کرد. سپس موجیکا اقدام به ارسال مقاله به مجلات دیگر نمود. در پایان، پس از چندین بار رد مقاله، وی توانست یافتههای خود را در ژورنال Molecular Evolutionبعد از ۱۲ ماه بازبینی، با عنوان «عملکرد احتمالی کریسپرها» منتشر کند.
برنامهریزی کریسپر
جان ون در اوست (John van der Oost) مدرک دکترای خود را از دانشگاه آمستردام دریافت کرد. اوست در سال ۲۰۰۵ با بودجهی تحقیقاتی خود به کمک یوگن کونین (Eugene Koonin) به بررسی باکتریهای سختی دوست پرداخته و بخشی از آن را صرف آنالیز توالیهای کریسپر کرد.
او و همکارانش، کریسپرِ سویهای از E.Coli را به سویهای دیگر از این باکتری که فاقد آن بود، منتقل کردند. این فرآیند به پژوهشگران اجازه میداد تا مجموعهی پنج پروتئین Cas را از منظر بیومدیکال مشخص نمایند. اعضای گروه اوست با حذف هر جزء، نشان دادند Casها برای برش پیشساز RNA رونویسی شده از ژن کریسپر به RNA ۶۱ نوکلئوتیدی نهایی ،(crRNA)لازماند.
بهمنظور اثبات عملکرد crRNA در مقاومت باکتریایی وابسته به کریسپر، تیم اوست اقدام به ساخت اولین آرایهی کریسپر مصنوعی کرد. این عملکرد موجب برنامهریزی کریسپر جهت هدفگیری چهار ژن اساسی در فاژ لامبدا میشد. مطابق با فرضیهی مطرح شده سویههایی که توالی جدید کریسپر را حمل میکردند، به فاژ لامبدا مقاومت نشان میدادند. این آزمایش نخستین ایمنی ایجاد شده به کمک کریسپر در تاریخ علم بود.
نتایج بررسیها همچنین نشان داد که توالی هدف سیستم کریسپر مولکول RNA نبوده و مستقیماً بر روی DNA اثر میگذارد. این گروه همچنین برای اثبات آنکه مولکول DNA، هدف توالیهای کریسپر است، از دو سری آرایه استفاده نمود. یکی از توالیها، مکمل mRNA و رشتهی کدکننده بود و دیگری، مکمل رشتهی دیگر DNA. با وجود تمامی تلاشهای شکل گرفته، ویراستاران ژورنال Science پس از ارسال مقاله توسط اوست، تأکید ویژهای بر عدم قطعیت این موضوع داشته و آن را تحت عنوان فرضیه منتشر ساختند.
کریسپر DNA را هدف قرار میدهد
لوسیانو مارافینی (Luciano Marraffini) همزمان با اتمام دورهی دکتری در دانشگاه شیکاگو بر روی استافیلوکوکوس کار میکرد. پس از همکاری با دکتر کازادابان (Casadaban) و درک اهمیت کریسپر در مکانیسم ایمنی باکتریایی، همکاری ویژهای جهت اثبات فعالیت محصولات کریسپر روی رشتهی DNA صورت گرفت. علت اصلی موضوع آن بود که کازادابان اعتقاد داشت با توجه به حجم عظیمی از محصولات RNA ویروسیِ تولید شده حین حمله ویروس، منطقی نیست که کریسپر با مکانیسم تداخل با RNAهای ویروسی فعالیت کند.
مارافینی در بررسیهای مرتبط با استافیلوکوکوس، متوجه شد سویهای از استافیلوکوکوس اپیدرمیس دارای توالی فاصلهاندازی در کریسپر خود است که با توالی خاصی از پلازمید ضدآنتیبیوتیکی (ژن nes) استافیلوکوکوس اورئوس مطابقت دارد. بررسیهای بعدی نشان داد امکان انتقال این پلازمید به سویهی ذکر شدهی استافیلوکوکوس اپیدرمیس وجود ندارد. بهطور واضح کریسپر استافیلوکوکوس اپیدرمیس موجب بلوکه شدن پلازمید باکتری دیگر شده بود؛ دقیقاً همانطور که موجب مهار ویروس میشد.
پس از این یافتهی فوقالعاده، مارافینی به کمک همکار خود دکتر سانتیمر (Sontheimer) به فکر بازسازی سیستم کریسپر در محیط آزمایشگاهی – جهت اثبات کارایی آن در برش DNA – افتاد. اما سیستم استافیلوکوکوس اپیدرمیس بسیار پیچیده بوده و دارای ۹ ژن cas است. در اقدامی بسیار هوشمندانه، آنها ژن nes که بر روی پلازمید استافیلوکوکوس اورئوس بود را به کمک اضافه نمودن یک اینترون که بهصورت خودکار قابلیت برش خود را دارد تغییر دادند؛ این اینترون در میانهی توالی فاصلهانداز قرار داشت. در صورتی که مکانیسم عملکرد کریسپر، تداخل RNA میبود، میبایستی هیچگونه تغییری در قبول و یا رد پلازمید جدید رخ نمیداد. اما با توجه به تغییر توالی DNA در بخش فاصلهانداز، در صورتی که مکانیسم عمل کریسپر برش DNA میبود، میبایستی مکانیسم بلوکه شدن دیگر رخ نمیداد. نتایج فوقالعاده بود؛ هیچگونه تداخلی رخ نداد: کریسپر بر روی DNA عمل میکرد!
نتایج مطالعات مارافینی و سانتیمر نشان میداد، کریسپر سیستمی قابل برنامهریزی متشکل از آنزیمهای محدودکننده است. در مقاله منتشر شده از آنها، بهطور واضحی به پتانسیل این سیستم در اصلاح ژنتیک اشاره شده بود. در کنار انتشار یافتهها، این دو دانشمند اقدام به ثبت پتنت استفاده از این سیستم در برش یا تصحیح لوکوسهای ژنیِ سلولهای یوکاریوتی کردند؛ اما بهدلیل کمبود یافتههای تجربی در این رابطه، تلاش آنها در ثبت پتنت با موفقیت همراه نبود.
کمپلکس Cas9 به وسیلهی crRNA راهنمایی شده و سبب برش دو رشتهی DNA میشود در پی مطالعهی صورت گرفته در سال ۲۰۰۷ که کریسپر را به عنوان سیستم ایمنی ذاتی معرفی کرده بود، سیلوین موئینیو با بررسی نقاط برش ژنوم ویروسی دریافت، تعداد برشهای ایجاد شده، برابر با تعداد توالیهای مطابق کریسپر و ژنوم ویروسی است. همچنین با بررسی توالیهای برشیافته، تطابق دقیق آنها با توالی crRNA مشخص شد. لازم به ذکر است که این فرآیند به کمک آنزیمهای Cas9 صورت میگیرد.
کشف tracrRNA
با وجود مطالعات فراوان صورت گرفته بر روی سیستم CRISPR-Cas9، یک تکهی دیگر پازل باقیمانده بود. این تکه، قطعهای کوچک به نام trans-activating CRISPR RNA یا tracrRNA بود که با کوشش امانوئل کارپنتیر (Emmanuelle Charpentier) بهطور اتفاقی کشف شد.
ویرایش ژنوم سلولهای پستانداران
در سال ۱۹۸۰ دانشمندان موفق به یافتن راهی برای تغییر ژنوم سلولهای پستانداران زنده و الصاق DNA به نقاطی خاص در رویان موش شدند. اما این فرآیند بهینه نبوده و تنها یک مورد از هزاران سلول دستکاری شده نتایج دلخواه را نشان میداد.
سوالات زیادی بر اساس ادعای مطرح شده در سال ۲۰۰۸ توسط مارافینی و سانتیمر مبنی بر پتانسیل سیستم کریسپر در اصلاح ژنتیکی مطرح شد. مشکلات زیادی در مسیر استفاده از این سیستم در ویرایش ژن یوکاریوتی وجود داشت. از جملهی این موارد، ژنوم بسیار پیچیده و بزرگتر یوکاریوتی، حضور ساختارهای کروماتینی ویژه یوکاریوتی و محیط داخل سلولی متفاوت بود. همچنین تلاشهای صورت گرفته برای انتقال سیستمهای باکتریاییِ ساده – مانند اینترونهایی با پیرایش خودکار – نیز با موفقیت همراه نبود. تمامی این موارد سوالات زیادی را در ارتباط با توانایی کریسپر در هدفگیری ژنوم یوکاریوتی به پیش کشیده بود.
فنگ ژنگ (Feng Zhang) در ۱۶ سالگی، بیست ساعت از زمان هفتگی خود را در آزمایشگاه اصلاح ژن میگذراند. حوزهی علاقهمندی وی اپتوژنتیک (Optogenetic) – تکنیکی انقلابی که فعالیت نورونها را حین ارسال ایمپالسهای عصبی به کمک نور نشان میدهد – است. او پس از توسعهی راهی برای ردیابی بیان ژن به کمک نور، به برنامهریزی فاکتورهای رونویسی علاقه نشان داد.
ژنگ توانست با تلاش فراوان خود نسخهی ویژهای از Cas9 باکتری استافیلوکوکوس ترموفیلوس را برای استفاده در سلولهای انسانی طراحی کند. در آوریل ۲۰۱۱، وی موفق شد بهکمک بیان Cas9 و CRISPR RNA مهندسیشدهای که ژن لوسیفراز را در پلازمید هدف قرار میدهد، میزان بیان این ژن را در سلولهای رویانی کلیه انسان کاهش دهد. با این حال تأثیر این فرآیند چشمگیر نبود. ژنگ یک سال را صرف بهینهکردن سیستم طراحی شدهی خود کرد .در میانهی ۲۰۱۲ وی توانسته بود سیستم سه-بخشی خود را که شامل Cas9 استروپتوکوکوس پایوژن و یا استافیلوکوکوس ترموفیلوس، tracrRNA و آرایهی کریسپر بود طراحی کند. او با هدفگیری ۱۶ ناحیه در ژنوم انسان و موش، نشان داد که میتوان به کمک این سیستم ژنهای انسانی را با بهینگی بالا تغییر داد. ژنگ و کونین مدتی کوتاه پس از یافتههای ذکر شده موفق به کشف کلاس دیگری از سیستم کریسپر شدند.
در کلاس دو سیستم کریسپر عملکرد برش توالی DNA وابسته به tracrRNA نبوده و تنها با کمک crRNA صورت میپذیرد. ژنگ به کمک همکاران خود در ژانویه ،۲۰۱۳ مقالهای در ارتباط با ویرایش ژنوم پستانداران منتشر نمود. این مقاله که در ژورنال Science منتشر شده، بالاترین میزان ارجاعات را در این حوزه به خود اختصاص داده است. از اوایل سال ۲۰۱۳ روند جستجوی عبارت کریسپر در گوگل با افزایشی بسیار چشمگیر همراه بوده و این روند در حال حاضر نیز ادامه دارد. حدود یک ماه بعد در ۲۶ اکتبر، جرج چرچ پروفسور دانشگاه هاروارد که حوزهی تخصصی وی ژنومیک و زیستشناسی سنتتیک است، با همکاری ژنگ مقالهای تحت عنوان ویرایش ژنوم انسانی منتشر ساختند و با تأثیر مقالهی شارپندیر و جنیفر دودنا، چرچ اقدام به آزمایش تلفیق crRNA-tracrRNA در سلولهای پستانداران کرد.
ویرایش باز
پنج سال از شروع با اشتیاق تحقیقات روی کریسپر میگذرد و دانشمندان به نسخههای تطابقپذیر، مؤثر و قدرتمندتر این ابزار دست یافتهاند که به طور گستردهای ویرایش DNA را تسهیل مینماید. دو مطالعه که به تازگی در Science و Nature منتشر شده است، دسترسی کریسپر را برای تغییر مادهی ژنتیک از این هم گستردهتر و البته ظریفتر میکند؛ روشی که ویرایش باز نام گرفته است. یکی از مطالعات، استراتژیای را برای ویرایش DNA و دیگری برایRNA پیشنهاد داده است. هر دو پژوهش صورت گرفته راههای جدیدی را برای مطالعات ژنتیکی و حتی درمان بیماریها ایجاد کردهاند. دیوید لیو، شیمیدان دانشگاه هاروارد که پیشگام ویرایش باز در هر دو بخش DNA و RNA است، میگوید:
کسی نباید این فکر را بکند که ویرایشگرهای باز بهتر از کریسپر اند؛ آنها فقط متفاوتاند. مثل این میماند که بپرسید کدامیک بهتر است، قایق یا خودرو؟
کریسپر که از سیستم دفاعی باکتریایی گرفته شده، کارش را با بریدن دورشتهی DNA بر روی هدف مشخصش روی ژنوم به انجام میرساند. برخلاف آن، ویرایش باز، دو رشتهی DNA را برش نداده و به جای آن از آنزیمهایی استفاده میکند که به طور دقیق، با جابهجا کردن برخی اتمها بازهای DNA و یا RNA را به یکدیگر تبدیل میکنند، بدون اینکه لازم باشد بازهای اطراف آن تعویض شوند. این توانایی به مقدار قابل توجهی انتخابها را در اصلاح ژنتیکی افزایش میدهد. اریک سانتیمر، از محققین پیشگام در کریسپر این روش را بسیار کارآمد دانسته است.
بسیاری از بیماریهای انسانی به دلیل جهش تنها در یک باز رخ میدهند. استفاده از روش کریسپر برای تصحیح جهشهای نقطهای با مشکلات فراوانی همراه بوده و بهینگی لازم را ندارد؛ در نتیجه ویرایش باز راهحل بهتری را ارائه میدهد. پس از گزارش اولیه لیو، گروهی در چین از ویرایش بازهای DNA برای تصحیح یک بیماری در جنین انسانی کلون شده از یک بیمار با نقص ژنتیکی خونی استفاده کردند.
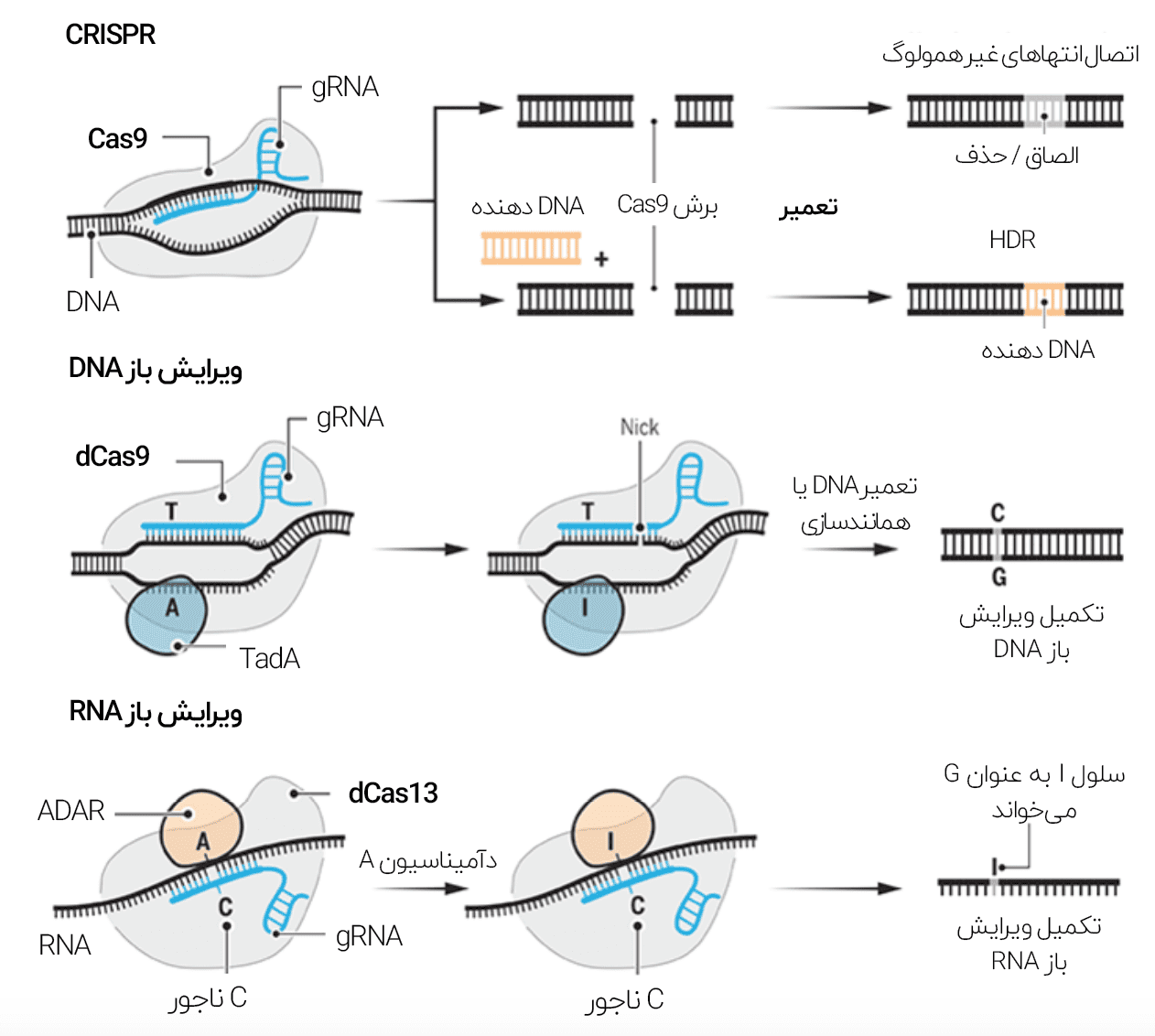
کریسپر کلاسیک از یک RNA راهنما »gRNA« که با یک نوع آنزیم نوکلئاز معمولاً Cas9 جفت شده است، استفاده میکند. سپس این مجموعه به توالی خاصی از DNA متصل میگردد. در این هنگام نوکلئاز مارپیچ دورشتهای را قیچی میکند. مکانیسم بازسازی DNA سلول سپس وارد عمل شده و سعی در اتصال قطعات جدا شده میکند، با این حال در برخی موارد این فرآیند همراه با اضافه شدن یا حذف برخی دیگر از بازها اتفاق میافتد که سبب میشود تا رمز DNA به کدی نامفهوم تبدیل شده و ژن هدف از بین برود. فنگ ژنگ در این باره میگوید:
ویرایش ژنی بر پایه نوکلئاز اغلب در غیرفعال ساختن ژنها مؤثر است.
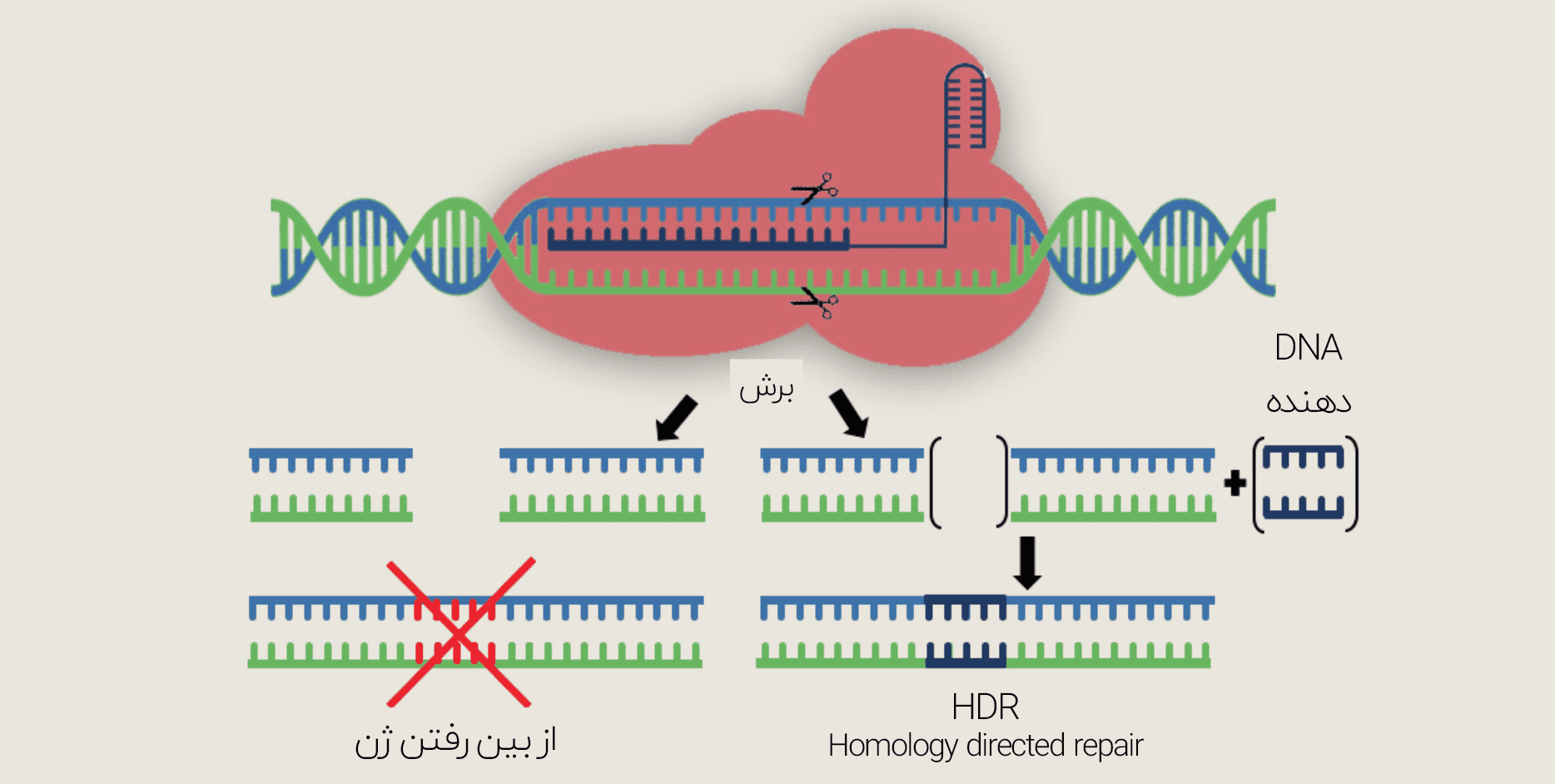
درحال حاضر کریسپر در ایجاد تغییرات دقیق آنچنان مؤثر نیست. برای تصحیح جهش نقطهای، علاوه بر سیستم کریسپر-Cas9 باید توالی سالمی از ژن مورد نظر تحت عنوان توالی «دهنده» همراه با کمپلکس کریسپر ارائه گردد. سپس موفقیت فرآیند وابسته به مکانیسم سلولی موسوم به HDR یا Homology-directed repair خواهد بود. اما این فرآیند تنها در هنگام تقسیم سلولی بهطور مناسب فعالیت مینماید. این بدان معناست که این مکانیسم در سلولهایی مانند تارهای ماهیچهای و نورونها مؤثر نخواهد بود. همچنین در صورت تقسیم سلولها نیز تنها در تعداد اندکی از سلولها DNA دهنده به محل برش اضافه میگردد.
بخشی از اجزای تشکیل دهندهی سیستم ویرایش باز، مشابه با اجزای کریسپر است. از جمله این موارد، gRNA و پروتئین Cas9 میباشند. با این حال در این سیستم به جای برش هر دو رشتهی ،DNA تنها بازها به کمک آنزیمهای دآمیناز تغییر داده میشوند. از جمله این آنزیمها میتوان به TadA و ADAR اشاره نمود. DNA چهار نوع باز نوکلئوتیدی دارد (A ،C ،T و G) و ویرایش باز آنها را به یکدیگر تبدیل میکند. در طی تحقیق لیو در سال ۲۰۱۶ ،تیم او gRNA را به یک Cas9 مرده (dCas9) الحاق کردند.

dCas9توانایی برش کل دو رشته را ندارد ولی میتواند آن را در محل صحیح از هم باز کند. برای انجام چنین عمل پیچیدهای، محققان از آنزیمی به نام APOBEC1 استفاده کردند که با یک سری واکنشها، باز C را به T تبدیل مینماید. همچنین، تبدیل باز G در رشتهی مقابل به ،A در اثر تحریک سیستم ویرایش ذاتی خود سلول به انجام میرسد. با اولین ویرایشگر باز DNA که شرح داده شد، نمیتوان بیشتر جهشهای مرتبط با بیماریهای انسان را برطرف کرد. ولی بهنظر میرسد این مشکل هم برطرف شده است.
گروه لیو بار دیگر gRNA را با یک dCas9 ترکیب کردند، اما این بار آنزیمی وجود نداشت که A را به G تبدیل کند. بنابراین محققان آنزیم جدیدی را از TadA (آنزیمی در باکتری E.Coli) ایجاد نمودند که باز A را به اینوزین (I) تبدیل میکند. سیستم ویرایش همانندسازی DNA در خود سلول زحمت تبدیل باز I به G را خواهد کشید. جورج چرچ که در هاروارد روی کریسپر تحقیق میکند، در این باره میگوید:
کار اصلی مهندسی آنزیم TadA است تا فرآیندی کاملاً غیرطبیعی را انجام دهد. من به احترام کسانی که این کار را کردهاند، کلاه از سر خود برمیدارم!


خدا قوت، امیدوارم روز به روز پیشرفت کنید
بنده سال چهارم تجربی ام و علاقه ی زیادی به CRISPR پیدا کردم ولی مقالتون تخصصی هست و من بعضی قسمت هارو می فهمم
من هر مقاله یا متنی که درباره CRISPR میخونم تخصصیه یکم دلرحم باشید افرادی در سطح من هم مخاطبتونن
– لطفا بصورت ساده عمل CRISPR رو توضیح بدید و هر قسمتی که میبینید لازمه توضیح بدید
ممنون
سلام دوست عزیز؛
ممنون از همراهی شما
مطالب زیر شاید بیشتر کمکتون بکنه:
https://virtualdr.ir/2016/10/30/crispr-cas9
در صورتی که جواب سوالتون رو نگرفتید، باز هم موضوع رو مطرح کنید تا پاسخ داده بشه
جوابمو نمیدید؟
سلام، مطلب فوقالعاده خوب و جامعی بود.
سلام دوست عزیز؛
ممنون از همراهی شما
با سلام.مطالبتون واقعا کامل بود به نظرم.و یک گزارش کامل بود
با سلام
خوشحالم مفید بوده براتون ?
سلام
ممنون به خاطر گذاشتن چنین مطلب مهم و مفید.
ایده جدیدی در مورد مکانیسم سرطان دارم و در حال نوشتن یه پروپوزال در موردش هستم و کاملش نکردم چون دوست داشتم اول بدونم پس چطور باید سرطان رو به طور کامل درمان کرد با این ایده پس درمان های فعلی همشون موقتن مگر در برخی موارد که علتشم خوب میدونم. با خوندن این مطالب ایده ای هم برای درمانش به ذهنم رسید و اینکه چرا این روش برخی موارد جواب نداده و برای اثبات تئوریش نیاز به مطالعه بیشتر دارم. خیلی خیلی امیدوارم کردین. یه دنیا ممنون.