در اساطیر یونان باستان، سه الهه سرنوشت برای تقدیر اجتنابناپذیر همه افراد از بدو تولد تا لحظهٔ مرگ تصمیم میگرفتند. کلوتو ریسمان را میریسید، لاخسیس تا حدی که دلش میخواست آن را میکشید و دراز میکرد و آتروپوس میبرید. آن ریسمان را زندگی آدمیزاد میپنداشتند. به عقیده آنها، این سه الهه سرنوشت انسانها را مقرر میکردند. هنگامی که یک جهش ژنتیکی در موشها شناسایی شد که عامل پیری زودرس بود، ژن درگیر کلوتو (klotho) نامیده شد. Klotho حاوی رمز ژنتیکی پروتئینهای α-klotho و β-klotho (sister proteins) است. این دو پروتئین، کورسپتورهای گروه خاصی از فاکتورهای رشد فیبروبلاستی (FGF) بوده و تمایل بالایی به ترکیب با آنها دارند. عملکرد این کورسپتورها هنوز به خوبی شناخته نشده است. در این مقاله، به تحلیل دو مطالعهای که ساختار کمپلکس FGF-klotho را بررسی کردهاند، خواهیم پرداخت. این دو مطالعه، علاوه بر آنکه اطلاعات پایهای از نحوه عملکرد پروتئین کلوتو را فراهم آوردهاند، روشهایی را نیز برای طراحی داروهای جدید ارائه کردهاند.
مقاله مرتبط: دلیل ژنتیکی زوال ناشی از پیری
α-klotho از پروتئینهای غشایی است و غالبا در کلیه و مغز بیان میشود. موشهای فاقد این پروتئین، علائم مرتبط با پیری فراوانی همچون نقص شنوایی، اختلال در تواناییهای شناختی و تحلیل ارگانها را نشان میدهند. همچنین افزایشی در سطح فسفات خون آنها رخ میدهد. نقش α-klotho در سطح مولکولی، تا پیش از شناسایی موشهای فاقد FGF23 ناشناخته بود.
FGF23 یکی از سه FGF درونریز بوده، به عنوان هورمون عمل کرده و توسط یک ارگان ترشح میشود تا عملکرد دیگری را تنظیم کند. FGF23 خصوصا پس از دریافت فسفات، از استخوانها ترشح میشود. این هورمون در کلیه بازجذب فسفات را مهار میکند تا با افزایش دفع، سطح فسفات بدن تعدیل شود. در موشهایی که فاقد FGF23 هستند، سطح فسفات به علت اختلال در دفع آن، افزایش مییابد. این موضوع باعث بروز علائم مربوط به پیری میشود. دانشمندان با مشاهده این شباهت قابل توجه بین FGF23 و α-klotho، اینگونه نتیجه گرفتند که α-klotho با نوعی پروتئین غشایی به نام FGFR1c که رسپتور FGF است، تشکیل کمپلکس داده و به عنوان کورسپتور عمل میکند. درنتیجه باعث اتصال بیشتر FGF23 و تحریک سیستم سیگنالیگ آن میشود.
در یکی از این دو مطالعه، Chen و همکارانش، ساختار کمپلکس FGF23 -بخش متصل به لیگاند FGFR1c-بخش خارج سلولی α-klotho را شناسایی کردند. آنان دریافتند که α-klotho بازوی درازی برای اتصال به رسپتور (long receptor-binding arm=RBA) ارسال میکند. این بازو همانند ریسمانی بخش متصل به لیگاند FGFR1c را نگهمیدارد. محققان، α-klotho فاقد RBA را ایجاد کرده و مشاهده نمودند که این پروتئین جهشیافته فاقد توانایی اتصال به FGFR1c و یا کمک به فعال شدن مسیر سیگنالیگ FGF است.
Chen و همکارانش نشان دادند که FGF23 در شیاری که بین FGFR1c و α-klotho تشکیل میشود قرار میگیرد. انتهای کروی آمینی FGF23 به FGFR1c و انتهای میلهای کربوکسیلی آن به α-klotho متصل میشود. α-klotho اتصالات این کمپلکس را تقویت کرده و باعث اتصال قویتر FGF23 به FGFR1c میشود. در صورت عدم وجود α-klotho این اتصالات ضعیف هستند.
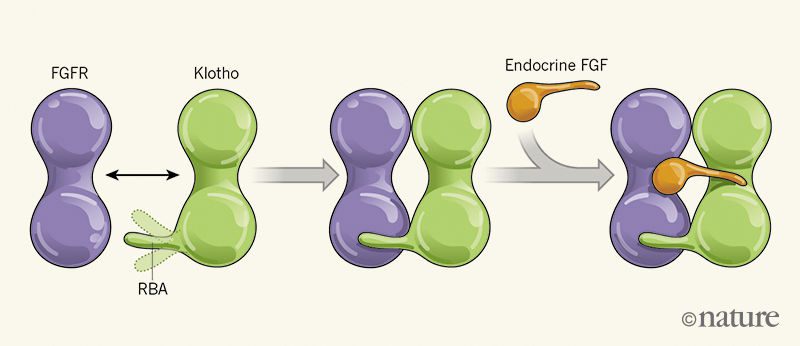
β-klotho نیز همانند α-klotho به عنوان کورسپتور عمل کرده و باعث تشکیل کمپلکس بین FGFR1c و FGF21 و نیز FGFR4 و FGF19 میشود. FGF19 از روده و پس از غذا خوردن ترشح میشود. این هورمون در کبد عمل کرده و سنتز اسیدهای صفراوی را مهار میکند. FGF21 از کبد و پس از عدم مصرف غذا به مدت طولانی (روزه گرفتن) ایجاد شده، در سلولهای چربی و مغز عمل کرده و باعث ایجاد سازگاری متابولیکی و پاسخ به استرس میشود. بااینکه FGFRها در بافتهای فراوانی بیان میشوند، بیان اختصاصی β-klotho در کبد، سلولهای چربی و مغز، ارگانهای هدف این FGFها را محدود میکند.
در مطالعه بعدی، Lee و همکارانش، ساختار بخش خارج سلولی β-klotho را در غیاب FGFRها و در حالات متصل به FGF21 و جدا از آن مطالعه کردند. مشابه FGF23، انتهای کربوکسیلی FGF21 به شیاری در β-klotho متصل میشود. با این حال آنان نتوانستند ساختار بعضی از نواحی β-klotho را شناسایی کنند. به عنوان مثال نتوانستند ساختاری مشابه RBA در α-klotho را بیابند. این موضوع نشان میدهد که پروتئینهای کلوتو از دسته intrinsically disordered proteins هستند؛ به این معنی که ساختار سهبعدی منظم و ثابتی ندارند و بدون متصل شدن به FGFRها نمیتوانند به نحو پایداری تا شوند (folding). intrinsically disordered proteinها، میتوانند با چندین پروتئین فعل و انفعال داشتهباشد. این موضوع نشان میدهد که RBA پروتئین کلوتو میتواند به بخشهای دیگری به جز FGFRها نیز متصل شود. از این رو، بخش خارج سلولی α-klotho که میتواند به فضای خارج سلولی آزاد شود، نقشهای دیگری نیز دارد که مستقل از FGFRهاست. تنظیم فعالیت کانالهای یونی و سایر ناقلها از جمله این نقشهاست.
وظیفه مستقل از FGF دیگری که برای پروتئین کلوتو گزارش شده است، عمل به عنوان پروتئین متصل شونده به کربوهیدرات است. این پروتئینها لکتین نام دارند. در واقع کلوتوها متعلق به خانوادهای از آنزیمها هستند که وظیفه بریدن زنجیرههای قندی را بر عهده دارند، اما همه آمینواسیدهای مسئول این کار، در کلوتو قرار ندارند. بنابراین پروتئین کلوتو ممکن است تنها به کربوهیدراتهای خاصی متصل شود، اما در بریدن آنها نقش نداشته باشد. مطالعه Lee و همکارانش مغایرتی با این موضوع ندارد؛ اما ساختاری که Chen برای کمپلکس α-klotho- FGF23- FGFR1c مشخص کرد، این موضوع را که α-klothoها به عنوان آنزیم یا لکتین عمل میکنند، تایید نکرد. ممکن است علت، تفاوت ساختار α-klotho در حضور یا غیاب FGFR باشد همچنین ممکن است نقش مستقل از FGF این دو پروتئین کلوتو با همدیگر متفاوت باشد.
مقاله مرتبط: پروتئینهای ضد پیری ممکن است دیابت، چاقی و سرطان را درمان کنند
مسیرهای سیگنالینگ FGF-klotho در پیری و اختلالات مربوط به آن نقش کلیدی دارند. این ساختارهای شناسایی شده میتوانند در تولید داروهای جدید برای درمان اختلالات ناشی از افزایش سن، مورد استفاده قرار گیرند. به عنوان مثال بیماری مزمن کلیه (Chronic Kidney Disease=CKD) را در نظر بگیرید. این بیماری نوعی اختلال شایع در عملکرد کلیه است که درنتیجه فشار خون بالا و دیابت رخ میدهد. مبتلایان به CKD علائم مشابهی با موشهای فاقد α-klotho نشان میدهند. اختلالات متابولیسم فسفات و افزایش خطر مرگ از جمله این علائم هستند. کاهش میزان فسفات رژیم غذایی موشهای فاقد α-klotho یا FGF23، احتباس فسفات و پیری زودرس را در آنها کاهش میدهد. این موضوع نشاندهنده اثر تسهیلی فسفات بر فرایندهای پیری است. بنابراین داروهایی که کمپلکس FGF-klotho-FGFR را هدف قرار داده و متابولیسم فسفات را اصلاح میکنند، در درمان CKD موثر خواهند بود.
مثال دوم به کمپکس FGF21 مربوط است. بیان بیشازحد FGF21 طول عمر موشها را افزایش میدهد؛ ازاینرو این پروتئین، هورمون ضد پیری (antiageing) نامیده شدهاست. Lee و همکارانش اظهار کردهاند که میتوانند این توانایی FGF21 را با ایجاد جهش و افزایش میل ترکیبی به β-klotho، تقویت کنند. این چنین مطالعاتی میتواند به تسهیل کشف داروهای آینده منجر شود.
