همان طور که میدانید، میتوکندریها ارگانلهایی هستند که وظیفه تامین انرژی بدن را بر عهده دارند. آنها این کار را با تبدیل گلوکز به ATP انجام می دهند که منبع اصلی انرژی برای اعمال سلولی است. دانشمندان میدانند که میتوکندریها از باکتریها تکامل پیدا کرده اند. میتوکندریها به علت شباهتی که باکتریها دارند، میتوانند بیماریهای شدیدی را در انسان باعث شوند. چگونه ارگانلهای داخل بدنمان ناگهان تبدیل به یک تهدید میشوند؟
منشا میتوکندریها به عنوان ارگانلهای داخل سلولی: تئوری درون همزیستی
در اواخر قرن نوزدهم، گیاهشناسی به نام Andreas Schimper برای نخستین بار پیشنهاد کرد که برخی ارگانل ها از به هم پیوستن و همزیستی دو ارگانیسم مختلف ایجاد شدهاند. وی هنگام مشاهده تقسیم کلروپلاست در گیاهان سبز، متوجه شباهت این ارگانل با سیانوباکترهای آزادزی شد. در اوایل قرن بیستم، گیاهشناس دیگری به نام Konstantin Mereschkowski، با ارائه تئوری همزیستیزایی (symbiogenesis)، تاییدی برای نظر شیمپر فراهم آورد. طبق این تئوری، کلورپلاستها از سیانوباکترهای همزیست پدید میآیند. همزمان، Ivan Emanuel Wallin نیز پیشنهاد داد که میتوکندریها هم از باکتریها ایجاد میشوند. این تئوریها به میزان زیادی نادیده انگاشته شدند، تا اینکه در دهه ۱۹۶۰ دوباره مطرح شدند. در آن زمان، دانشمندان به میکروسکوپهای الکترونی دسترسی داشتند و میتوانستند سلولها را با جزئیات بیشتری مطالعه کنند. دانشمندان اکنون قادر بودند ارگانلهای سلولی و ذرات به کوچکی چند میکرون را مشاهده نمایند. در اثر این پیشرفتهای پیشرفتهای انقلابی، دانشمندان متوجه شدند که میتوکندریها در داخل خود، دارای DNA ای به فرم کروموزوم حلقهای هستند. این مشاهده بعدها توسط متدهای بیومدیکال اثبات گردید.
در سال ۱۹۶۷، Lynn Margulis و سپس Lynn Sagan مشاهدات میکروبیولوژیکی متنوعی را فراهم آوردند تا تئوری درون همزیستی را توجبه کنند. البته در آن زمان مقاله وی توسط ۱۵ مجله علمی رد شد، تا اینکه Journal of Theoretical Biology آن را به چاپ رساند. ابن مقاله هم اکنون از معتبرترینها در زمینه منشا سلولهای یوکاریوتی است. طبق درون همزیستی که توسط Margulis ارائه شد، میتوکندریها از پروکاریوتهای همزیست باستانی منشا گرفتهاند که به اخل پروکاریوتهای آزادزی وارد شده اند. همان طور که انتظار میرود، این تئوری سریعا مقبولیت پیدا نکرد و دههها طول کشید تا دانشمندان فرضیه وی را تئوری بنامند.
شواهد
Margulis از چه شواهدی برای پشتیبانی عقیدهاش استفاده کرد؟ به خاطر بیاورید که در آن زمان، دانشمندان قادر بودند که سلولها را زیر میکروسکوپ بررسی کنند، آنها لیز کرده و ساختار ترکیبات داخل سلولی شان را بیازمایند، اما نمیتوانستند به توالی DNA پی ببرند. Margulis از تعدادی از شواهد برای اثبات فرضیهاش استفاده نمود. وی متوجه شد که میتوکندریها اجسام خودتکثیرشوندهای هستند. میتوکندریها تعداد دو یا بیشتری غشا دارند و ترکیب داخلیترین غشا بسیار شبیه به باکتریها است. هر دو ارگانل میتوکندری و کلروپلاست، DNA اختصاصی خود را دارند که حاوی محتویات وراثتی آنها است. DNA میتوکندریایی ساختار حلقوی سادهای دارد که از لحاظ ساختاری مشابه DNA باکتریایی و کموبیش هم اندازه آن است. ریبوزومهای میتوکندریایی، آنزیم ها و سیستمهای انتقالی آن، مشابه باکتریها هستند.
با پیشرفت متدهای بیولوژی مولکولی، شواهد مبنی بر نظریه درون همزیستی نیز افزایش پیدا کردهاند. به عنوان مثال، با استفاده از توالی یابی ژنومی و آنالیزهای فیلوژنتیکی، دانشمندان نشان داده اند که DNA میتوکندریایی، موتیفهای ساختاری مشابهی را با DNA باکتریایی دارد و آن ژنهای میتوکندریایی از پروتئوباکتریها منشا گرفتهاند.
اخیرا تئوری درون همزیستی به دانشمندان کمک کرده است که تا پاسخ معمایی را که پزشکان برای سالها در اورژانس با آن مواجه میشدند، پیدا کنند. آن چه در ادامه خواهید خواند، داستان ارتباط میتوکندریها به پاسخهای ایمنی التهابی در بیماران نیازمند مراقبتهای ویژه است.
معمایی در اورژنس: پاسخ ایمنی التهابی و میتوکندریها
برای سالها، پزشکانی که در واحدهای مراقبت ویژه کار میکردند، شاهد وقوع مشابهتهایی میان دو پدیده متفاوت بودند: SIRS (سندروم پاسخ سیستمیک التهابی) و سپسیس. بیمارانی که از ترومایی شدید و یا آسیب فیزیکی جان سالم به در می برند، ممکن ایت دچار SIRS شوند که عارضهای مرگبار است. تب، افزایش ضربان قلب و فشار خون پایین، مشخصه SIRS است و می تواند باعث شوک عمومی و اختلال عملکردی چندین ارگان شود. سپسیس، پدیدهای شناخته شده است که هنگام وقایعی همچون پاسخ سیستمیک التهابی تا عفونت شدید رخ میدهد.
پزشکان متوجه شدند که سپسیس و SIRS هر دو دارای علائم مشابهی هستند، اما آیا این مشابهتها اساس فیزیولوژیک دارد؟ در نگاه اول، دو بیماری متفاوت به نظر میرسیدند. در SIRS، پاسخ التهابی در اثر آسیب فیزیکی و تروما ایجاد میگردد. این در حالی است که در سپسیس، عفونتهای ناشی از پاتوژنهای متنوع عامل التهاب می باشند. دانشمندان پیشنهاد دادند که سیستم ایمنی ذاتی، محرکهای مشخصی را از طریق رسپتورهای شناسایی کننده الگو (PRR ها) تشخیص میدهد که به مسیرهای سیگنالینگ مولکولی خاصی منتهی می شود که منجر به پاسخ التهابی خواهند شد. پس محرکها در سپسیس و SIRS کدامند؟
دانشمندان کشف کرده اند که سیستم ایمنی ذاتی از PRRها به عناون سنسورهای میکروبی استفاده می کند تا مجموعهای از مولکول های حفظ شده در طول تکامل را که در انواع مختلف پاتوژنها یافت می شوند، شناسایی کند. این مولکولها مجموعا با نام الگوهای مولکولی مرتبط با پاتوژن یا PAMPها، شناخته شده و و در انواع فراوانی از میکروارگانیسمها، از جمله آنهایی که غیربیماریزا هستند، بیان میشوند. در بیمارانی که دارای عفونتهای شدید از جمله سپسیس هستند، PAMPها محرکهای اصلی پاسخ التهابی میباشند.
در سال ۱۹۹۴، Polly Matzinger پیشنهاد کرد که سیستم ایمنی نه تنها به پاتوژنها، بلکه به هشدارهای داخل سلولی که در شرایط رهاسازی مولکولهای داخل سلولی در بدن ایجاد می شوند نیز پاسخ می دهد. در طی سالهای بعد، دانشمندان نشان دادند که مولکولهای داخل سلولی فراوانی از بافتهای آسیبدیده ایجاد میشوند که به نام الگوهای مولکولی مرتبط با آسیب (DAMPها) شناخته میشوند. DAMPها قادر به آغاز پاسخهای التهابی یکسانی با PAMPها هستند، حتی در صورتی که عفونت میکروبی خاصی وجود نداشته باشد. سوال این است که چرا مسیرهای سیگنالینگی که در سپسیس توسط PAMP ها (محرکهای خارجی) و در SIRS مشابه DAMPها (محرکهای داخلی) ایجاد میشوند، در این حد مشابه هستند و آیا این مسیرها با یکدیگر همپوشانی دارند؟
به نظر میرسد که دانش ما از میتوکندریها (این که در طی تکامل از باکتری ها مشتق شده اند و موتیفهای ساختاری یکسانی را با یوکاریوتها دارند)، میتواند نشان دهد که چرا مسیرهای سیگنالینگی که توسط محرکهای داخلی و خارجی فعال میشوند در این حد شبیه هم هستند. Qin Zhang و همکارانش با این ذهنیت، فرضیهای جالب پیشنهاد کردند: ممکن است پروتئینها و DNAهای میتوکندریایی به عنوان DAMP عمل کرده و مسیرهای مشابهی با PAMPها را فعال نمایند. این فرضیه میتواند مشابهت های میان پاسخ ایمنی به عفونت و پاسخ ایمنی به تروما را بیان کند.
میتوکندریها و باکتریها از مکانیسم یکسانی برای تحریک پاسخ ایمنی استفاده می کنند
Zhang و همکارانش به منظور فراهم کردن شواهدی برای اثبات نظریه شان، رهاسازی DAMPها را در بیماران دچار تروما یا آسیب فیزیکی شدید بررسی کردند. با در نظر گرفتن این فرض که میتوکندریها از باکتریها حاصل شدهاند، آنها به دنبال دو PAMP باکتریایی شناخته شده گشتند: DNA و پپتیدهای فرمیل. در یکی از آزمایشات، آنان میزان رهاسازی DNA میتوکندریایی به داخل جریان خون بیماران ترومایی شدید را اندازه گرفتند. همان طور که انتظار داشتند، مقادیر فراوانی از DNA میتوکندریایی در جریان خون این بیماران در مقایسه با گروه کنترل داوطلب (که فاقد آسیب فیزیکی بودند) وجود داشت. آنها همچنین مقادیر بالایی از DNA میتوکندریایی را پس از جا انداختن استخوانهای شکسته توسط پزشکان ارتوپد شناسایی کردند. هر دو این اندازهگیریهای پس از وقوع آسیب تایید کرد که DAMPهای مخصوص میتوکندریها پس از آسیبهای شدید به داخل جریان خون آزاد میشوند.
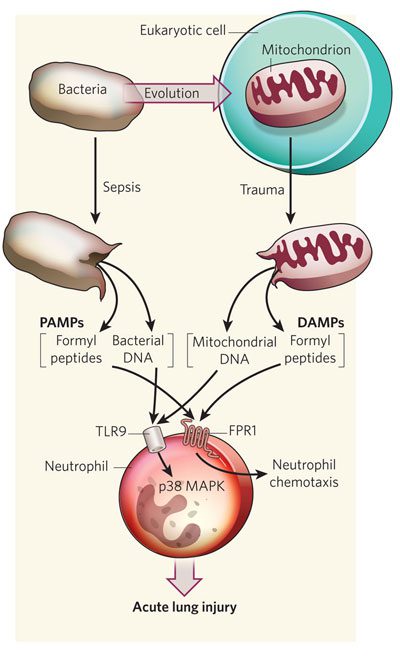
این میتوکندریها از کجا می آیند؟ به احتمال زیاد، آسیب ها باعث لیز سلولی، تجزیه و از هم پاشیدگی بافتی و نکروز میشوند. در نتیجه، محتویات سلولی مانند میتوکندریهای آسیب دیده آزاد میگردند. از آنجایی که هر سلول حاوی چندین میتوکندری است و هزران سلول در بافتهای ما وجود دارند، ترومای شدید میتواند منجر به رهاسازی مقادیر زیادی از DAMPهای میتوکندریایی به داخل خون شود.
در آزمایشی دیگر، گروه Zhang بررسی کرد که چگونه DAMPهای مشتق از میتوکندری پاسخ ایمنی را فعال میکنند. تنها باکتریها و میتوکندریها دارای پروتئین های N-formylated هستند. درنتیجه آنها تنها منابع پپتیدهای N-فرمیل در طبیعت میباشند. پپتیدهای فرمیل میتوانند نوتروفیلها را که در ایمنی ذاتی نقشی اساسی دارند به خود جذب نمایند. آنها همچنین میتوانند فعالسازی نوتروفیلها را با اتصال به formyl peptide receptor-1 یا FPR1 که در سطح این سلولها وجود دارند، انجام دهند. فعالسازی نوتروفیلها، پاسخ التهابی را با رهاسازی واسطههای شیمیایی و فعالسازی آنزیمهایی به نام MAP کینازها تحریک میکند. با استفاده از DAMPهای مشتق از میتوکندریها، دانشمندان میتوانستند FRP1 و MAP کینازها را فعال کنندکه تاییدی بر حضور پپتیدهای فرمیل در DAMPهای میتوکندریایی بود. DNA میتوکندری همچنین میتواند از طریق رسپتور خاصی به نام TLR-9 که در سطح نوتروفیلها قرار دارد، به آنها متصل شود. TLR-9 عضوی از خانواده PRRها است. با اتصال به TLR-9، DNA میتوکندریایی میتواند MAP کینازها را فعال نماید. گروه Zhang نتیجه گرفتند که پاسخ ایمنی به آسیب، از سپسیس تقلید میکند؛ چون DNA میتوکندریایی میتواند نوتروفیلها را از طریق PRRها و FPR1ها که در حالت عادی از طریق PAMPهای باکتریایی فعال میشوند را تحریک نماید.
احتمالا جالبترین پرسشی که Zhang و همکارانش مطرح کردند این بود که آیا DAMPهای میتوکندریایی در گردش نیز میتوانند باعث آسیب به واسطه نوتروفیل ارگانها شوند. به منظور پاسخ به این پرسش، آنها DAMPهای میتوکندریایی را به صورت داخل وریدی به موشها تزریق کردند تا امکان ایجاد آسیب ارگانها در داخل بدن را بررسی نمایند. پس از موجهه با DAMPها، جانوران کشته شده و نمونههای گرفته شده از ارگانهای آنها رنگآمیزی و زیر میکروسکوپ مشاهده شد. آنها دریافتند که DAMPهای میتوکندریایی در بافتهای مختلف ایجاد التهاب میکنند که از جمله آنها آسیب التهابی ریوی است و عامل اصلی ایست تنفسی در بیماران بحرانی میباشد. در موشهای گروه کنترل، شواهدی از التهاب وجود نداشت.
در پژوهشهای علمی، اکتشافات جدید، حتی سوالات بیشتری را نیز مطرح میکنند. آیا DAMPهای دیگری نیز وجود دارند که مرتبط با ترکیبات میتوکندریایی بوده و باعث تحریک پاسخ ایمنی به تروما گردند؟ آیا مقدار DAMPهای میتوکندریایی که پس از تروما آزادسازی میشود، به تظاهرات بالینی بیمار ارتباطی دارد؟ به علاوه، آیا مقادیر فراوان DAMPهای در گردش میتوانند به عنوان مارکری برای پیشبینی شدت پاسخهای التهابی و مرگومیر به کار روند؟
