چه عاملی سلولهای سرطانی را به سمت تکثیر خارج از کنترل هدایت میکند؟ مطالعاتی که روی پروتوانکوژنها انجام شده است، سرنخهایی را در مورد نحوه وقوع جهش در فرایندهای سلولی و انحراف آنها از روند طبیعی را آشکار میکند.
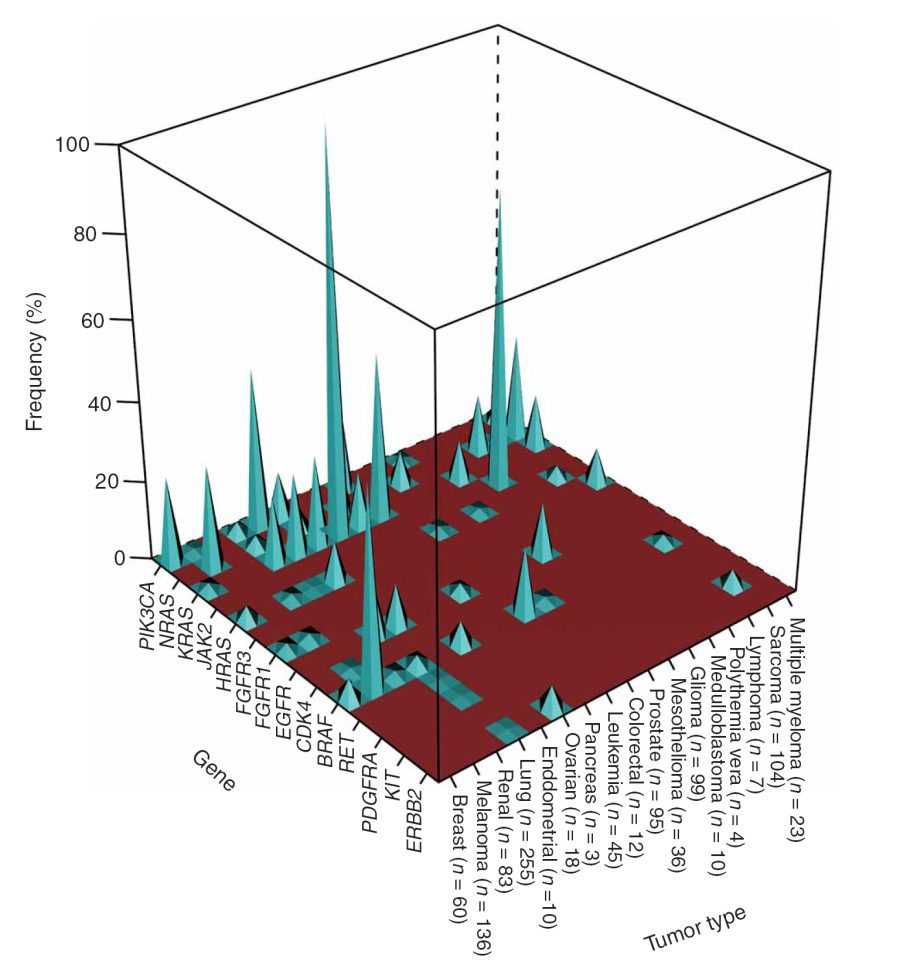
تصویر ۱. فراوانی جهشهای انکوژنی در میان انواع مختلف تومور؛ فراوانیها (محور y) با استفاده از درصد نمونههای توموری با نوع ذکرشده (محور x) که دارای جهشی انکوژنی بودند (محور z) و در مقایسه با تعداد کلی نمونههای مخصوص آن نوع از تومور محاسبه شدهاند.
مقدمهای بر پروتوانکوژنها
پروتوانکوژنها دستهای از ژنها هستند که در صورت ایجاد جهش در آنها، سلولهای نرمال سرطانی خواهند شد. جهشهای پروتوانکوژنها معمولا از نوع غالب هستند و نوع جهشیافته آنها، انکوژن نامیده میشود. پروتوانکوژنها غالبا پروتئینهایی را کد میکنند که در تحریک تقسیم سلولی، مهار تمایز سلولی و جلوگیری از مرگ سلولی است. تمامی این فرایندها برای رشد طبیعی انسان و حفظ بافتها و ارگانها لازمند. این فنوتیپها در مجموع فنوتیپ سلولهای سرطانی را شامل میشوند. درنتجیه، انکوژنها امروزه منبع مولکولی مهمی برای طراحی داروهای ضدسرطان میباشند.
ویروسهایی که کنترل DNA میزبان را به دست میگیرند
ویروسها علاوه بر بیماریهایی مانند سرماخوردگی عادی، آنفلوانزا و ذاتالریه، سرطان را نیز ایجاد میکنند. دانشمندی آمریکایی به نام پیتون روس، نخستین ویروس مولد تومور را شناسایی نمود. این ویروس، Rous sarcoma virus نام دارد و در اوایل قرن بیستم شناسایی شده است. روس، هنگامی که در حال مطالعه بر روی سرایت تومور در مرغها بود، دریافت که میتوان با تزریق قطعات کوچکی از تومور گرفته شده از مرغهای مبتلا به سرطان، میتوان تشکیل تومور را در مرغهای سالم نیز القا نمود. روس سپس عصارهای از تومورهای مرغ را فراهم کرده و آنها را از فیلترهایی با منافذی کوچک رد کرد که اجازه عبور باکتریها را نمیدادند. وی مشاهده کرد که حتی این عصارههای فاقد سلول نیز تشکیل تومور را در مرغهای سالم القا کردند. از آنجایی که اندازه حفرات فیلتر به حدی کوچک نبود که به ویروسها اجازه عبور ندهد، روس نتیجه گرفت که احتمالا یک ویروس در القای تشکیل تومور دخیل بوده است.
روس به علت این اکتشاف مهم خود، در سال ۱۹۶۶ برنده جایزه نوبل شد. در سخنرانی نوبل خود، روس از مطالعات Ellerman و Bang که در سال ۱۹۰۸ دریافته بودند که فیلترایی حاوی ویروس می تواند لوسمی را به مرغها سرایت دهد، تقدیر به عمل آورد. علیرغم این یافتهها، کشف Ellerman و Bang در آن زمان چندان شناخته نشد، چون ارتباط لوسمی با سرطان هنوز معین نبود.
روس اولین فرد از بین چندین دانشمند برنده نوبلی بود که لینکهای ناشناخته میان Rous sarcoma virus و سرطان را آشکار کردند. به عنوان مثال، بعدها آزمایشاتی که توسط David Baltimore، Howard Tenin و Renato Dulbecco انجام شد، نشان دادند که Rous sarcoma virus یک رتروویروس است. این مجموعه مطالعات برنده جایزه نوبل گردیدند. به علاوه، در سال ۱۹۷۵، Micheal Bishop و Harold Varmus نتیجه گرفتند که ژن ویروسی Rous sarcoma که باعث سرطان میشد، در واقع ژن میزبانی بود که توسط ویروس تغیر یافته بود. پروتوانکوژن سلول میزبان c-src و انکوژن ویروسی Rous sarcoma، v-src نامیده میشود. Bishop و Varmus سویههای مختلفی از ویروس Rous sarcoma را در تحقیقات خود به کار برده و در تمامی سویهها، انکوژن v-src مسئول ایجاد سرطان بود. این دانشمندان شروع به تولید پروب نوکلئیکاسیدی به منظور استفاده در آزمایشات هیبریداسیون کردند و دریافتند که ژن c-src در ژنوم بسیاری از گونهها حضور دارد. آنها سپس نشان دادند که ژن c-src موجود در میزبان به طور طبیعی در تنظیم مثبت رشد و تقسیم سلولی درگیر است. با این حال به دنبال عفونت، انکوژنv-src در سطوح بالایی در سلول میزبان بیان شده و منجر به رشد خارج از کنترل سلول میزبان، تقسیم سلولی بیرویه و سرطان میگشت.
با وجود اینکه ویروس Rous sarcoma قادر به آلودهسازی سلولهای انسانی نیست، انسانها خود دارای ورژنی از ژن c-src هستند که SRC نامیده میشود. سطح بالای بیان SRC با انواع مختلفی از سرطانهای انسانی در ارتباط است.
از خوب به بد: چگونه پروتوانکوژنها به انکوژنها تبدیل میشوند؟
امروزه بیش از ۴۰ پروتوانکوژن مختلف انسانی شناخته شده اند. اما کدام نوع از جهشها، این پروتوانکوژنها را به انکوژن تبدیل میکنند؟ پاسخ ساده است: انکوژنها درنتیجه جهشهایی حاصل میشوند که سطح بیان و یا میزان فعالیت پروتوانکوژنها را افزایش میدهند. مکانیسمهای ژنتیکی مرتبط با فعالشدن انکوژنها از قرار زیر می باشند:
- جهشهای نقطهای، حذفی و یا الحاقی که باعث تولید محصول ژن هایپراکتیو میشوند
- جهشهای نقطهای، حذفی و یا الحاقی در ناحیه پروموتر پروتوانکوژن که منجر به افزایش رونویسی میگردند
- رویدادهای تکثیر ژنی که منجر به افزایش تعداد نسخههای کروموزمی پروتوانکوژن میگردند
- رویدادهای جابهجایی کروموزومی که باعث جابهجایی پروتوانکوژن به جایگاه کروموزومی جدید شده و در نتیجه سطح بیان بالاتر رود
- جابهجاییهای کروموزومی که منجر به اتصال پروتوانکوژن به ژن دومی شود که پروتئین fusionای با فعالیت انکوژنیک ایجاد نماید.
مثالهایی از انکوژنها

پروتوانکوژنهای زیادی وجود دارند که نقش مهمی را در امبریوژنز بازی میکنند. نقش این ژنها در این فرایند، تحریک رشد و تکثیر سلولی در حین رشد ارگانیسم است. همچنین برخی از پروتوانکوژنها در تنظیم منفی تمایز سلولی دخالت دارند. فعالیتهای پروتوانکوژنی مهمولا با تکمیل فرایندهای رشدی که در تنظیم آنها دخالت دارند، پایان مییابد. با این حال، در صورتیکه فعالیت پروتوانکوژنیک بالا باقی بماند، و یا اینکه این فرایندها به صورت نابهجایی مجددا فعال گردند، ممکن است سرطان رخ بدهد.
تعدادی از پروتوانکوژنها رسپتورهایی را در سطح سلول کد میکنند که در طول غشا امتداد داشته و پلی ارتباطی را میان محیط داخل و خارج سلولی برقرار میسازند. این رسپتورهای خلال غشایی متشکل از سه بخش میباشند: ناحیه خارج سلولی که در سطح غشا بوده و مانند آنتنی عمل میکند که سیگنالهای خارج سلولی را جمعآوری میکند؛ ناحیه خلال غشایی که از عرض غشا عبور میکند؛ و ناحیه داخل سلولی که دارای فعالیت آنزیمی مخصوص به خود بوده و میتواند به سایر پروتئینهای واقع در داخل سلول مرتبط شود.
سلولها برای آنکه بتوانند رشد شوند و تکثیر یابند، باید بتوانند از طریق نواحی خارجسلولی گیرندههای خلال غشایی خود به لیگاندهای خارج سلولی اتصال یابند. غالبا این لیگاندها فاکتورهای رشدی هستند که تقسیم سلولی و رشد را تحریک میکنند و با فاکتورهای آنژیوژنیکی میباشند که تولید عروق خونی جدید را باعث میشوند. زمانی که یک لیگاند به رسپتور خود متصل میشود، تغییرات کانفورماسیونی مکرری در رسپتور ایجاد شده و در نهایت منجر به فعال شدن دومین داخل سلولی و زنجیرهای از وقایع داخل سلولی میگردد که رشد، تکثیر، آنژیوژنز و مرگ سلولی را تنظیم میکنند. از جمله رسپتورهای پروتوانکوژنی، EGFR است که رسپتور فاکتور رشد اپیدرمی (EGF) میباشد. EGF در سیگنالینگ با واسطه فاکتور رشد دخالت دارد. KDR نیز رسپتور فاکتور رشد اندوتلیال عروقی (VEGF) است که در آنژیوژنز نقش دارد.
پروتوانکوژنها همچنین میتوانند پروتئینهای داخل سلولی را که در پاییندست مسیرهای مرتبط با رسپتورهای سطحی سلول عمل میکنند، کد کرده و رشد و تقسیم سلولی را تحریک کنند. از جمله این پروتئینهای سیگنالینگ پاییندست، HRAS و KRAS است. به علاوه، تعدادی از پروتوانکوژنها از جمله cyclin D1 (CCND1) و cyclin E1 (CCNE1) در حالت نرمال باعث میشوند که سلول با دریافت سیگنال مناسب، در مراحل مشخصی از چرخه سلولی پیش برود. هنگامی که این پروتوانکوژنها در سطوحی بالاتر از سطح نرمال بیان شوند، یا بیان آنها در موقعیت نامناسبی روشن گردد، سرطان میتواند اتفاق بیفتد.
فعالسازی انکوژنها میتواند حین فرایندهای جابهجایی کروموزومی نیز رخ دهد. کروموزوم فیلادلفیا که در سال ۱۹۶۰ شناسایی شد، بهترین نمونه جابهجایی کروموزومی انکوژنیک است. در این مورد، یکی از انتهاهای کروم وزوم ۹ با یکی از انتهاهای کروموزوم ۲۲ تعویض میگردد. در انتهای شکسته کروموزوم ۲۲، ژن BCR قرار دارد که با قطعهای از کروموزوم ۹ که حام ل ژن ABL1 است، اتصال مییابد. این کروموزم fuse شده، کروموزوم فیلادلفیا نام دارد. با اتصال انتهاهای کروموزمی، دو ژن نیز به همدیگر اتصال مییابند تا BCR-ABL را تشکیل دهند. این ژن بیان شده و پروتئینی را کد میکند که فعالیت تیروزینکینازی بالایی دارد. بیان تنظیمنشده این پروتئین، دستهای از پروتئینهای دیگر را فعال میکند که در تنظیم چرخه سلولی و تحریک تقسیم سلولی دخیل هستند. در نتیجه، کروموزم فیلادلفیا با لوسمی میلوئیدی مزمن (chronic myelogenous leukemia (CML)) و بسیاری از انواع دیگر لوسمی در ارتباط میباشد.
هدفگیری addiction انکوژن به منظور درمان سرطان
برخی از انواع سرطان در اوایل زندگی رخ میدهند و با جهشهایی تکژنی در ارتباط هستند. به عنوان مثال، رتینوبلاستوما که نوعی از سرطان رتین است که در کودکی رخ میدهد، در اثر جهشهایی در ژن RB1 ایجاد میشود. این ژن، نوعی ژن سرکوبکننده تومور است. با این حال، سرطان فرایندی چندمرحلهای است که طی آن سلولها مجموعهای از جهشها را کسب کرده و عملکرد ژنهای سرکوبکننده تومور به ترتیب کاهش و افزایش می یابد. نتیجه نهایی، جمعیتی هتروژن از سلولها است که تقسیم سلولی خارج از کنترلی داشته و به سرعت تقسیم میشوند. این سلولها معمولا نمیتوانند به سیگنالهایی پاسخ دهند که در شرایط نرمال میتوانست منجر به مرگ سلولی شود.
سلولهای سرطانی تقریبا همیشه حاوی تعدادی غیرعادی از کروموزمها هستند که آنوپلوئیدی نامیده میشود. این پدیده منجر به تغییر دوزاژ و بیان همه ژنهای واقع در کروموزم موردنظر خواهد شد. با رشد و تقسیم سریع سلولهای سرطانی، کروموزم های اضافی به طور ناهنجاری از یکدیگر جدا شده و تغییرات دیگری نیز در تعداد کروموزمها با ادامه تقسیم پدید میآید. این ویژگی سلولهای سرطانی، ناپایداری ژنتیکی نامیده میشود.
در صورتیکه سلولهای سرطانی در این حد در معرض تغییر باشند، چگونه ممکن است که بتوان تمام مولکولهای متفاوت موردنیاز برای مهار بیان و یا تکثیر آنها را هدفگیری نمود؟ محققان امروزه باور دارند که سلولهای سرطانی برای رشد، تکثیر و بقا به جهشهای انکوژنیکی خاصی بیشتر از سایرین نیازمند باشند. این مفهوم، oncogenic addiction نام گرفته است. بنابراین، با هدف قرار دادن فعالیت انکوژنی خاص که در نوع معینی از سرطان نقشی اساسی دارد، خواهیم توانست علی رغم حضور سایر جهشها و تعداد همواره در حال تغییر کروموزمها، به طور موثری سلولهای سرطانی را هدف قرار دهیم. جدول ۱ لیستی از انکوژنهای انسانی را نشان میدهد که با oncogene addiction مرتبط میباشند. مهار بیان این ژنها در ردههای سلولی سرطانی انسان منجر به مهار رشد، کاهش توانایی تشکیل تومورها و در برخی از موارد، منجر به افزایش حساسیت نسبت به داروهای شیمیدرمانی میشود. جدول ۲ لیستی از انکوژنهای انسانی را فراهم کرده است که میتوانند با داروهایی خاص، با یا بدون شیمیدرمانی، و در انواع مشخصی از سلولهای سرطانی هدف قرار بگیرند.
همانطور که قبلا نیز بحث شد، CML با رویدادهای جابهجایی کروموزومی خاصی مرتبط است که منجر به تولید پروتئین fusionای میشود که متشکل از BCR و ABL میباشد. شواهد دال بر وجود oncogene addiction در سلولهای بیانکننده BCR-ABL، از مطالعاتی به دست آمده که در آنها از imatinib، که نوعی مهارکننده ABL kinase است و برای درمان بیماران CML به کار میرود، استاده شده است. این دارو که فعالیت تیروزین کینازی ABL را هدف قرار میدهد، یکی از بزرگترین موفقیتهای درمان سرطان در دو دهه اخیر بوده است. توانایی درمان موفقیت آمیز بیماران CML با دارویی که تنها یک مولکول انکوژنیک را هدف قرار میدهد، یکی از اثباتکنندههای نظریه oncogene addiction است. با این حال، مطالعات بالینی طولانیمدتتری که با استفاده از imatinib برای درمان بیمارانCML صورت گرفتهاند، نشان میدهند که برخی از بیماران ممکن است با گذر زمان، علائمی از مقاومت دارویی را نشان دهند.
امروزه، محققان آکادمیک، کمپانیهای بیوتک و دارویی در حال تلاش برای کشف روشهایی به منظور هدفگیری فعالیت انکوژنها هستند. رویکردهایی که تاکنون به کار گرفته شده اند، عبارت است از استفاده از داروهایی که به رسپتورمتصل شده و فعالیت آن را مهار میکنند، مولکولهای RNA کوچکی که بیان انکوژنها را تنظیم میکنند، و داروهایی که فعالیت پروتئینهای سیگنالینگ موجود در پاییندست را مهار میکنند. توانایی سلولهای سرطانی در تکامل سریع، در ترکیب با طبیعت هتروژن جمعیت سلولهای سرطانی، در سالهای پیشرو محققان را بیشتر به چالش خواهد کشید. پس همان طور که سلولهای سرطانی دائما در حال تکامل هستند، رویکرد ما به درمان سرطان نیز باید همواره در حال تکامل باشد.
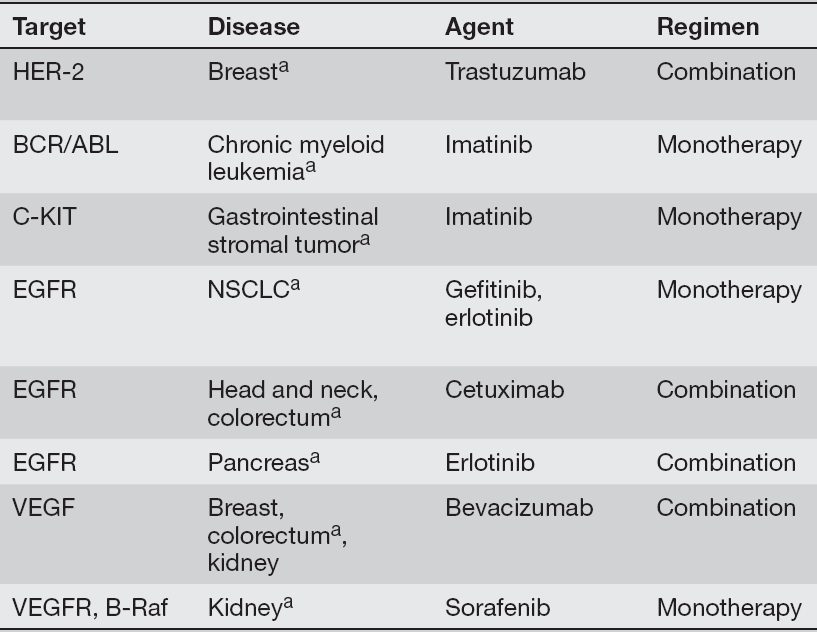
جدول ۱. شواهد کلینیک oncogene addiction؛ برنامه درمانی شامل استفاده از دارو به تنهایی (مونوتراپی) و یا در ترکیب با موادی سایتوتوکسیک است (combination).
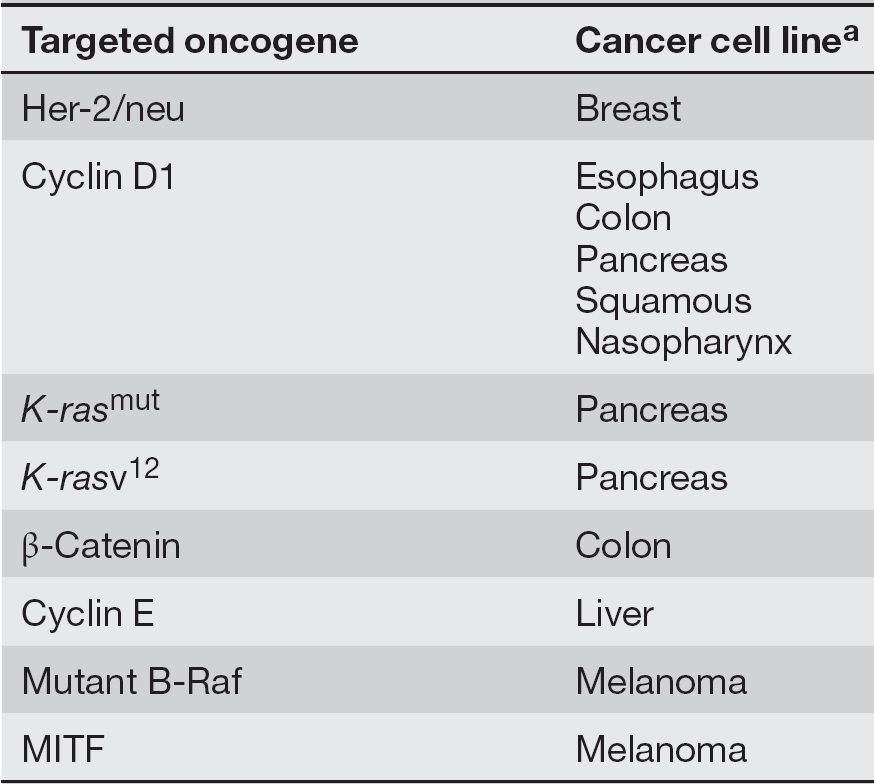
جدول ۲. مثالهایی از oncogene addiction در انسان: مطالعات انجام گرفته بر روی ردیفهای سلولهای سرطانی انسانی؛ درمان این ردیفهای سلولی با الیگونوکلئوتید antisense و یا RNAiای که مستقیما انکوژن مربوطه را هدف قرار میدهد، باعث مهار رشد و در برخی از موارد باعث کاهش تومورژنز و افزایش حساسیت به شیمی درمانی خواهد شد.
