آلدهیدها مولکول های بسیار واکنش پذیری هستند؛ که می توانند از محیط وارد بدن شوند و یا با فرآیند متابولیک سلولی در بدن ساخته شوند. یکی از آلدهید هایی که در سلامتی انسان نقش دارد، استالدهید است، که به هنگام مصرف الکل در بدن تولید می شود. در صورتی که استالدهید در سلول ها انباشته شود، با دی ان ا(DNA) واکنش می دهد که می تواند دو رشته ی آن را به هم وصل کند. در این صورت شکل مضردی ان ا تحت عنوان آی سی الICL پدید می آید. آی سی ال ها برای تولید داروهای ضد سرطان، جهت ازبین بردن سلول های تومور استفاده می شوند. در ادامه به مکانیسم های ترمیم دی ان ا ناشی از مصرف الکل خواهیم پرداخت.
Hodskinson و همکارانش درباره ی مکانیسم ترمیم آی سی ال ناشی از استالدهید را که (نسبت به سایر روش ها) معمول تر است درNature گزارشی نوشته اند.
سندروم کم خونی فانکونی چیست؟
عدم توانایی ترمیم آی سی ال ها ، با سندروم نادر کم خونی فانکونی ارتباط دارد. این شرایط بر اثر جهش در یکی از ۲۲ ژن FANC که پروتئین های ترمیم آی سی ال رمز گذاری می کنند، رخ می دهد.
نشانه های کم خونی فانکونی
افراد دارای کم خونی فانکونی، نارسایی مغز استخوان و پیری زودرس را تجربه می کنند و احتمال ابتلا به سرطان نیز در این افراد زیاد است.
در سال های ۱۹۷۰ دانشمندان می دانستند که سلول های افراد مبتلا به آنمی فانکونی نسبت به داروهای محرک آی سی ال حساس هستند. مکانیسم ترمیم این آسیب دیدگی ناشناخته بود؛ تا اینکه در سال ۲۰۱۱، دانشمندان شواهد ژنتیکی یافتند که نشان می داد: علت آسیب دی ان ا ناشی از استالدهید، همان دارو های محرک آی سی ال است. برای پاکسازی استالدهید از سلول ها، جهت جلوگیری از آسیب دی ان ا، بعد از تطبیق و آزمایش ها با بدن موش آشکار شد که دو سطح برای سیستم حفاظت از مولکول های فعال وجود دارد.
سطوح مختلف این مکانیسم چگونه عمل می کنند؟
نخستین سطح حفاظت آنزیم آلدهید دهیدروژناز۲ (ALDH2) است که استالدهید را به مولکول های استات بی خطر تبدیل می کند. غیر فعال شدن این آنزیم، در بین مردم آسیا شایع است که با شیوع آن منجر به افزایش سرطان های ناشی از الکل می شود. سطح دوم ترمیم آسیب دی ان ا، ناشی از استالدهید است.
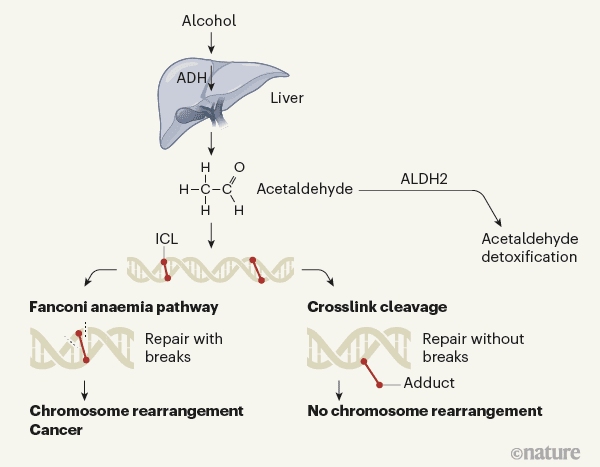
مکانیسم دفاعی سلول در برابر استالدهید. هنگامی که فرد الکل مصرف می کند، توسط آنزیم الکل دهیدروژناز(ADH) در کبد به استالدهید سمی تبدیل می شود. استالدهید می تواند توسط فرایند های متابولیکی تشکیل شود و یا از محیط بیرون وارد بدن شود. این ترکیب با آنزیم دیگری به نام آلدهید دهیدروژناز۲(ALDH2) سم زدایی می شود؛ اما گاهی اوقات در سلول تجمع می یابد که با آی سی ال ها بین پایه های مولکول دی ان ا شکل می گیرد. این آسیب می تواند از مسیر آنمی فانکونی ترمیم شود. فرآیند شامل شکسته شدن دی ان ا ها در دو طرف آی سی ال می باشد، البته شکستن دی ان ا می تواند خطرناک باشد و منجر به بازآرایی خطرناک کروموزوم و ایجاد سرطان شود. Hodskinson مسیر دوم ترمیم آی سی ال شرح می دهند؛ به این صورت که یک قسمت از رشته از دی ان ا بریده می شود. در این روش یک رشته دی ان ا ترمیم می یابد و رشته ی دیگر حاوی یک ترکیب اضافی می باشد. مزیت این مسیر، جلوگیری از بازآرایی کروموزومی است.
آیا آی سی ال های ناشی از استالدهید در افراد مبتلا به کم خونی فانکونی تجمع می یابد؟
از آن جایی که غیرفعال کردن FANC و ALDH2 ژن ها خصوصیات کم خونی فانکونی را در موش ها تکرار می کنند، گمان می رود که آی سی ال مواد زاید سلولی (مرگ سلول) هستند، که توسط استالدهید ایجاد شده اند. مطابق با این دیدگاه، مشاهده شده است که شدت آنمی فانکونی با جهش آنزیم ALDH2 درافراد ژاپنی دارای کم خونی فانکونی ارتباط دارد. با این حال مطالعه ی مستقیم این پیوندهای عرضی (crosslink) در سیستم های سلولی و داخل بدن با استفاده از فناوری های موجود امکان پذیر نیست. بنابر این آیا آی سی ال های ناشی از استالدهید در افراد مبتلا به کم خونی فانکونی تجمع می یابد یا خیر؟! یکی از سوالات مهمی است که هنوز به پاسخی دست نیافته اند.
قبلا در سیستم کشتin vitro) cell-free) که از تخم های قورباغه استفاده شده بود، گزارشی مبتنی بر مطالعه ی گسترده ی مکانیسم های ترمیم آی سی ال ناشی از دیگر عوامل مانند داروهای ضد سرطان(مانند سیس پلاتین) داده شده بود. این سیسیتم اجازه می دهد تا دی ان ا حاوی ضایعه ی خاص تجزیه و تحلیل شوند. در مواردی آی سی ال ناشی از سیس پلاتین سیستم cell- free، یک مکانیسم پیشرفته ی ترمیم را نشان می دهد که وابسته به پروتئین FANC است. این روش ترمیم، نیازمند تکثیر دی ان ا است که سپس رشته ها را برش داده و آی سی ال از آن جدا می گردد.
Hodskinson و همکارانش این چالش بزرگ سنتز مولکول دی ان ا که شامل محل اختصاصی برای استالدهید آی سی دل است را انجام دادند. آن ها نحوه ی ترمیم این ضایعه را در سیستم cell-free بررسی کردند و دریافتند که این این فرآیند ترمیم نیازمند مسیر فعال کم خونی فانکونی (مکانیسمی که پروتئین های FANC درگیر می کند.) است. این فرآیند با شواهد ژنتیکی مطابق است به طوری که پروتئین FANC در سیستم متشکل از دو سطح می باشد تا از آسیب استالدهید حفظ کند.
با این حال به طور غیر منتظره کشف کردند؛ که حدود نیمی از پیوند ها توسط مکانیسم دوم سریع تر ثابت شده اند. تحقیقات بیشتر نشان می دهد که مکانیسم دوم شامل تکثیر دی ان ا که مستقل از مسیرآنمی فانکونی می باشد.
مکانیسم سطح دوم ترمیم دی ان ا نسبت به سطح اول چیست؟
به طور شگفت انگیزی در مسیر سریع یا دوم، در رشته های دی ان ا هیچ برشی ایجاد نمی شود، در عوض احتمالا آی سی ال است که از پیوند قطع می شود. در این روش ترمیمی، منجر به بازگشت رشته ی بریده شده به رشته ی سالم دی ان ا می شود، اما یک ترکیب اضافی را در رشته به جای می گذارد که آنزیم های اختصاصی همانند سازی دی ان ا به طور کامل ترمیم می کنند. این مکانیسم یاد آور این است که آی سی ال توسط داروی پسورالن با آنزیم های مختلف برطرف می شود.
مکانیسم ترمیم سریع با جلوگیری از قطع شدن دی ان ا که با بازآرایی ژنومی اتفاق می افتد که از نشانه های سرطان و پیری است مزیت مهمی را نسبت به مسیر آنمی فانکونی دارد.
داده های جمع آوری شده ی Hodskinson و همکارانش، نگاهی اجمالی به مکانیسم پاکسازی دی ان ا از استالدهید را دارد و از ایده ی کمک کردن ضایعات به مسیرFA حمایت می کنند.
آیا نقش این پروتئین ها خود به خودی است؟
نویسندگان پروتئین هایی که باعث شناسایی مسیر جدید بعد از ترمیم پیوند می شوند، هنوز شناسایی نکرده اند. بنابر این فقط می توان حدس زد که آیا این پروتئین ها خودبه خودی بوده و به عنوان نیروهای مکانیکی در باز شدن دی ان ا به هنگام تکثیر آن نقش داشته اند یا عمل آن ها نتیجه ی فعالیت آنزیمی است. اگر این فعالیت ناشی از فرآیند آنزیمی باشد چالش جدیدی برای شناسایی اجزای آن خواهد بود. همچنین می تواند فرصت هایی را برای درمان ایجاد کند مانند تحریک مسیر می تواند علایم فانکونی را کاهش داده و از بروز سرطان هایی که در اثر الکل ایجاد می شود جلوگیری کند.
شناسایی پروتئین های درگیر در تقسیم پیوند عرضی در آزمایش های درون جاندار(in vivo) صورت می گیرد که تست می کنند: اختلال در مسیر ترمیم جایگزینی سبب افزایش سمیت استالدهید می شود، به خصوص در شرایطی که مولکول توسط متابولیسم سم زدایی نمی شود. علاوه بر این جهش در پروتئین های درگیر این مسیر می تواند گروه جدیدی از افراد مبتلا به کم خونی فانکونی را پدید آورد. Hodskinson و همکارانش به توسعه ی سنجش های لازم برای مطالعه ی آی سی ال و سایر آسیب های دیگر دی ان ا تاکید کردند. با مطالعه ی ترمیم دی ان ا ناشی از آسیب های استالدهید و سایر جهش هایی که در بدن به وجود می آیند ما احتمالا سایر مکانیسم های دفاعی سلولی را در برابر آسیب دی ان ا و سمیت سلولی کشف خواهیم کرد.
