مرگ سلولی طی فرآیندی به نام آپوپتوز، التهاب بافت مجاورش را مهار می کند. یافته ها حاکی از آن هستند که سلول های آپوپتوتیک بستر مناسبی برای آزاد سازی متابولیت ها هستند؛ روشی که بر سلول های مجاور خود تاثیر می گذارند.
مارلی بدون شک مرده بود. در سطرهای آغازین رمان سرود کریسمس چارلز دیکنز، ایده ی مرگ را به شما منتقل می کند؛ ایده ای که تفکر ما را درباره ی مرگ و میر سلول ها به خود مشغول می کند. توصیف دیکنز از مارلی، به as dead as a doornail از چارلز هریس تشبیه شده است؛ اما مارلی شخصیتی فراتر ازEbenezer Scrooge برای تاثیرگیری از قبر داشت؛ به طوریکه سلول ها می میرند و می توانند تاثیر حیاتی بر روی سلول های زنده اطراف خود بگذارند. مدینا و همکارانش در مجله ی Nature درباره ی فرآیند های متابولیکی که به هنگام مرگ سلول عواقب مهمی بر دیگر ارگانیسم ها دارند، مطالعه کردند.
چرا سلول ها می میرند؟
در هر ثانیه میلیون ها سلول در اثر فرآیند های جزئی مانند گردش در بافت ها و در اثر پاسخ به فشار ناشی از استرس های محیطی می میرند. اکثر این فرآیند ها در قالب آپوپتوز اتفاق می افتند. آپوپتوز، نوعی خودکشی برنامه ریزی شده ی سلول است؛ که با آنزیم های عملکردی، نظیر کاسپاز ها، صدها پروتئین درون سلولی را تجزیه می کنند. این عمل تقسیم و تجزیه ی پروتیین، تنظیم کننده ی عملکرد آنزیم کاسپاز در سلول های در حال مرگ است که طی فرآیند منظمی بسته بندی می کنند.
دی ان آ در هسته به قطعات کوچک تبدیل شده و اسکلت سیتوپلاسمی پروتئین اکتین، برای شکسته شدن سلول و تبدیل به قطعات کوچک، دوباره بازسازی می شود. قرارگیری در معرض لیپید های خاص، روی سطح سلول به سلول های ایمنی ماکروفاژ ها سیگنال دهی می شود، سلول را در بر می گیرند و هضم می کنند.
آپوپتوز و پاسخ التهابی
از وقتی که توصیف اصلی آپوپتوز ارائه گردید، مشخص شد؛ این نوع مرگ سلولی برخلاف دیگر نوع مرگ سلولی، همانند نکروز پاسخ التهابی ایجاد نمی کند. بررسی های بعدی نشان داد مرگ سلولی ناشی از آپوپتوز ضد التهاب است؛ به طوریکه با استفاده از تزریق سلول های آپوپتوتیک برای کنترل بیماری های التهابی استفاده می شود.
التهاب ناشی از مرگ سلولی نکروتیک، باعث انتشار مولکول های منسوب به نام الگو های مولکولی مرتبط با آسیب (DAMPs) که چندین مورد از آن ها شناسایی شده است. درباره ی مکانیسم پایه خواص ضد التهابی سلول های آپوپتوتیک، اطلاعات محدود است. درگیری سلول های آپوپتوتیک با ماکروفاژها، باعث ترمیم بافت می شود و مولکول های مربوط به آپوپتوز مسئول این امر ناشناخته هستند.
درباره آپوپتوز بیشتر بدانیم:
درمانی جدیدی برای ایدز با گیر انداختن ویروس در سلول و نابودی آن از طریق آپوپتوز
شناسایی متابولیت ها
مدینا و همکارانش دریافتند؛
سلول های در حال مرگ پستانداران(از جمله سلول های انسانی) که در آزمایشگاه رشد کرده اند؛ مولکول های کوچک رها شده از سلول های در حال مرگ می توانند ماکروفاژها را برای بیان ژن های دخیل در ترمیم بافت فرا بخواند. ابتدا تصور می کردند که متابولیت ها- مولکول هایی که در اثر فرآیند های متابولیکی تولید می شوند- در این امر نقش دارند.
مدینا و همکارانش انواع مختلفی از سلول ها را که تحت تاثیر آپوپتوزیس قرار می گیرند، توضیح می دهند.
متابولیت های شناسایی شده از همه ی سلول های درحال مرگ آزاد می شوند؛ در حالی که سایر متابولیت های موجود در سلول ها آزاد نمی شوند. این حالت بیشتر به انتخاب کانال های پروتئینی خاص روی سلول ها (pannexin1(PANX1 مربوط است که هنگام فعالیت آنزیم کاسپاز این کانال ها باز می شوند. سلول های آپوپتوتیک مهندسی شده برای PANX1 ، متابولیت های مربوط به آپوپتوزیس را آزاد نمی کنند.
دانشمندان شش متابولیت آزاد شده از سلول های آپوپتوتیک را بررسی کردند و دریافتند؛ هیچکدام به تنهایی تاثیری بر بیان ژن های ماکروفاژها ندارند. به هر حال مجموعه ی شش متابولیت بر بیان ژن تاثیر زیادی دارند. حداقل ترکیبی از سه متابولیت این اثر را در ماکروفاژها القا می کند که این متابولیت ها عبارت اند از:
اسپرمیدین گوانوزین مونوفسفات و مونو فسفات اینوزین.
اثرات متابولیت ها بر بدن
نویسندگان گزارش می دهند؛ که مخلوط این متابولیت ها اثرات ضد التهابی قابل توجهی بر بدن دارند و در آرتریت و رد پیوند ریه در مدل سازی انجام شده بر موش ها، خواص ضد التهابی دارند.
اسپریمیدین و فرآیند تولید آن
اسپرمیدین نوعی مولکول پلی آمین است. این ماده عمدتا از یک مسیر متابولیکی تولید می شود؛ که ابتدا اسید آمینه آرژنین به حد واسط اورنیتین تبدیل می شود و سپس مولکول پلی آمین به وجود می آید. مدینا و همکارانش مسیر تبدیل آرژنین به اسپرمیدین ردیابی کردند و دریافتند که سلول های تحت تاثیر آپوپتوز، قبل از مرگشان به میزان قابل توجهی اسپرمیدین و پیش ماده ی آن، مولکول پتراسین را سنتز می کنند.
سلول های آپوپتوتیک، اسپریمیدین آزاد می کنند نه پتراسین! آزاد شدن اسپریمیدین وابسته به روش PANX1 است.
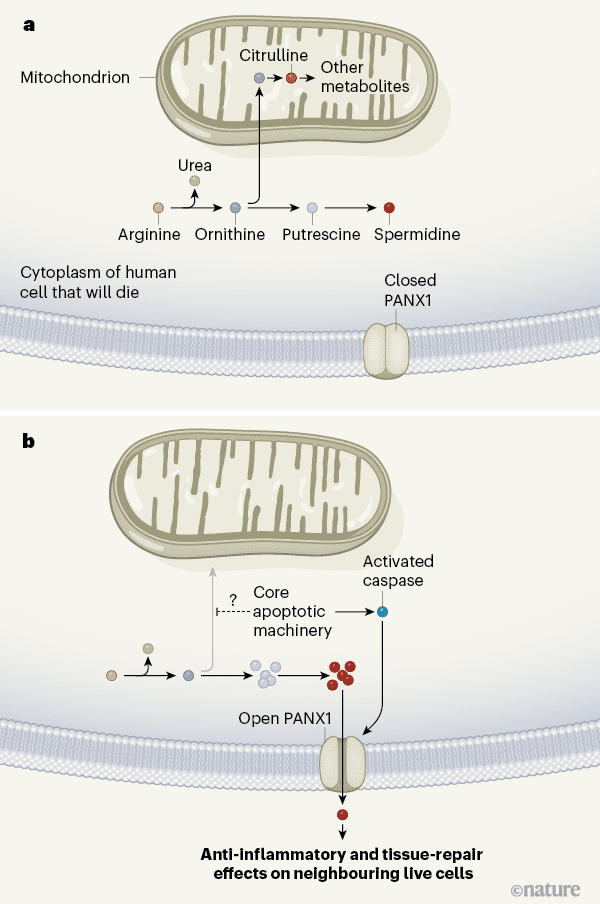
شکل ۱|سلول هایی که با فرآیندی به نام آپوپتوزیس، سلول های مجاور خود را درگیر می کند. مدینا و همكاران گزارش می دهند كه سلول های در حال مرگ انسان، مولكول هایی را توسط فرآیندهای متابولیكی آزاد می كنند و این متابولیت ها دارای اثرات ضد التهابی بوده و باعث ترمیم بافت می شوند. a در سلول های سالم انسان، آمینو اسید آرژینین اغلب به مولکول اورنیتین تبدیل می شود، که یا در مسیری مورد استفاده قرار می گیرد و مولکول اسپرمیدین را تولید می کند یا به میتوکندری (نوعی ارگانل) منتقل می شود، و در جایی به سیترولین تبدیل می شود. متابولیت های دیگر تا زمانی که سلول شروع به مرگ کند، پروتئین کانال روی سطح سلول بنام PANX1 بسته می ماند. b همانطور که سلول تحت آپوپتوزیس قرار می گیرد، مکانیسم های اصلی آپوپتوز آنزیم های کاسپازهای موسوم به کاسپازها را فعال می کنند، که PANX1 باز می کند و کانال باز می شود. تولید مولکول های اسپرمیدین و پوترسین از حد طبیعی بیشتر می شود. یک راه ممکن برای توضیح این امر در صورتی است که مجموعه عملکردی آپوپتوزیس مانع از ورود اورنیتین به میتوکندری شده و در عوض آن را به سمت تولید اسپرمیدین منحرف کند. اسپرمیدین و سایر متابولیت های خاص (نشان داده نشده است) به صورت انتخابی از طریق PANX1 منتشر می شوند و سلول های مجاور را تحت تأثیر قرار می دهند.
تاثیر داروی مقلد BH3 بر فرآیند آپوپتوز
اگرچه این پدیده با استفاده از تنها یک شرایط القاکننده آپوپتوز (یعنی اشعه ماوراء بنفش) مورد بررسی قرار گرفت، اما این یافته این احتمال را ایجاد می کند؛ که فعال شدن آپوپتوز، مسیر سنتز اسپرمیدین را هدایت می کند. نکته ی قابل توجه این موضوع، مشاهده نویسندگان از اثرات استفاده از نوعی دارویی به نام مقلدBH3 است. این دارو مستقیماً قدم اساسی در آپوپتوزیس، با نفوذپذیری اندامک میتوکندری تحت عنوان نفوذپذیری غشای بیرونی میتوکندری (MOMP) ایجاد می کند و استفاده از آن منجر به ترشح اسپرمیدین در سطوح قابل مقایسه با موارد مشاهده شده در آپوپتوزیس با واسطه اشعه ماوراء بنفش می شود. شاید MOMP مانع از انتقال اورنیتین به میتوکندری (جایی که اورنیتین به مولکول سیترولین تبدیل می شود) شده و تا مرحله ی تبدیل اورنیتین در مسیرهای سیتوپلاسمی که منجر به تولید اسپرمیدین می شود، جمع می گردد. این مدل می تواند در سلول های مهندسی شده که فاقد اجزای مورد نیاز برای MOMP باشد و در معرض داروی مقلد BH3 قرار گیرند مورد آزمایش باشند.
محصول جانبی:اوره
اوره مولکولی است که به عنوان محصول جانبی در فرآیند تبدیل آرژنین به اورنیتین تشکیل می شود.
اوره یک DAMP التهابی است که از سلول های نکروتیک آزاد می شود. نویسندگان مشخص نکرده اند که آیا طی فرآیند آپوپتوزیس آزاد می شود و یا خیر. با این حال مدینا و همکارانش مشاهده کردند؛ متابولیسم آرژنین به هنگام آپوپتوزیس افزایش می یابد. همچنین دریافتند درصورت عدم انتشار اوره از طریق PANX1، ممکن است بر اثر علت دیگری این التهاب را ایجاد کند. سیستم قدرتمندی مانند فروپتوزیس از مرگ سلول محافظت می کند.
چگونه اسپریمیدین مونوفسفات گوانوزین و مونوفسفات اینوزین را در پاسخ به ماکروفاژ ها آزاد می کند؟ و چگونه سه متابولیت فعالیت دسته جمعی دارند؟
گوانوزین مونوفسفات و اینوزین مونوفسفات به گیرنده های آدنوزین همراه با پروتئین G سیگنال می دهند؛ و اسپریمیدین می تواند در طیف گسترده ای شرکت کند. مولکول اینوزین(که می تواند از مونوفسفات اینوزین حاصل شود) خواص ضد التهابی دارد و می تواند در برابر سموم باکتریایی در موش، التهاب کشنده را مهار کند. ممکن است؛ اسپریمیدین، برای افزایش خواص ضد التهابی، از روش سیگنالینگ به گیرنده های آدنوزین اقدام کند.
مقایسه اثرات ضد التهابی بر روی سلول های انسان و موش
سلول های انسانی نسبت به سلول های موش، ده برابر حساسیت بیشتری نسبت به اثرات ضد التهابی اینوزین دارند. این تفاوت احتمالا به دلیل تفاوت در بیان ژن گیرنده های آدنوزین و عملکرد گیرنده ها در گونه وابسته است. بنابر این استفاده از این متابولیت ها برای درمان بیماری های انسانی به موضوعی چالش برانگیز تبدیل شده است.
مدینا و همکارانش روی چگونگی بروز آپوپتوزیس و چگونگی ایجاد تغییرات متابولیکی و انتشار این متابولیت ها تحقیقاتی انجام دادند. بر خلاف آپوپتوزیس، سایر اشکال مرگ سلولی، مانند اشکال تنظیم شده نکروز، تأثیرات بسیار متفاوتی بر سلول های مجاور دارند و اینکه چگونه تغییرات متابولیسمی ناشی از آن مسیرهای مرگ سلول بر روی سلول های مجاور آن ها تأثیر می گذارد، ناشناخته است.
نکروپتوز
سلول هایی که با نوعی نکروز تنظیم شده به نام نکروپتوز می میرند، همچنان می توانند مولکول هایی به نام سیتوکین ها را آزاد و ترشح کنند که روی التهاب تاثیر می گذارد. در این سلول های مرده زامبی، این سنتز در یک اندامکی موسوم به شبکه آندوپلاسمی اتفاق می افتد و این احتمال را ایجاد می کند که متابولیت های تولید شده در شبکه آندوپلاسمی عملکرد این سلول های زامبی را نیز به سلول های زنده در بافت اطراف نشان دهند.
روح مارلی در زنجیرهایی ظاهر می شود که به گفته وی در زندگی جعلی شده است. آیا زنجیره های دیگر در مرگ سلول جعل می شوند؟
