محدودیت در مهاجرت سلولهای بنیادی در مغز، یک سد در راه درمان بیماریها و صدمات مغزی با سلولهای بنیادی عصبی محسوب میشود. گروهی از دانشمندان با طراحی یک استراتژی، الگوی تحریکی ایمنی را بسط دادهاند که به وسیلهی آن، سلولهای بنیادی، علیرغم وجود نشانههای ذاتی در مغز، در جهت تحریک شده مهاجرت کردهاند.
سلولهای بنیادی عصبی نوید بخش درمان بسیاری از بیماریها میباشند. پژوهشهای پیشین اثبات کردهاند که سلولهای بنیادی عصبی قادر به مهاجرت و تمایز در مغز رتهای بالغ میباشند؛ اما مغز انسان در استفاده از این سلولهای عصبی با چالشی بزرگ رو به رو میباشد.
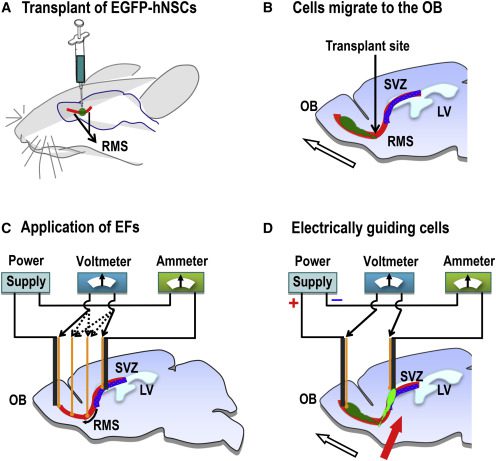
سلولهای نوروبلاست که در ناحیهی سابونتریکولار SVZ)۲) قرار دارند، به دلیل بزرگی مغز انسان مسافت زیادی را باید تا کورتکس و نواحی فوق هیپوکامپ۳ طی کنند که این موضوع، محدودیت جدی در مسیر مهاجرت سلولهای بنیادی محسوب میشود. همچنین سلولهای بنیادی پیوندی۴ در مغز به دلیل سرکوب مهاجرت توسط یکدیگر و سلولهای حاصل از تقسیم جنبش کمی دارند. این مقاله به شرح تکنیکی میپردازد که برای اولین بار طراحی شده و با بسط دادن این محدودیتها، موفق به تحریک و هدایت سلول های بنیادی در مغز موشها (in vivo) شده است.
برای انجام این پژوهش، از مسیر مهاجرتی Rostral (RMS)۵ که یکی از فعّالترین و شناختهشدهترین مسیرهای مهاجرتی است استفاده شده است. سلولهای نوروبلاستی که تازه تولید شده و سلولهای پیوندی که در ناحیهی SVZ قرار داده میشوند، به طور طبیعی، با استفاده از نشانههای شیمیایی چندگانه و مایع مغزی-نخاعی به سمت پیاز بویایی OB)۶) مهاجرت میکنند.
ثابت شده است که در محیط ازمایشگاهی (in vitro) میدان الکتریکی سیگنالهای قدرتمندی برای تحریک و مهاجرت انواع مختلفی از سلولها از جمله NSCs فراهم میکند. همچنین میدانهای الکتریکی ضعیفی که به طور طبیعی در مغز وجود دارند، در مهاجرت نوروبلاستها از SVZ به OB نقش دارند؛ به همین دلیل پژوهشگران فرضیهی «با به کار بردن میدان الکتریکی قویتر، سیگنال کافی برای تحریک و مهاجرت hNSCs که به میانهی RMS وارد میشوند، به نواحی بالاتر، برخلاف مکانیسمهای هدایتی ذاتی، فراهم میشود» طراحی کردند.
در تکنیک طراحی شده، جریانهای الکتریکی به کار برده شدهاند که کمترین تأثیر را در فعّالیت الکتریکی مغز و رفتارهای حرکتی دارند؛ و سلولهای پیوندی، به جای مهاجرت به نواحی پاییندست (OB)، خلاف جهتهای هدایتی ذاتی درونی مغز و به نواحی بالاتر، به، SVZ مهاجرت میکنند.
محقّقان برای ردیابی NSCs از سلولهای تبدیل شده با وکتورهای لنتیویرال بیانکنندهی پروتئین فلورسنت سبز۷ استفاده کردند. همچنین در این تکنیک، با تغییر محفظهی گالوانوتاکسیک کلاسیک،۸ جریان الکتریکی را در ولتاژ فیزیولوژیک حفظ کردند. که این بازطراحی، تولید گرما را از بین برده و تغییر یونها و اختلال شرایط کشت را به حداقل میرساند. سلولهایی که در معرض میدان الکتریکی قرار گرفته بودند، سالم مانده و برای روزها، توانایی حرکتی خود را حفظ کرده بودند.
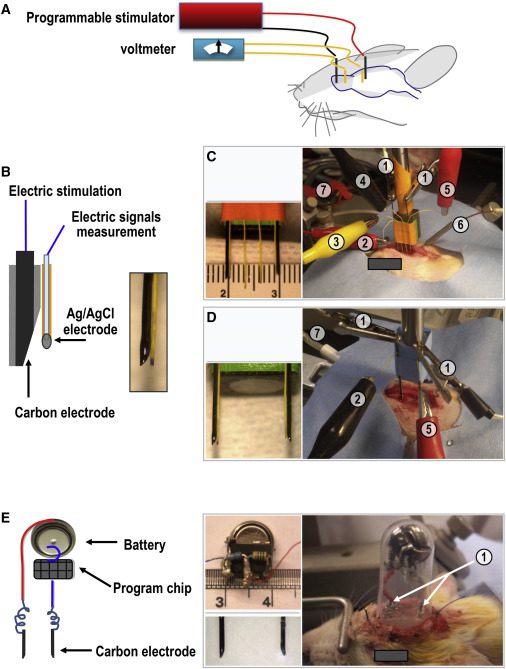
با استفاده از شکافی که به طریقهی جراحی در جمجمهی موشها ایجاد شده بود، الکترودهایی را با فریم استریوتاکتیک در مواجهه با سخت شامه قرار دادند که جریانهای الکتریکی را به مغز وارد میساختند. این جریانهای الکتریکی در حالت بیهوشی یا بعد از ریکاوری اعمال شده بودند.
در طول بیهوشی، جریانهای الکتریکی بیش از ۱۰ ساعت در طول RSM وارد شده بودند. همچنین موشهایی که ریکاوری شده و آزادانه در قفس حرکت میکردند، جریانهای الکتریکی را توسط یک تحریک کنندهی کوچک قابل حمل، که با یک باطری و یک تراشهی برنامهریزی شده برای مدیریت تحریکات ساخته شده، دریافت میکردند.
در طول تحریکات الکتریکی و بعد از آن، هیچ تشنّجی در موشها دیده نشد. ۲ الکترود الکتروانسفالوگرام (EEG) که در استخوان فرونتال دو سمت تعبیه شده بود، نشان میداد امواج شکل یافتهی EEG قبل و بعد از جریانهای الکتریکی شبیه هستند. آنالیزهای مختلف نیز این موضوع را تأیید میکردند.
در این مطالعه سه گروه رت آزمایشگاهی موجود بودند؛ ۱. گروه کنترل که الکترود نداشته و جریان الکتریکی دریافت نکرده بودند. ۲. گروه شم که الکترود تعبیه شده بود اما جریان الکتریکی دریافت نکرده بودند. ۳. گروه آزمایشی که الکترود تعبیه شده و جریان الکتریکی دریافت میکردند.
hNSCs وارد شده به میانهی RMS، در گروه کنترل و شم به سوی OB مهاجرت کرده بودند که وجود سیگنالهای هدایتی ذاتی قوی را تأیید میکند.
وقتی که جریان الکتریکی در بطن جانبی، از نواحی بالاییِ میانهی RMS۹، اعمال میشد شمار قابل توجهی از سلولها در نواحی ایپسیلترال LV مشاهده میشدند که در گروه کنترل و شم قابل مشاهده نبود. در گروه آزمایش، سری قطعات مغزی، مهاجرت hNSCs به نواحی ایپسی لترال SVZ را نشان میداد؛ همچنین با رنگآمیزی آنتیبادی SOX2 انسانی عدم تمایز این سلولها تأیید شد. برای بررسی این مسئله که «تعبیه ساختن الکترود علت مهاجرت به سمت LV میباشد» در گروه شم، الکترودها را در مسیری مشابه قرار دادند اما همچنان تحریکی الکتریکی اعمال نشد. هیچ سیگنال EGFP در اطراف ناحیهی LV دیده نشد.
برای مشخص ساختن بقای طولانیمدت سلولها، بعد از گذشت ۴ ماه و ۳ هفته از اعمال تحریک الکتریکی، سری قطعات ساجیتال نشان میدادکه NSCs از محل تزریق شده به ناحیهی LV و به همیسفر کنترالترال مهاجرت کردهاند. در واقع سیگنال EGFP در نواحی دورتر از محل تزریق حتی فراتر از الکترود در ناحیهی خلفی SVZ در کورپوس کولاسوم همیسفر کنترالترال تشخیص داده شده است که در گروه کنترل و شم چنین نبود.
مهاجرت NSCs به نواحی دورتر از الکترود جاذب اظهار میدارد که اثرات حرکتی تحریک الکتریکی، بعد از تحریک نیز باقی میماند.
این مطالعه گامی مهم در پژوهشهای مرتبط با مهاجرت سلولهای بنیادی عصبی محسوب میشود که با گسترش و مطالعات بیشتر میتواند به گامهای رو به جلوی بیشتر در درمان بیماریها و آسیبهای مغزی با سلولهای بنیادی تبدیل شود.
این مقاله در Stem Cell Reports منتشر شده است.
- Neural stem cells
- subventricular zone
- extra-hippocampal
- transplanted NSCs
- rostral migration stream
- olfactory bulb
- lentiviral vector expressing EGFP
- classic galvanotaxis chamber
- lateral ventricle