پیرو مطالب پیشین، در این بخش قصد داریم استفاده از وکتورهای ویروسی در اپتوژنتیک را مورد بررسی قرار دهیم.
مقاله مرتبط: مقدمه ای بر اپتوژنتیک؛ بازی نور و ژنتیک
مقاله مرتبط: مروری مختصر بر تاریخچه اپتوژنتیک
مقاله مرتبط: اپسین؛ جزء جدایی ناپذیر اپتوژنتیک
یکی از اهداف مطالعات علوم اعصاب، شناسایی دقیق جمعیتهای سلولی و شبکههای ارتباطی میان آنها است. این شبکههای ارتباطی، رفتارهای پیچیده و حالات روحی مختلفی را کنترل میکنند. سطح بیسابقهی دقت ژنتیکی، فضایی و زمانی ابزارهای اپتوژنتیک، جستجوی جزئیات فرضیههای مختلف درباره موجودات زنده را ممکن ساخته است.
روشهای بسیاری برای وارد کردن ابزارهای اپتوژنتیکی یا اپسینها به سلولهای زنده وجود دارد؛ از ترانسفکشن DNA گرفته تا الکتروپوریشن و سیستمهای بیان ترانس ژنیک. ترانسفکشن، وارد کردن یک قطعه DNA بیگانه به درون سلول و الکتروپوریشن، روشی است که در آن قطعات DNA را در یک محیط دارای بار الکتریکی در مجاورت سلولها قرار میدهند؛ بار الکتریکی باعث ایجاد منافذ ریز در غشای سیتوپلاسمی میشود که تسهیل ورود قطعات DNA به داخل سلول را در پی دارد.
با این حال وارد کردن این ژنها به کمک روشهای انتقال ژن با واسطه ویروسی، توانایی بالاتری برای هدف گیری منعطف تجمعهای مختلف سلولی و نقاط متعدد سیستم عصبی فراهم میآورد. اتخاذ این رویکرد، زمینه گستردهای برای انجام تحقیقات و شناسایی ویژگیهای مختلف نوروبیولوژیک سلولها و جانداران مختلف ایجاد کردهاست.
ویروسها، واسطهای ایدهآل برای انتقال ترانس ژنی هستند؛ زیرا بصورت طبیعی وارد سلولهای میزبان شده و سیستم رونویسی و پروتئین سازی سلول را برای بیان ژنهای ویروسی، به کار میگیرند. وکتورهای مهندسی شده میتوانند با جایگزین ساختن ژنوم ویروسی با توالیهایی که اپسین را تحت کنترل یک پروموتر ژنی مشخص کد میکنند، ایجاد شوند.
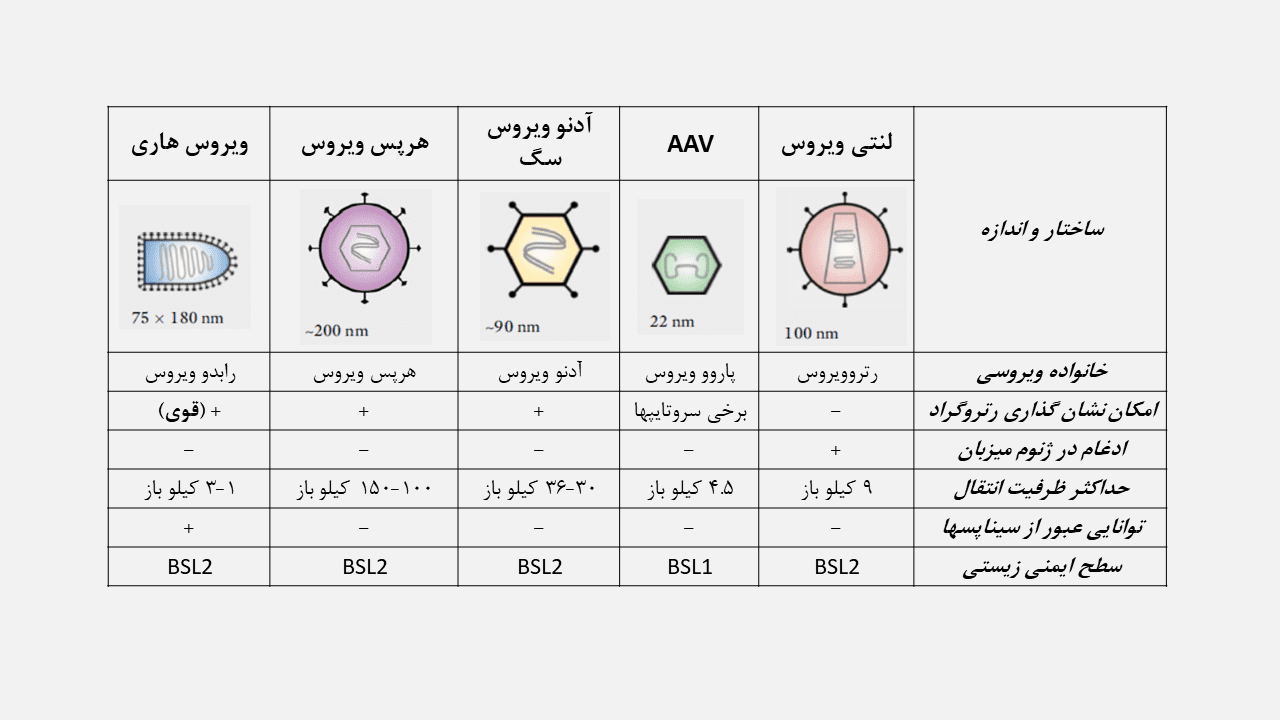
سیستمهای بیان ویروسی زیادی وجود دارند که هر یک، از ویژگیهای منحصربفردی برای کاربردهای متفاوت مطالعاتی برخوردار هستند. ویروسهایی که بیشترین استفاده را در مطالعات اپتوژنتیکی داشتهاند، عبارتند از: لنتی ویروس، ویروس مرتبط با آدنو ویروس (AAV)، آدنو ویروس سگ (canine)، هرپس سیمپلکس ویروس و ویروس هاری.
امروزه ویروسهای مرتبط با آدنو ویروس (AAVs)، بیشترین استفاده را برای انتقال اپسینها به درون سیستمهای دست نخورده سلولی دارند. این ویروسها توسط مراکزی مانند هستههای وکتور دانشگاه Stanford، دانشگاه North Carolina و همچنین دانشگاه Pennsylvania تکثیر داده میشوند. تکثیر این ویروسها در مراکز کشت بافتی با درجه ایمنی ۱ نیز امکان پذیر است.
سیستمهای بیان وکتورهای ویروسی
سیستمهای بیان ویروسی، مطالعات اپتوژنتیکی بر روی جوندگان، گورخرماهی و مدلهای پریمات را تسهیل کردهاست. این سیستمها، سریع و تطبیق پذیر بوده و میتوانند بدون نیاز به ردههای ترانس ژنیک، مورد استفاده قرار گیرند.
وکتورهای ویروسی، بیان قوی اپسینها را باعث میشوند که یکی از نکات اساسی در فعالسازی نوری کارآمد است. بعلاوه، این وکتورها، امکان پیاده سازی استراتژیهای هدف گیری متقاطع را برای کسب اختصاصیت ژنتیکی و آناتومیکیس فراهم میآورند.
هر وکتور ویروسی، مزیتها و معایب مشخصی دارد که در زمان طرح ریزی یک مطالعه اپتوژنتیکی، باید مورد توجه قرار گیرد.
وکتورهای ویروسی در اپتوژنتیک (وکتورهای معمول)
وکتورهای لنتی ویروسی
لنتی ویروسها که از اعضای خانواده رتروویروسها هستند، ژنوم RNA تک رشتهای داشته و بصورت پوشش دار مشاهده میشوند. پس از انتقال، ژنوم این ویروسها در درون کروموزوم میزبان ادغام میشود تا امکان بیان دائمی و انتقال به دیگر نسلهای سلولی، فراهم گردد. بهمین دلیل، لنتی ویروسها برای استفاده در سلولهای دارای تقسیم میتوزی و سلولهای فاقد این تقسیم، مناسب هستند و در انتقال ژن به سلولهای بنیادی، موفق ظاهر شدهاند.
در سلولهای فاقد تقسیم میتوز، وکتورهای لنتی ویروسی بصورت اتفاقی در درون کروموزوم ادغام میشوند؛ در حالیکه این ادغام در سلولهای در حال تقسیم، در درون نواحی ژنی فعال صورت میگیرد.
وکتورهای لنتی ویروسی در مقایسه با دیگر وکتورهای حمل ژنی اولیه مانند آدنو ویروسها که حاوی ژنهای ویروسی باقیمانده بودند، باعث بروز پاسخ التهابی و پاسخ ایمنی نمیشوند.
تمایل و اولویت انتقالی این وکتورهای ویروسی (که تحت عنوان تروپیسم ویروسی تعریف میشود) به واسطه گلیکوپروتئینهایی که در سطح سلولها واقع هستند، تعیین میشود. این ویژگی، اتصال ویروس به سطح سلول و کسب اجازه ورود ویروس به سلول را تعیین میکند. تروپیسم، میتواند با pseudotyping دچار تغییر شود. [Pseudotyping، فرآیندی است که طی آن وکتورهای ویروسی در ترکیب با پوشش ویروسی با منشا ویروس دیگر تولید میشوند؛ با بکارگیری این روش، پایداری وکتورها و همچنین تروپیسم بافتی ویروسها میتواند تغییر یابد.]
ظرفیت ژنومی وکتورهای لنتی ویروسی، ۸ تا ۱۰ کیلو باز بوده که در مقایسه با وکتورهای AAV، ساختار ژنی طولانی را در خود جای میدهند. با این حال، اندازه ۱۰۰ نانومتری این وکتورها در مقایسه با وکتورهای AAV که کوچکتر هستند، انتشار این ویروسها در بافتهای موجودات زنده را محدود میکند.
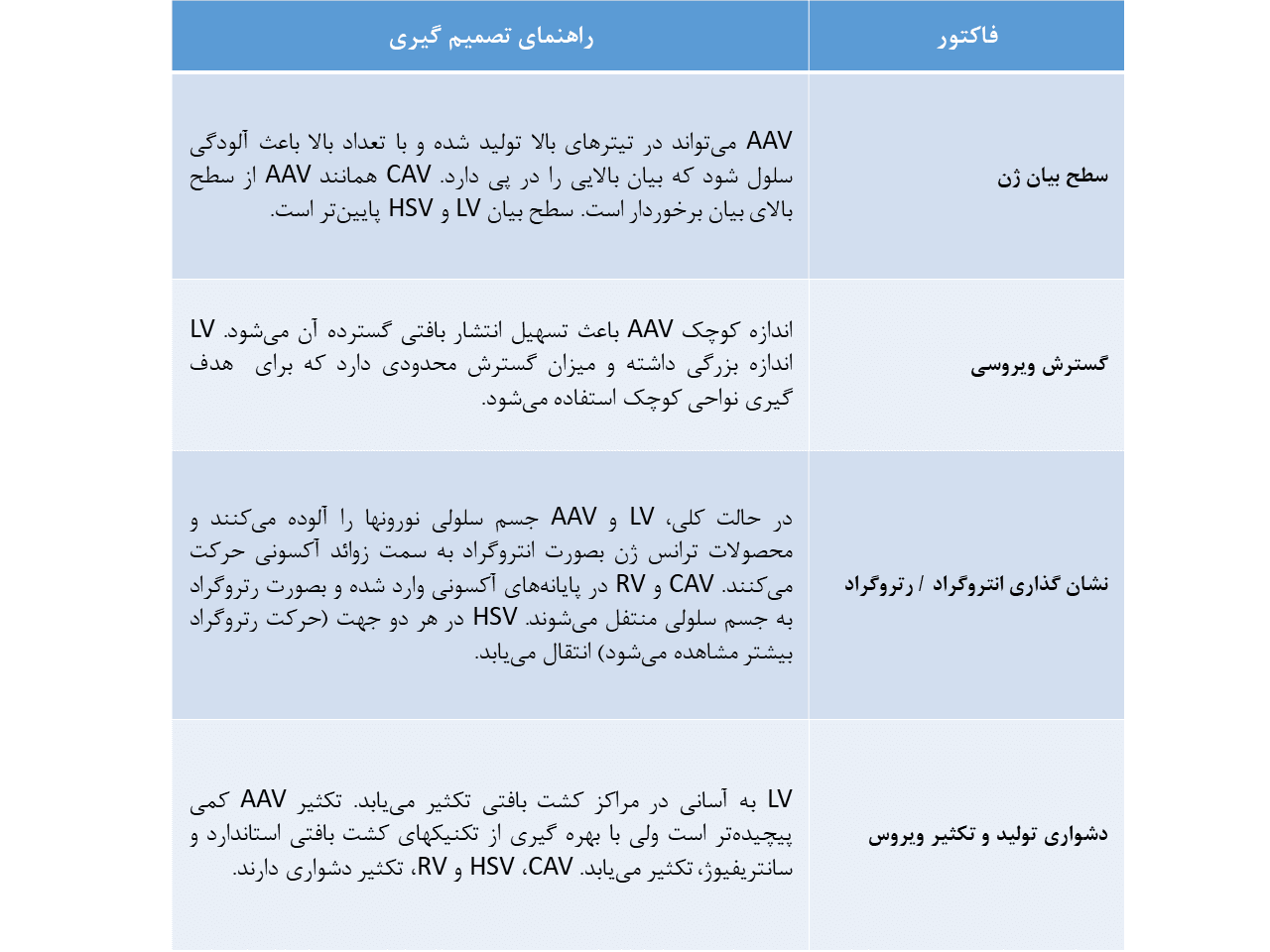
لنتی ویروسها میتوانند به سادگی و با واسطه روشهای کشت بافتی استاندارد، تکثیر یابند که این ویژگی، استفاده گسترده این وکتورها در مطالعات اپتوژنتیکی بر روی جوندگان و پریماتها را سبب شده است.
وکتورهای ویروسی مرتبط با آدنو ویروس (AAV)
AAV بخاطر ژنوم خود که DNA تک رشتهای است و فقدان پوشش، به خانواده پاروویروسها تعلق دارد. پس از اینکه ویروس با واسطهی رسپتور اندوسیتوز شد و ژنوم آن به هسته منتقل گردید، پروتئینهای مد نظر (ابزارهای اپتوژنتیکی) سنتز میشوند. سپس این پروتئینها بصورت آنتروگراد به پایانه آکسونی منتقل شده و در غشا قرار میگیرند که تحریک پذیری اپتوژنتیکی زوائد آکسونی را بدنبال دارد. البته انتقال رتروگراد اجزای AAV از انتهای رشتههای عصبی به جسم سلولی در انواع مشخصی از AAVs، دیده میشود.
ژنوم نوترکیب AAV به آسانی در ژنوم سلولی اینتگره نمیشود و معمولا به حالت کونکاتمرهای اپیزومال DNA در درون هسته قرار میگیرد. بهمین دلیل، ژنوم AAV درون هسته طی تقسیم سلولی کاهش مییابد (بعبارت دیگر همراه با ژنوم سلولی تکثیر نمیشود). با این حساب، AAV برای استفاده در سلولهای دارای تقسیم میتوزی، مناسب نیست.
در سلولهای فاقد تقسیم مانند نورونها، AAV بعنوان وکتور انتخابی محسوب میشود؛ زیرا پاسخهای ایمنی کمتری ایجاد کرده و پایداری بیشتری دارد. بعلاوه در بررسیهای بالینی و در روند هدف قرار دادن مغز و بافتهای دیگر، ایمن بودن این ویروسها اثبات شدهاست.
نقص اصلی این وکتورها، ظرفیت پایین بسته بندی (قطعه ژنومی ˃ ۴.۷ کیلو باز) آنهاست که در مقایسه با دیگر وکتورها، محدودتر است. با اینکه توالی ژنتیکی پروتئینهای اپتوژنتیکی به آسانی در ژنوم این وکتورها جای میگیرد، فضای محدود باعث محدودیت استفاده از توالیهای پروموتر طولانیتر بمنظور اختصاصیت بیان ژن میشود. با این وجود، اختصاصیت عصبی زیادی را میتوان با پروموترهای سیناپسین انسانی کاهش یافته (hSyn) یا CaM کیناز-۲α که به وفور در مطالعات اپتوژنتیکی مورد استفاده قرار میگیرند، بدست آورد.
نکته قابل توجه اینکه اخیرا وکتورهای AAV خود تکمیل کننده (scAAVs) برای سریعتر ساختن مرحله سنتز DNA مورد نیاز، ایجاد شدهاند. این scAAVs برای دربرگرفتن DNA دو رشتهای مهندسی شدهاند که بطور قابل توجهی، زمان انکوباسیون ویروسی را کاهش میدهد. با این وجود، این وکتورها ظرفیت بسته بندی محتوای ژنتیکی کمتری نسبت به وکتورهای AAV مرسوم دارند (قطعه ژنومی ˃ ۲.۴ کیلو باز).
سروتایپهای متعدد AAV با پروتئینهای متنوع کپسید که ویژگیهای بخصوصی مانند اختصاصبت ورود از پایانه آکسونی یا انتشار بافتی را شامل میشود، وجود دارند. سروتایپهای متفاوت، توالیهای مشخصی برای تکثیر و بسته بندی ژنوم ویروسی دارند که تحت عنوان توالیهای تکراری پایانی معکوس (ITRs) شناخته میشوند.
هیبریدهای نوترکیب AAV میتوانند با pseudotyping سیستمهای بسته بندی متنوع، تولید شوند. برای مثال، سروتایپ ۲ وکتور AAV، بهترین سروتایپ طبیعی است که ویژگیهای منحصربفردی داشته و بصورت وسیع برای تولید انواع نوترکیب مانند AAV2/5 استفاده میشود. در وکتور AAV2/5، توالیهای ITR از AAV2 و پروتئینهای کپسیدی از AAV5 میباشند.
مهندسی مولکولی بصورت پیوسته باعث ایجاد هیبریدهای جدید AAV میشود که از توانایی انتخاب سلولی ارتقا یافته بهره میبرند.
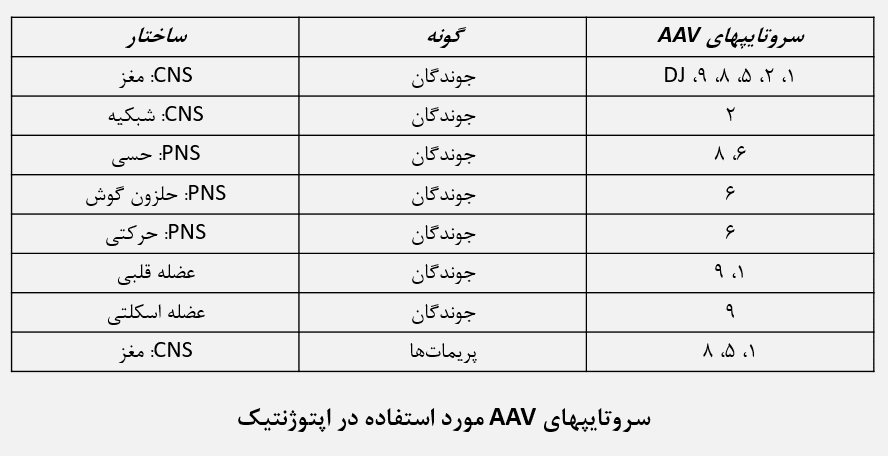
سروتایپهای ۱، ۲، ۵، ۶، ۸ و ۹ وکتورهای AAV بصورت موفقیت آمیز برای بیان اپسینها در مدلهای موشی استفاده شدهاند، درحالیکه وکتورهای AAV1، AAV5 و AAV8 در پریماتها مورد استفاده قرار گرفتهاند.
بدلیل تفاوت در پراکندگی نسبی اجزای قابل اتصال ویروسی در بافتها، تفاوت مشخصی در درجه گسترش بافتی ویروسی میان AAV2 و AAV5 مشاهده میشود. AAV5 بصورت گسترده در بافت منتشر شده و پوشش بهتری برای نشان گذاری ساختارهای بزرگتر مانند هیپوکامپ یا استریاتوم فراهم میآورد. در مقابل، تزریق AAV2، الگوهای بیان نسبتا محدودتری بروز میدهد که میتواند بعنوان مزیتی برای هدف گذاری ساختارهای کوچکتر مانند habenula یا منطقه پری لیمبیک قشر محسوب شود.
بعنوان یک راهنمای عمومی، گسترش ویروس در مغز از الگوی AAV2˂۱&6˂۵˂۸˂۹ پیروی میکند ولی این الگو باید بصورت تجربی برای هر ناحیه مغزی و انواع مختلف سلولها، تایید شود.
نکته جالب اینکه با تزریق محیطی AAV9، این وکتور از سد خونی-مغزی عبور کرده و هم سلولهای عصبی و هم سلولهای گلیا را تحت تاثیر قرار میدهد. این ویژگی اکنون برای بررسی تواناییهای بالقوه این وکتور در ژن درمانی مورد توجه است.
یک سروتایپ نوترکیب که اخیرا ایجاد شدهاست، AAV-DJ است. این وکتور دارای یک کپسید هیبرید از ۸ نوع مختلف سروتایپی است که طیف وسیعی از سلولها را با درجه بالا، تحت تاثیر قرار میهد. AAV-DJ بدلیل توانایی قوی بیان در سلولهای مختلف، میتواند زمان انکوباسیون کمتری به خود اختصاص دهد؛ بهمین دلیل این وکتور رفته رفته از محبوبیت بیشتری در رویکردهای اپتوژنتیکی برخوردار میشود.
وکتورهای آدنوویروس
آدنوویروسها به خانواده آدنوویرال تعلق دارند و دارای ژنوم DNA دو رشتهای میباشند که هیچ پوششی آن را احاطه نمیکند. استفاده از این وکتورها در ژن درمانی بدلیل مسائل سمیت زایی این ویروسها، محدود است. همچنین حضور آنتی بادیهای خنثی کننده (که از قبل در بدن افراد ساخته میشوند) در اکثر افراد، استفاده از این وکتورها را با محدودیتهایی روبرو ساخته است. بهمین دلیل، آدنوویروس سگ بر پایه گونه وکتور CAV-2 ایجاد شدهاست که از سطح پایینتری از پاسخ مثبت سرولوژیک در جمعیتهای انسانی برخوردار است.
CAV-2 از مزیتهای زیادی برای استفاده در مطالعات اپتوژنتیکی برخوردار است، زیرا این وکتور بصورت طبیعی پایانههای آکسونی را تحت تاثیر قرار داده و بصورت رتروگراد به سمت جسم سلولی نورونها حرکت میکند. این حرکت رتروگراد، تشخیص دقیق نورونهای ورودی به یک منطقه مشخص را امکان پذیر میسازد.
وکتورهای CAV، فرآیند تولید مقیاس پذیری دارند و میتوانند در تیترهای بالینی تولید شوند. این وکتورها از نظر تکثیری معیوب بوده و در ژنوم سلول میزبان، اینتگره نمیشوند. مزیت دیگر این وکتورها، ظرفیت بالاتر آنها در بسته بندی توالیهای ژنتیکی است (قطعه ژنومی ˃ ۳۰ کیلو باز).
در مطالعات اپتوژنتیکی، CAV-2 برای بیان تحریک مستقیم یا غیر مستقیم (از طریق بیان Cre-recombinase) بیان اپسین مورد استفاده قرار گرفته است.
توضیح مختصر در مورد بهره گیری از Cre-recombinase: Cre-recombinase، یک آنزیم tyrosine recombinase مشتق از باکتریوفاژ P1 است که وقایع بازآرایی ویژهای را در محلهای بخصوصی از DNA انجام میدهد. در مدلهای ترانس ژنیک موشی که برای بررسیهای اپتوژنتیکی طراحی شدهاند، این آنزیم در ردههای سلولی مشخصی بیان میشود؛ با تزریق وکتورهای حامل ژنهای اپسین، این آنزیمها در سلولهای مشخص، دستکاریهایی بر روی ژن اپسین بمنظور بیان آن انجام میدهند و بیان اپسین را ممکن میسازند.
وکتورهای هرپس سیمپلکس (HSV)
هرپس سیمپلکس (HSV)، یک ویروس پوششدار و دارای ژنوم از نوع DNA دو رشتهای است. این ویروس تروپیسم وسیعی دارد. همچنین طی یک تا دو هفته بصورت قوی و سریع در گونههای مختلفی مانند جوندگان و گورخر ماهی بیان میشود.
در برخی از بررسیها با بهره گیری از این وکتور، عدم پایداری بیان بدلیل واکنشهای التهابی گزارش شدهاست. با این حال، یک مزیت بزرگ این وکتور، ظرفیت بسته بندی بسیار زیاد (قطعه ژنومی ˃ ۱۵۰ کیلو باز) است که استفاده از توالیهای طولانی مانند توالیهای پروموتری کامل را تسهیل میکند.
وکتورهای HSV قادر به تکثیر نبوده و از سیناپسها عبور نمیکندد ولی توانایی عبور از پایانه آکسونی و حرکت رتروگراد به سمت جسم سلولی را دارا هستند. با این حال، حرکت انتروگراد HSV نیز در بررسیها مشاهده شدهاست و هنگام طراحی آزمایش، باید به این نکته نیز توجه داشت.
وکتورهای ویروس هاری (Rabies)
ویروس هاری (RV) پوششدار بوده و دارای ژنوم RNA تک رشتهای منفی است که بصورت انتخابی، تنها نورونها را درگیر میکند.
وکتورهای ویروس هاری به یک ابزار قوی برای نقشه برداری از مدارهای عصبی تبدیل شدهاند؛ زیرا این وکتورها، پایانه آکسونی را درگیر کرده و بصورت رتروگراد در میان نورونهای متصل با سیناپس، حرکت میکنند. این ویژگی، امکان نشان گذاری ترانس سیناپتیک مدارهای عصبی را فراهم میکند. با این حال، در نورونهای محیطی ممکن است حرکتی به غیر از حرکت رتروگراد نشان دهند.
این وکتورها بعنوان یک ابزار کارآمد برای رمزگشایی وظایف عملکردی مختص ورودی (input-specific founctional roles) در نورونهای دوپامینرژیک مغز میانی، مورد استفاده قرار گرفتهاند.
یکی از پیشرفتهای بزرگ در این زمینه، طراحی روشی بود که گسترش ویروسی را تنها به سلولهایی محدود میکرد که بصورت مونوسیناپتیک با نورون درگیر، ارتباط داشتند. این رویکرد از ویروس هاری فاقد گلیکوپروتئین G یا به اختصار RVdG بهره میبرد و برای نقشه برداری مدارهای عصبی بسیار کارآمد است؛ زیرا هم درگیری اولیه نورونها را به جمعیت سلولی تعریف شده محدود میکند و هم گسترش ویروس را تنها در مسیر مونوسیناپتیک محدود میسازد.
وکتورهای RVdG میتواند توالی ژنومی در حدود ۱ تا ۳ کیلو باز را بسته بندی کنند. البته انواع مختلفی از این وکتورها برای کد گذاری ChR2 طراحی و تولید شدهاند.
ملاحظات لازم در انتخاب وکتور
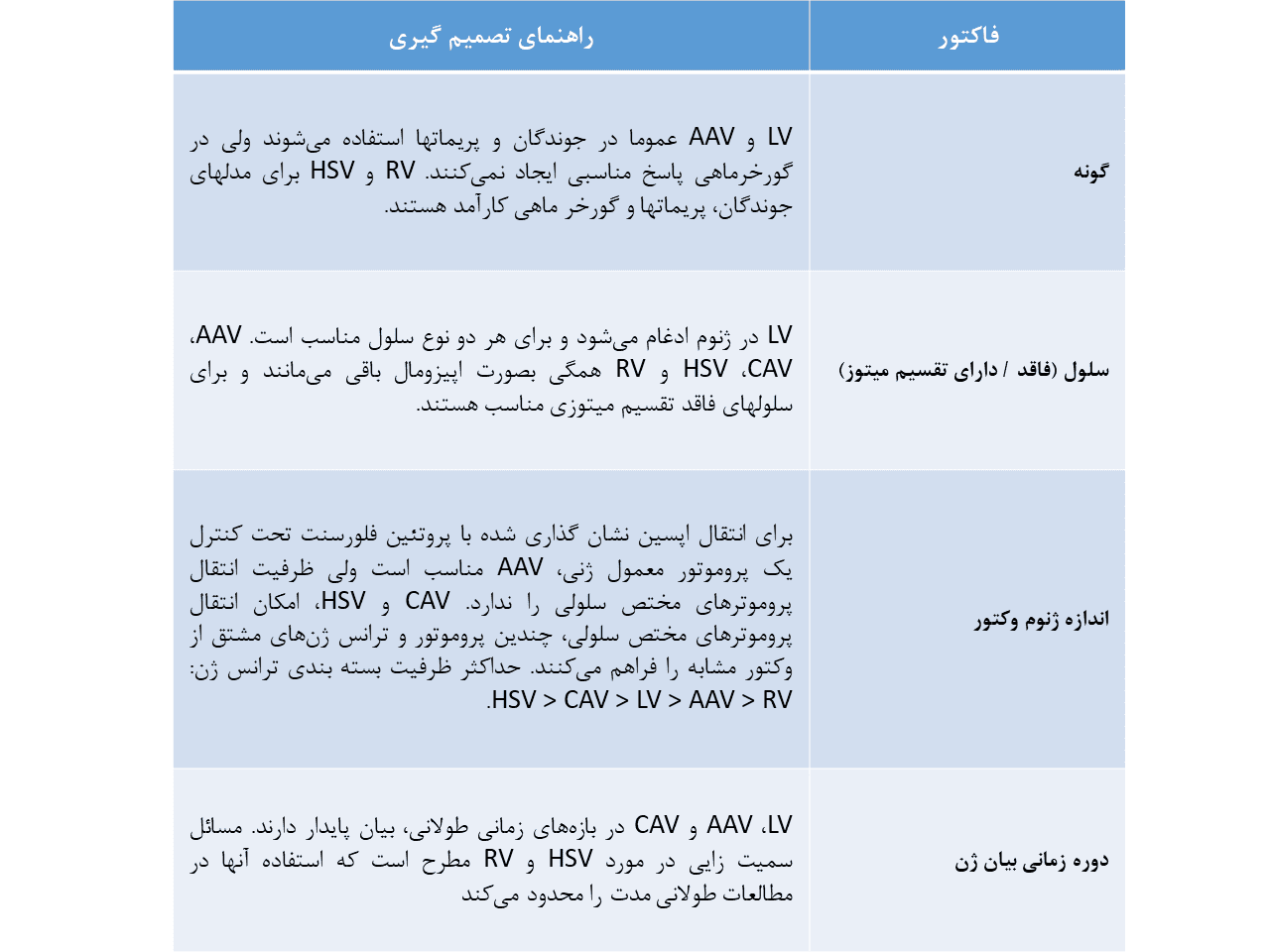
انتخاب وکتور ویروسی پیچیده بوده و به جزئیات خاص مطالعه مورد نظر بستگی دارد. جدول زیر، فاکتورهای عمدهی موثر بر انتخاب وکتور را مطرح میکند.
وکتورهایی که بصورت گسترده مورد استفاده قرار میگیرند، وکتورهای LV و وکتورهای AAV هستند. یکی از ملاحظات اولیه برای انتخاب وکتور مناسب، بررسی سلول هدف از نظر تقسیم میتوزی است. همانطور که پیشتر بحث شد، لنتی ویروسها بصورت پایدار در ژنوم میزبان اینتگره شده و برای هر دو نوع سلول (سلول دارای تقسیم میتوزی و سلول فاقد تقسیم میتوزی) مناسب است، درحالیکه AAV بصورت ایپزومال باقی میماند و برای بیان پایدار در نسلهای سلولی، مناسب نیست.
یکی از چالشهای اصلی در هدف گیری ویروسی، محدودیت ظرفیت انتقال توالی ژنتیکی توسط وکتور است. لنتی ویروس میتواند قطعات بزرگتر را تا ۹ کیلو باز در مقایسه با سیستمهای AAV که توانایی انتقال ۴.۷ کیلو باز را دارند، منتقل سازد. بعلاوه، AAV نسبت به LV کوچکتر بوده و توانایی انتشار گستردهتری در بافت دارد. پس AAV در مطالعاتی که پوشش وکتوری وسیعتری مورد نیاز است، انتخاب بهتری است، درحالیکه LV برای اختصاصیت فضایی بالاتر، گزینه مناسبتری به نظر میآید.
با اینکه AAV و LV میتوانند طیف گستردهای از گونهها از جمله جوندگان و پریماتها را آلوده کنند، در مطالعات گورخر ماهی از HSV و RV برای بازده بالاتر استفاده میشود.
زمانیکه قصد داریم وکتوری برای مطالعات نشانگذاری رتروگراد انتخاب کنیم، فاکتورهای زیادی باید مدنظر قرار گیرد. HSV بیشترین ظرفیت انتقال را دارد که برای جا دادن توالیهای پروموتر مختص سلولی، ترانس ژن و نشانگر فلورسنت، مناسب است. با این حال، HSV سطح بیان پایینی داشته و تا حدودی اثرات سمی بر روی سلول اعمال میکند.
در مقابل، آدنوویروس سگ برای جا دادن توالی اکثر اپسینها مناسب بوده و در مقایسه با HSV، سطح بیان و سلامت سلولی بیشتری را داراست.
در میان وکتورهای ترانس سیناپتیک، RV بهترین انتخاب است. همچنین این وکتور بدلیل دارا بوده حرکت رتروگراد، وکتور انتخابی در مطالعات بررسی اختصاصیت است.
نقاط ضعف انتقال ویروسی ژن
انتقال ژن با واسطه ویروسها، محدودیتهای مشخصی دارد که باید در طراحی، اجرا و تفسیر نتایج مطالعات اپتوژنتیکی، مورد توجه قرار گیرد.
در حالت کلی، بیان ویروسی در نقاط مختلف با فاصله آن نقطه از محل تزریق، رابطه عکس دارد؛ یعنی هر چه فاصله از محل تزریق وکتور بیشتر میشود، سطح بیان ویروس کاهش مییابد. بهمین دلیل در آزمایشهای اپتوژنتیکی، نباید انتظار بیان یکسان و مشابه را در نقاط مختلف داشت.
همچنین بدلیل بیان سطوح بالای پروتئینهای برونزاد، ممکن است اثرات جانبی وکتور بر سلامت سلول بروز پیدا کند و باید مورد ملاحظه قرار گیرد. این مسئله در موارد کار با وکتورهای RV مشهود است زیرا این وکتورها، سمیت اثبات شده طولانی مدتی اعمال میکنند. پس آنالیز بافتی پس از انجام آزمایش باید بمنظور تایید فقدان سمیت سلولی، انجام گیرد.
همچنین وکتورهای غیر سمی AAV در زمان بیان طولانی مدت و با تیتر بالا، ممکن است باعث بروز ویژگیهای غیر طبیعی سلولی شوند؛ این ویژگیها در زمان وارد کردن یک پروموتر قوی ژنی به سلول، بیشتر مشهود است.
همچنین ناخالصیها و اندوتوکسین باید در روند تهیه وکتور مورد توجه قرار گیرد؛ زیرا این عوامل میتوانند بر پاسخهای ایمنی و سلامت سلولی تاثیر گذار باشند.
روش تزریق وکتور (مطالعات in vivo)
۱- ملاحظات ایمنی: اعمال جراحی باید در مرکز دارای درجه II ایمنی زیستی انجام گیرد. در هنگام انجام اعمال جراحی باید از کلاه، ماسک، محافظ چشم و دستکش استفاده شود. پس از اتمام اعمال جراحی نیز تمامی لوازم باید استریل شوند.
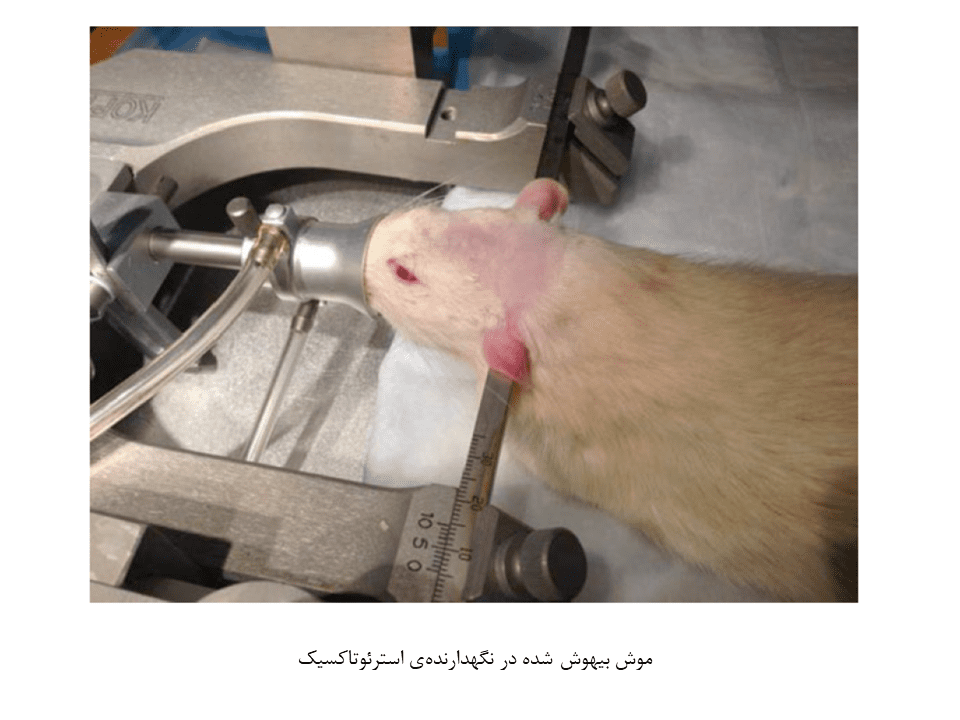
۲- موش را در اتاق القا توسط ایزوفلوران ۴ درصد بیهوشی کنید. سپس آن را توسط دستگاهی محکم نگاه داشته و در صورت نیاز به ادامهی بیهوشی، ایزوفلوران را به ۱.۵ تا ۳ درصد کاهش دهید.
۳- موی پوست سر موش را بتراشید و با محلول ید شتسشو دهید. سپس محل را دوباره با الکل تمیز کنید. این روند را ۲ مرتبه تکرار کنید.
۴- ترکیبات پیش از عمل شامل آنتی بیوتیک سفازولین (۳۰ mg/kg) را بصورت زیر جلدی و ماده بیهوشی کارپروفن (۵ mg/kg) را بصورت عضلانی تزریق کنید. سپس ژل لیدوکائین را بصورت زیرجلدی به محل تزریق وارد کنید و از یک گاز استریل برای ماساژ دادن محل استفاده کنید.
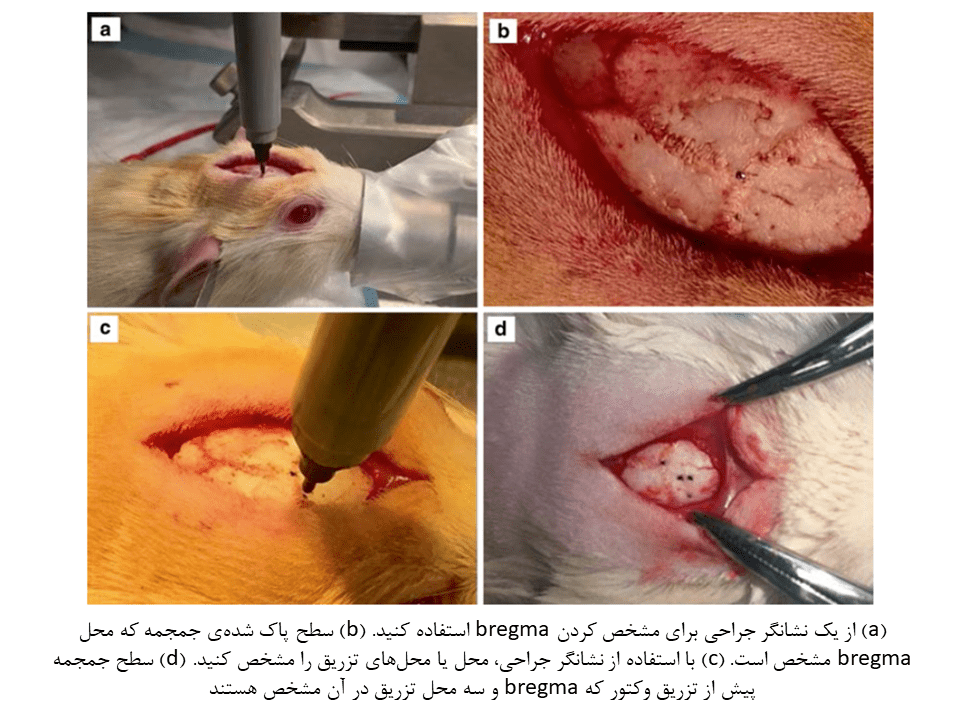
۵- یک برش خط وسط به اندازه نزدیک به ۲ cm در سطح پشتی جمجمه ایجاد کنید. از قرار گرفتن bregma و lambda (نقاط آناتومیک مخصوص در جمجمه) در این ناحیه برای انجام محاسبات مرتبط، اطمینان حاصل کنید.
۶- به آرامی پوست را بشکافید. جمجمه را با محلول هیدروژن پراکسید بمنظور مشخص شدن سوچورهای جمجمه، شستشو دهید. در صورت نیاز، از کوتر الکتریکی برای هموستاز و جلوگیری از خونریزی استفاده کنید.
۷- با استفاده از یک نشانگر متصل به بازوی جراحی، مختصات bregma و lambda را بیابید.
۸- مختصات محل تزریق را محاسبه کرده و این محل را توسط بازو نشان گذاری کنید. (تمامی اطلسهای آناتومی بدن موش، دارای مختصات bregma و دیگر نقاط جمجمه بوده و این مختصات برای جنس، سن و وزنهای مختلف موش، متفاوت هستند.)
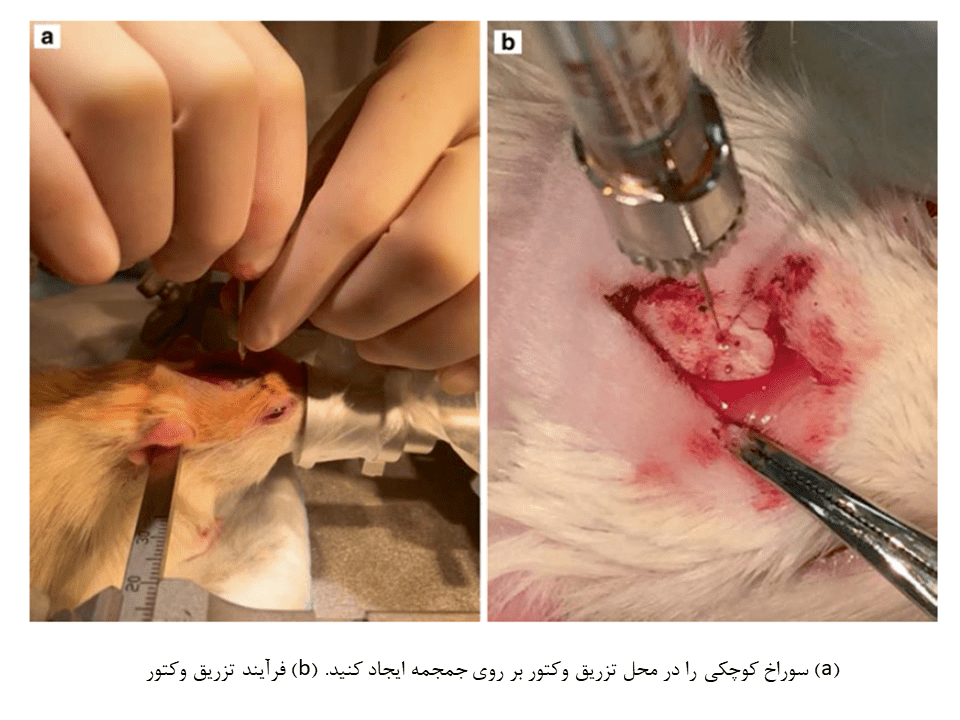
۹- سوراخ کوچکی را با استفاده از میکرودریل ۰.۳ میلیمتری در جمجمه و هر یک از محلهای تزریق ایجاد کنید. سپس پرده مننژ را در صورت استفاده از سوزن غیر نوک تیز، توسط دریل سوراخ کنید. (ایجاد سوراخ با دست، خطر آسیب به مغز در محل تزریق را کاهش میدهد.)
۱۰- سرنگ را با ۰.۵-۱ میکرولیتر بیشتر از مقدار مورد نیاز ویروس، پر کنید. سپس آن را به بازوی جراحی متصل کرده و بازو را در محل تزریق قرار دهید. پمپ تزریق را بر روی ۰.۰۱ میکرولیتر در دقیقه تنظیم کنید تا حجم مورد نظر شما بدست آید. در نهایت پمپ را بصورت دستی تا زمان مشاهده قطره کوچک در سر سوزن، فشار دهید.
۱۱- سرنگ متصل به بازو را به محل اولین تزریق هدایت کرده و در سطح آن متوقف کنید. مختصات پشتی- شکمی را ثبت کنید. سپس سوزن را به آرامی به عمق مورد نظر فرو کنید. به مدت ۵ دقیقه برای متعادل شدن مغز با حضور سوزن، صبر کنید.
۱۲- تزریق ویروس را آغاز کنید. زمانیکه پمپ، تزریق را به پایان رساند، ۵ دقیقه برای متعادل شدن مغز با حجم ماده تزریقی، صبر کنید. سپس سوزن را به آرامی خارج کنید.
۱۳- مراحل ۹ و ۱۰ را برای هر محل تزریق، تکرار کنید.
۱۴- زمانیکه تزریقها به اتمام رسیدند و سوزن خارج شد، پوست را ببندید (بخیه بزنید). پوشاندن سوراخها پیش از بستن پوست، الزامی نیست.
۱۵- ترکیبات دارویی پس از عمل شامل سفازولین (۳۰ mg/kg) و کارپروفن (۵ mg/kg) را بصورت زیر جلدی تزریق کنید.