انواع فراوانی از میکروبها از جمله ویروسها، باکتریها، قارچها و تک یاختهها آماده حمله به بدن انسان و استفاده از محیط سرشار از مواد غذایی هستند که فراهم میکند. خوشبختانه پاسخ ایمنی به عنوان یک سیستم دفاعی عمل و با مهاجمان بیگانه مقابله میکند. اما سوال این است که چی چیزی بدن را از خطر آگاه میکند؟ ارگانیسمهای خارجی چگونه شناسایی میشوند؟ رسپتورهای مشابه تول میتوانند به ما در پاسخ دادن به این پرسشها کمک کنند.
مقالات مرتبط: کاوش در محیطهای اطراف تومور
وظیفه رسپتورهای مشابه تول چیست؟
تعداد اندکی از رسپتورهای مشابه تول میتوانند انواع گستردهای از پاتوژنهای انسانی و نیز انواع مولکولهای نشانگر آسیب بافتی را شناسایی کنند. این عمل، شناسایی الگو (pattern recognition) نامیده میشود. این رسپتورها دو بازوی اصلی سیستم ایمنی را که ایمنی ذاتی و اکتسابی نام دارند و به همراه یکدیگر با عفونتها مبارزه میکنند را شناسایی مینمایند. ایمنی ذاتی، عمل حفاظت را به صورت سریع انجام میدهد. البته این سیستم در شیوه حمله به پاتوژنها نسبتا غیراختصاصی عمل میکند و این موضوع می تواند به آسیب بافتهای سالم در صورت طولانی بودن پاسخ منجر شود. از سوی دیگر، پاسخ اکتسابی منجر به تولید سلولهای B ترشح کننده آنتیبادی و سلولهای T سیتوتوکسیک میگردد که اختصاصی پاتوژنهای هدف هستند. متاسفانه این پاسخ دیرتر از پاسخ ایمنی ذاتی شروع میشود.
پروتئینها، رسپتورها و محیط
مسئله شناسایی میکروبها توسط سلولها بخشی از یک مسئله بزرگتر است که در بیولوژی سلولی مطرح میباشد: چگونه یک سلول میتواند در مورد محیط اطلاعات جمعآوری کند؟ حتی ارگانیسمهای تکسلولی نیز باید محیط اطرافشان را مانیتور کنند و به محرکهای خارجی پاسخ دهند تا زنده بمانند. بدن ما چند سلولی است و تعداد بسیار فراوانی از سلولها باید بایکدیگر ارتباط برقرار کرده و فعالیتهایشان را تنظیم کنند تا بتوانند به عنوان یک مجموعه متحد عمل نمایند. مرز سلولها توسط غشای فسفولیپیدی دولایه تعیین میگردد، که به عنوان سدی موثر در برابر مولکولهای محلول در آب عمل میکند. البته غشا کاملا عایق نیست و توسط پروتئینهایی به ساختاری پویا مبدل شده است که میتواند محیط اطراف خود را احساس کرده و با آن ارتباط برقرار کند. به عنوان مثال رسپتورهای غشایی به مولکولهای خاصی در خارج از سلول مانند هورمونها، نوروترنسمیترها، ماتریکس خارج سلولی و مولکولهای چسبندگی متصل میشوند.
پروتئینها به علت ساختار متنوع خود، دامنه گسترده ای از اعمال بیولوژیک را به انجام میرسانند. ساختارهای خطی از آمینواسیدها تشکیل پروتئینها را میدهند و تنوع پروتئینها از ترکیب انواع مختلف آمینواسیدها حاصل میشود. هر پروتئین دارای توالی آمینواسیدی خاصی است که ساختار سهبعدی زنجیره را تعیین مینماید. نتیجه ساختار سوم پروتئین است و اعمال مشخصی را به انجام میرساند. رسپتور دارای شکلی سهبعدی است که به آن امکان اتصال به مولکولهای معینی به نام لیگاند را میدهد که میتوانند هورومون، نوروترنسمیتر و … باشند. اتصال رسپتور و لیگاند با affinity بالا رخ میدهد، به این معنی که بسیار قدرتمند است و اختصاصیت آن نیز بالاست، به این معنی که اتصال به لیگاند و یا مولکولهای مشابه آن، در سطح گستردهای رخ میدهد.
شناسایی الگو و تول
سلولهای انسانی تنها دارای ۲۵۰۰۰ ژن کدکننده پروتئین هستند، درنتیجه امکان وجود ژنهایی معین برای انواع میکروبها وجود ندارد. پس بدن چگونه میتواند تمام انواع پاتوژنها را که خطر محسوب میشوند و مقابله قبلی نیز با آنها نداشته، شناسایی کند؟ در سال ۱۹۸۹، چارلز جینوی اظهار کرد که سلولها از روش شناسایی الگو برای تشخیص پاتوژنها استفاده میکنند. به عبارت دیگر، رسپتورها به اشکال و الگوهایی که PAMP (Pathogen-associated molecular pattern = الگوهای مولکولی مرتبط با پاتوژن) نامیده میشوند و در تمام گروههای پاتوژن وجود دارند، اما در میزبان نه، متصل میگردند. طبق تئوری جینوی، رسپتورها نمیتوانند میکروبهای معین را به طور دقیق شناسایی کنند، اما می توانند بیگانه بودن آنها را تایید نمایند.
نخستین رسپتورهای شناسایی الگو ده سال پس از یافتههای جینوی، شناسایی شدند. این یافته عظیم به کمک کشفی قدیمیتر که روی مگس سرکه Drosophila انجام گرفته بود، ممکن گشت. برای دههها دانشمندان از این جاندار برای تعیین جهشهای مرتبط با رشد استفاده میکردند، اما دروسفیلا معادل خوبی برای سیستم ایمنی انسان نبود، چون حشرات فاقد ایمنی اکتسابی هستند. دانشمندان آلمانی برای اولین بار ژنهای تول را به عنوان منشا جهشهایی که باعث مگسهای دارای شکل معیوب میشدند، شناسایی کردند. Toll در انگلیسی به معنی عالی است و این نام برگرفته از توصیفی است که این دانشمندان از کار خود داشتند. کلون کردن ژن نشان داد که یک رسپتور غشایی توسط آن کد میشود.
مطالعهای در سال ۱۹۹۶ نشان داد که جهشهای loss of function در تول احتمال ابتلای دروسفیلاها را به بیماریهای قارچی افزایش داده و جهشهای gain of function، منجر به افزایش بیان پروتئینهای ضدقارچی مشخصی میگردد. مقایسه جهشهای تول با جهشهای سایر ژنها نشان داد که رسپتور تول نقش مهمی در شناسایی عفونتهای قارچی و آغاز پاسخهای ایمنی ذاتی دارد. این کشف هیجانانگیز محققان را بر آن داشت تا چنین رسپتورهایی را در اسنان نیز بیابند. با استفاده از توالی آمینواسیدی تول، محققان در پروژه ژنوم انسانی در جستوجوی توالیهای مشابه، رسپتورهای مشابه تول یا TLR ها (Toll-like receptors) را کشف کردند.
رسپتورهای مشابه تول
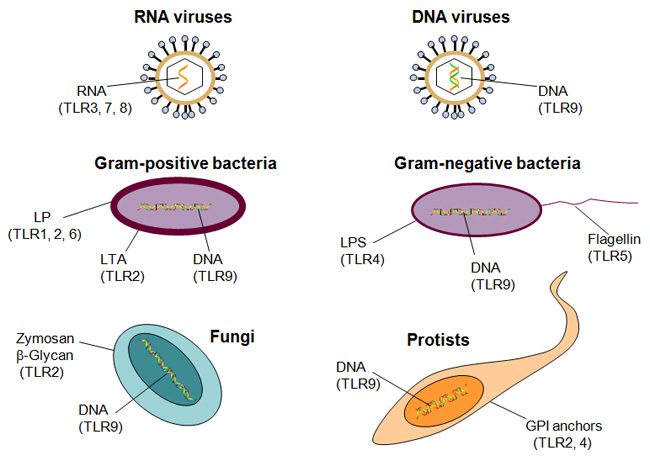
دانشمندان حدس زدند که علت آغاز پاسخ ایمنی ذاتی به پاتوژنها توسط TLR ها، مشابهت توالی آمینواسیدی آنها به تول است. اما روش اثبات عملی این تئوری چه بود؟ موشها با فراهم آوردن امکان بررسی عملکرد TLR ها به صورت in vivo، این موضوع را اثبات کردند. مدل های موشی به منظور مطالعه تعدادی از بیماریهای التهابی انسان، که در اثر بیشفعالی سیستم ایمنی ذاتی که منجر به واکنشهای التهابی خطرناک و تخریب بافتی می شود، به کار میروند. به عنوان مثال سپسیس بیماری وخیمی است که طی آن خون پر از باکتری شده و درنتیجه التهاب بدن را فرا میگیرد. سپسیس عامل مرگ بیش از ۲۰۰۰۰۰ نفر در سال در ایالات متحده است. تولید مدلهای موشی سپسیس با تزریق باکتریها به موش به منظور القای التهاب صورت میگیرد. سپس شدت بیماری توسط تستهای کنترلشده و استانداردسازی شده تعیین میشود. سالهاست که دانشمندان میدانند اجزای استخراجشده باکتری مانند LPS میتوانند به جای کل ساختار باکتری ایجاد سپسیس کنند. LPS در دیواره سلولی تمام باکتریهای گرم منفی وجود دارد که طیف وسیعی از باکتریها را در بر میگیرد. به علاوه مطالعهای که در سال ۱۹۹۸ انجام شد نشان داد که موشهای دارای نقص در TLR4 کاملا به سپسیس حاصل از LPS مقاوم هستند. این موضوع نشان داد که TLR4 ها رسپتور LPS هستند و به دنبال تحریک توسط این لیگاند، پاسخ ایمنی ذاتی ایجاد میکنند.
دانشمندان میدانند که انسان ها حداقل ۱۰ نوع مختلف TLR ها را دارا هستند و در مجموع طیف گستردهای از پاتوژنها را تشخیص میدهند. TLR های ۱، ۲، ۴، ۵ و ۶ به ترکیبات موجود در دیواره سلولی و غشا که مختص پاتوژنها است، متصل میشوند. شناخته شدهترین لیگاندها باکتریایی هستند و عبارتند از LPS و لیپوتایکوئیکاسید دیواره سلولی، لیپوپروتئینها از غشای سلولی و فالژلین تاژک باکتری. TLR های ۳، ۷، ۸ و ۹ به نوکلئیک اسیدهای میکروبی متصل میشوند که شامل مولکولهای RNA تکرشتهای و دورشتهای ویروسی و DNA بیشتر ارگانیسمها هستند. این TLR ها نمیتوانند نوکلئیکاسیدهای خودی را تنها بر اساس تفاوتهای ساختاری شناسایی کنند و این شناسایی نیازمند تعیین موقعیت نوکلئیکاسدها در سلول است. تمام این لیگاندها در میکروبها نقشی اساسی بازی میکنند و میکروبها نمیتوانند اسن سختارها را حذف کنند یا تغییر دهند تا بتوانند از دست سیستم ایمنی فرار کنند. دانشمندان در جانورانی با رده پایینتر مانند C. elegans که یک نماتود است و در گیاهان نیز TLR ها را شناسایی کردهاند که نشان از منشا تکاملی این رسپتورها دارد.
ساختار TLR ها
ساختار پایه TLR ها مشابه پروتئینهای transmembrane است. TLR های انسانی طولی در حدود ۷۰۰ تا ۱۱۰۰ آمینواسید داشته و حاوی بخشهای خارج سلولی، داخل غشایی و سیتوپلاسمی میباشند. بخش خارج سلولی، محل اتصال لیگاند است و TLR ها عموما به صورت هومودایمر عمل میکنند. ۱۰ نوع TLR انسانی محدود به شناسایی تنها ۱۰ نوع از PAMP ها نیستند. در واقع تعداد لیگاندهای با PAMP متمایز فراوان بوده و تعداد آنها همچنان رو به افزایش است. تشکیل هترودایمرها از راههایی است که باعث افزایش تنوع شناسایی لیگاند میگردد (به عناون مثال ترکیب TLR1 با TLR2 یا TLR6). همچنین ترکیب با پروتئینهایی خارج از خانواده TLR نیز این تنوع را افزایش میدهد. به عنوان مثال، TLR4 به همراه پروتئینهای MD2 و CD14، مولکولهای LPS را شناسایی میکند.
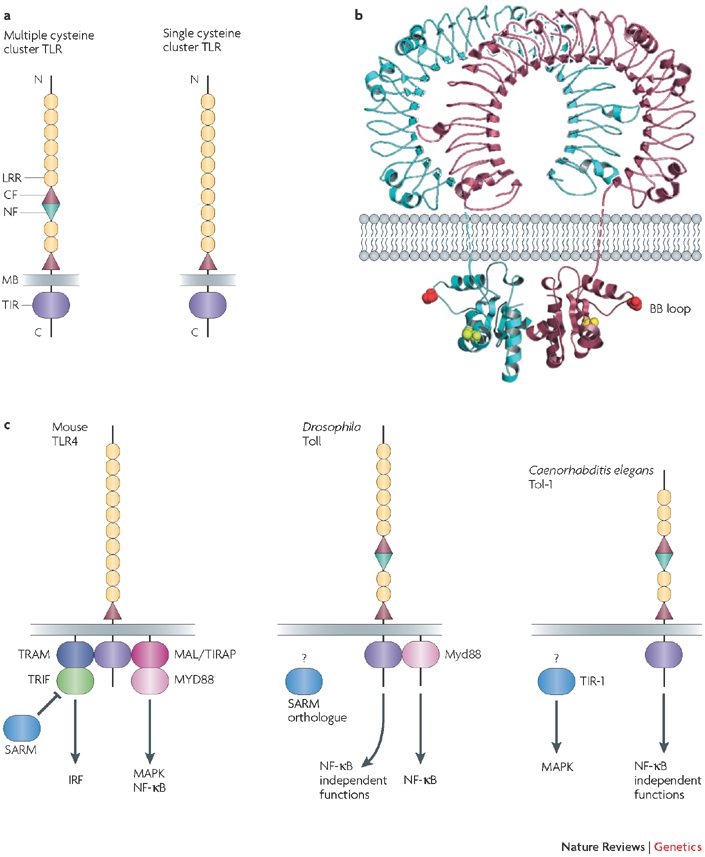
موقعیت TLR ها و بیان اختصاصی سلول
TLR های ۱، ۲، ۴، ۵ و ۶ عمدتا در غشای پلاسمایی که محل ارتباط با ترکیبات پاتوژنهای میکروبی با سلول است، قرار گرفتهاند. در مقابل، TLR های ۳، ۷، ۸ و ۹ در غشاهای اندوزومی و لیزوزومی قرار دارند، به نحوی که بخش خارج سلولی آنها به سمت داخل این ارگانلها است. پس از تجزیه پاتوژنهای وارد شده به داخل این ارگانلها، DNA و یا RNA آنها در تماس با TLR ها قرار میگیرد.
TLR ها در انواع مختلف سلولها الگوهای بیان مختلف و پیچیدهای دارند. همان طور که میدانید انواع مختلف سلولهای یک ارگانیسم چندسلولی ژنوم یکسانی دارند و آنچه باعث اختصاصیت عملکرد آنها میشود بیان ژنهای مختلف در سلولهای مختلف میباشد. بیان TLR ها در انواع مختلف WBC ها نیز این گونه است. ماست سلها، ماکروفاژها و سلولهای دندریتی جریان خون را ترک کرده و در بافتهای مختلف به منظور شناسایی پاتوژنها ساکن میشوند. پاسخهای ایمنی ذاتی توسط ماست سلها و ماکروفاژها، و پاسخهای ایمنی اکتسابی عمدتا توسط سلولهای دندریتی آغاز میگردد.
سیگنالهای آسیب
تصور بسیاری از دانشمندان این گونه بود که عملکرد TLR به منظور تشخیص ارگانیسمهای بیگانه اختصاصیت یافته است، تا بدن بتواند سلولهای خودی را از غیرخودی تشخیص دهد. با این حال، شواهد قانعکنندهای مبنی بر منشا خودی برخی از لیگاندهای TLR وجود دارد. چرا باید سیستم ایمنی به ترکیبات خودی واکنش نشان دهد؟ پاسخ این است که این لیگاندها به عنوان سیگنالهای آسیب عمل میکنند تا آسیب سلولها و بافتهای بدن را سیگنال کنند (الگوهای مولکولی مرتبط با آسیب یا DAMP).
آسیبهای فراوانی وجود دارند که سبب نوعی از مرگ سلولی به نام نکروزمیشوند. این نوع از مرگ باعث خواهد شد که ترکیبات داخل سلولی به محیط اطراف آزاد شده و خصوصا TLR ها را فعال کنند. محصولات تجزیه ماتریکس خارج سلولی نیز ممکن است به عنوان سیگنالهای آسیب عمل نمایند. دانشمندان همچنان در حال مطالعه اهداف این سیگنالهای اندوژن هستند و نقش آنها احتمالا آغاز پاسخهای ترمیم بافت، آغاز پاسخهای ایمنی علیه عفونتهایی که معمولا به دنبال آسیب ایجاد میشوند و همکاری با TLR ها در تشخیص پاتوژنهایی که باعث آسیب میشوند و تمایز آنها از میکروبهای بی ضرر است.
سیگنالهای آسیب اندوژن میتوانند محرک پاسخ ایمنی ذاتی نامناسبی باشند که در شرایط عدم وجود عفونت بیشتر آسیبرسان است تا مفید. مثالی که میتوان زد آسیب ایسکمیک است که ناشی از از دست دادن موقت جریان خون و درنتیجه اکسیژن به بافت میباشد. آسیب ایسکمیک در بسیاری از شرایط بالینی مانند سکته مغزی و پیوند بافت دارای اهمیت و نگرانکننده است. مرگ سلولی ناشی از ایسکمی باعث آزاد شدن سیگنالهای آسیب میشود. با برقراری مجدد جریان خون WBCها وارد شده و در پاسخ به سیگنال آسیب ایجاد التهاب مینمایند. این التهاب تخریب را مضاعف مینماید. بلاک TLR2 و TLR4 با آنتاگونیستها در مهار این شرایط و جلوگیری از پاسخ ایمنی بیش از حد مفید است. همچنین شواهدی مبنی بر نقش TLR ها در پیشرفت آترواسکلروز و بیماری آلزایمر از طریق احساس سیگنالهای آسیب وجود دارد.
انتقال سیگنال TLR ها
پس از اینکه TLR ها PAMP ها و DAMP ها را تشخیص دادند، باید از طریق انتقال سیگنال پیام را به داخل سلول منتقل کنند. در طراحی داروها نیز دانشمندان میخواهند این رویدادهای سیگنالینگ را تغییر دهند. ترکیبات مسئول سیگنالینگ داخل سلولی که پروتئین کیناز نامیده میشوند، با افزودن فسفات به آمینواسیدهای خاصی در پروتئینها آنها را فعال میکنند و از بهترین اهاف درمانی شناخته شده هستند. در سیگنالینگ TLR نیز انواع مختلفی از پروتئین کینازها مانند IRAKs (IL-1R-associated kinases) و MAPKs (mitogen-activated protein kinases) دخیل هستند و برخی از آنها نیز اهداف مناسبی به منظور تولید دارو میباشند. به عنوان مثال در صورتی که موشها دارای فرم معیوب IRAK4 باشند، نسبت به شوک سپتیک و التهاب مزمن مقاوم میگردند. پاسخ نهایی سلولها به تحریک TLR معمولا شامل فعال شدن فاکتورهای رونویسی است که الگوهای اختصاصی بیان ژن را تنظیم میکنند. درنتیجه بیان صدها پروتئین افزایش پیدا میکند. این پروتئینها سایتوکاین نام دارند و به منظور فعال کردن و فراخوانی سایر سلولها و درنتیجه آغاز کردن و هماهنگی پاسخهای ایمنی گستردهتر ترشح میشوند.
