این پدیده را چگونه میتوان توضیح داد؟ در مورد بسیاری از بیماریهای ارثی، یک جهش مشابه همواره در تمام افراد حامل آن بیان نمیگردد. به علاوه، در صورت بیان نیز، همواره نمود یکسانی نخواهد داشت. این یافتهها، اساس مفاهیم نفوذ و قابلیت بیان (expressivity) را تشکیل میدهند. درجه نفوذ، نسبتی از جمعیت را اندازهگیری میکند که حامل الل بیماریزا بوده و فنوتیپ بیماری مرتبط با آن الل را نشان میدهند. قابلیت بیان، نشان دهنده میزان بیان فنوتیپی ژنوتیپی خاص است. به علاوه، هر دو مفهوم نفوذ و قابلیت بیان بیماریهای مختلف، میتوانند تا حدودی با اعمال ژن های اصلاح کننده (gene modifiers) توضیح داده شوند.
نفوذ
رتینوبلاستوما سرطان شبکیه بوده، در اثر جهش در ژن Rb حاصل میشود و بیشتر کودکان را تحت تاثیر قرار میدهد. جالب اینجاست که تمام افراد حامل این جهش، مبتلا به رتینوبلاستوما نمیشوند. به عنوان مثال، دو خواهر میتوانند جهشهای یکسانی را از پدر و مادر خود به ارث ببرند؛ در حالیکه یکی از آنها مبتلا به بیماری شده و دیگری سالم بماند. جالبتر اینکه رتینوبلاستوما تنها بیماری این دسته نیست. تعداد زیادی از بیماریهای ارثی دیگری نیز وجود دارند که جهشی یکسان در تمام افراد حامل آن وجود دارد، اما بیان نمیشود. متخصصان ژنتیک از این مفهوم با عنوان نفوذ یاد میکنند.
نفوذ، نسبتی از افراد یک جمعیت را اندازهگیری میکند که حامل الل بیماریزا بوده و فنوتیپ آن را نیز نشان میدهند. در مورد رتینوبلاستوما، از آنجایی که تمام افراد حامل جهش، مبتلا به بیماری نمیشوند، گفته میشود که این بیماری دارای نفوذ ناقص یا کاهشیافته است. بیماریهای دیگری که دارای نفوذ ناقص هستند عبارتند از: بیماری هانتینگتون و سرطان پستان. در مقابل، یک بیماری در صورتی نفوذ کامل دارد که تمام افراد حامل ژن مربوطه، مبتلا به بیماری گردند. به عنوان مثال، به ارث بردن جهش نقطهای خاصی که در FGFR3 (گیرنده فاکتور رشد فیبروبلاستی ۳) رخ میدهد، همواره منجر به ناهنجاری آکندروپلازی میگردد که همراه با رشد غیرطبیعی استخوان و کوتولگی است.
قابلیت بیان
همان طور که گفتیم، اندازهگیری نفوذ، اطلاعاتی در مورد بیان و یا عدم بیان جهش مربوط به بیماری در جمعیت به دست میدهد. قابلیت بیان نیز میزان بیان فنوتیپی یک ژنوتیپ خاص را در افراد میسنجد. به عنوان مثال، فردی که از بیماری خاصی رنج میبرد، ممکن است علائمش به مراتب شدیدتر از فردی مبتلا به همان بیماری و حامل همان جهش باشد. نفر سوم حامل الل جهشیافته نیز ممکن است نرمال به نظر برسد. این پدیده، قابلیت بیان نامیده شده است و درجهای را میسنجد که یک ژنوتیپ، فنوتیپ خود را بیان میکند.
همان طور که افراد با جهشی خاص، تفاوتهایی را در شدت بیماری نشان میدهند، میتوانند درجنبههای فراوان دیگری نیز این تفاوت فنوتیپی را نشان دهند؛ به عنوان مثال، سن شروع بیماری. برخی بیماریها مانند بیماری هانتینگتون، میتوانند سن شروع پایینتر و علائم شدیدتری را در نسلهای بعدی نشان دهند. این نوع از بیان متنوع، پیش اندازی (anticipation) نامیده میشود.
به منظور درک بهتر مفهوم قابلیت بیان، بیماریهایی را بررسی خواهیم کرد که انواعی از فنوتیپها را نشان میدهند؛ از جمله نوروفیبروماتوز، هولوپروزنسفالی و سندروم وان در وود.
نوروفیبروماتوز
بیماری نوروفیبروماتوز در اثر جهش در ژن نوروفیبرومین حاصل میشود. این جهشها، باعث میشوند که سلولهای شوان در سیستم عصبی افراد درگیر به صورت تومورهایی به نام نوروفیبروما رشد کنند که به صورت لکهها و خالهای قهوهای در زیر پوست دیده میشوند. این تومورها میتوانند منجر به ناهنجاریهای اسکلتی و مشکلات عصبی گردند. با این حال، تمام افراد دارای ژن جهش یافته نوروفیبرومین به طور برابری تحت تاثیر این بیماری قرار نمیگیرد. تحقیقات نشان داده است که اعضای یک خانواده که حامل جهشی یکسان هستند، میتوانند انواعی از علائم را نشان دهند و شدت این علائم در تعدادی از آنها بسیار شدیدتر باشد؛ هر چند که همه آنها حامل اللی یکسان هستند.
هولوپروزنسفالی
در هولوپروزنسفالی، تقسیم مغز پیشین جنینی به دو لوب، به درستی صورت نمیگیرد. دانشمندان تاکنون ۹ نوع هولوپروزنسفالی را که در اثر حذف یا مضاعف شدن ژنها و نواحی کروموزومی مختلف رخ میدهند، شناسایی کردهاند.
در سال ۱۹۹۳، آماندا کالینز و همکارانش خانواده بزرگی را که چندین فرزند آن مبتلا به هولوپروزنسفالی بودند، مورد بررسی قرار دادند و متوجه بیان متنوع بیماری در اعضای آن گشتند. شدیدترین حالت بیماری، منجر به مرگ شده بود. در مقابل، در موارد متوسط، اعضای خانواده دارای رشد مغزی نزدیک به نرمال بودند و تنها ناهنجاریهای جزئی صورت مشاهده میشد. مطالعات دیگر نیز حاکی از نفوذ ناقص بیماری هستند.
مقالات مرتبط:
 سندروم وان در وود
سندروم وان در وود
سندروم وان در وود، اختلالی است که به صورت غالب به ارث میرسد و باعث لب و/یا کام شکافدار میگردد. این بیماری در نتیجه جهشی تکژنی در ژن کدکننده پروتئینی حاصل میشود که فاکتور تنظیمکننده اینترفرون ۶ نام دارد. مطالعه خانوادهای بزرگ و متشکل از هفت نسل که تحت تاثیر سندروم وان در وود قرار گرفته بودند نشان داد که این اختلال دارای هر دو الگوی نفوذ ناقص و بیان متنوع است. گاها افرادی که نمیدانستند مبتلا هستند، طی معاینه دقیق، مبتلا به نوع متوسط بیماری تشخیص داده شدند. بسیاریاز بیماران دارای چاله مشخص در لب بودند که گاها به تنهایی و گاها همراه با علائم دیگر ظاهر میشد. شکاف لب و کام در حدود یک پنجم موارد وجود داشت.
چرا فنوتیپها دارای تفاوت در نفوذ و بیان هستند: ژن های اصلاح کننده ؟
دانشمندان چگونه تفاوتهای موجود در نفوذ و بیان را که در سطح فنوتیپی مشاهده میشود، به سطوح مولکولی مرتبط میکنند؟ به عنوان مثال، چگونه ممکن است که یکی از اعضای خانواده حامل جهش در ژن رتینوبلاستوما باشد و به بیماری مبتلا شود، ولی عضو دیگر که دارای جهش نیز هست، نه؟ چه عاملی سبب بروز تفاوت در نفوذ بیماری میشود؟ در مورد نوروفیبروماتوز، اعضای یک خانواده حامل جهشی یکسان در ژن نوروفیبرومین هستند، ولی تعدادی از آنها علائم بسیار وخیمتری را نشان میدهند. چرا این بیماری دارای بیان متنوع است؟ پاسخ به این سوالات آسان نیست. اما تحقیقات نشان دادهاند که این فنوتیپهای متنوع میتوانند توسط فاکتورهای زیر ایجاد شوند:
- ژنهای اصلاح کننده
- فاکتورهای محیطی
- واریانتهای اللی
- فعل و انفعالات پیچیده ژنتیکی و محیطی
در بسیاری از مواردی که ژنوتیپی معین به ارث میرسد، دقیقا مشخص نیست که چرا اللی یکسان باعث ایچاد فنوتیپهایی کاملا متفاوت از یکدیگر میگردد. در برخی موارد، شواهدی مبنی بر تاثیر ژنهای اصلاح کننده در ایجاد واریانتهای فنوتیپی مشاهده شده است.
ژن های اصلاح کننده میتوانند نفوذ، رابطه غالب بودن و قابلیت بیان را تغییر دهند. چنین ژنهایی در صورت بیان، میتوانند بیان ژنهای دیگر را نیز تغییر دهند. ژنهای اصلاح کننده، رونویسی را تحت تاثیر قرار داده و از بیان فوری رونوشت ژن خودداری میکنند، و یا اینکه میتوانند فنوتیپ را با دستکاری سطوحی دیگر مانند سطوح سلولی یا ارگانیسمی تغییر دهند.
برخی از مثالهای ژن های اصلاح کننده در موشها و انسانها، در امتداد تاثیرات و نتایج فنوتیپی آنها در جدول زیر نشان داده شده است. همان طور که مشاهده میکنید، اصلاح کنندههای ژنتیکی فراوانتری در موشها نسبت به انسانها شناسایی شده است که به علت وجود امکان انجام آزمایشات هدفگیری ژنی روی موشهای درون آمیزی شده است. به عنوان مثال، اصلاح کننده ناشناختهای که با پیشزمینه ژنتیکی مشخصی در موشها در ارتباط هستند میتوانند نفوذ اللی را تغییر داده و باعث ناهنجاریهای مادرزادی گردند. همچنین، اصلاحکننده ژنتیکی دیگری قابلیت بیان اللی را تغییر میدهد که منجر به تولید موشهایی با اندازه متفاوت دم میگردد.
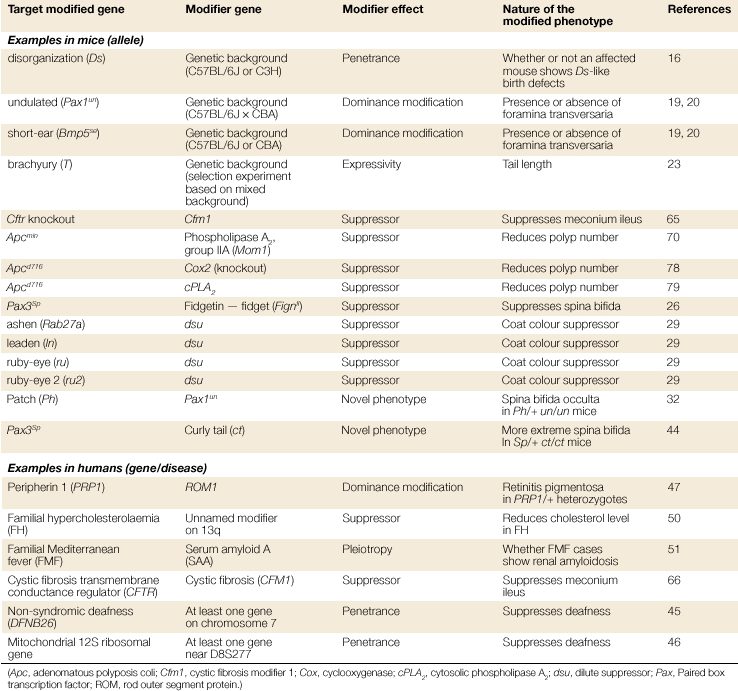
مدل شکل زیر، راههای مختلفی را که ژن اصلاحکننده از طریق آن فنوتیپ را در ارگانیسمهای مختلف تغییر میدهد، نشان داده است. ژن اصلاحکننده میتواند آستانه بیان صفت را تغییر دهد. این بدان معناست که اصلاحکننده باعث میشود که نسبت کمتر و یا بیشتری از افراد بیماری را بیان کنند. در این حالت، ژن اصلاحکننده احتمالا نفوذ را تغییر داده است. به عنوان مثال، ژن DFNM1 آستانه بیان صفت را به سمت راست جابهجا میکند. در نتیجه، برخی افرادی که از لحاظ الل DFNB26 هوموزیگوس هستند، ناشنوا نمیشوند و این منجر به نفوذ ناقص میگردد. سایر اصلاحکنندهها نیز میتوانند نسبت افرادی که تحت تاثیر الل عامل بیماری گرفتهاند را با کاهش آستانه بیان صفت افزایش دهند. اصلاحکنندهها همچنین میتوانند توزیع صفت و یا انواع فنوتیپهای بیماری را تغییر دهند. درنتیجه تعداد بیشتری از افراد حامل الل بیماریزا، فنوتیپ شدیدتر (یا خفیفتری) ازبیماری را بیان میکنند. این منجر به بیان متنوع میگردد.
به عنوان مثال، در بیماران مبتلا به تالاسمی، که درنتیجه نقص در سنتز بتا گلوبین ایجاد میشود، مشخصههای بالینی مختلف و بیان متنوع وجود دارد. در موارد شدید، آنمی وخیمی مشاهده میشود که بیماران را مجبور به دریافت خون منظم میکند. این در حالی است که سایر افراد حامل جهشی یکسان، علائم ملایم و غیرقابل تشخیصی دارند. یکی از عوامل زمینهساز این تنوع فنوتیپی، شامل درگیری تعداد فراوانی از ژن های اصلاح کنندهای است که تولید گلوبینها را تحت تاثیر قرار میدهند.
در انسانها بیماریهای ژنتیکی دیگری علاوه بر تالاسمی وجود دارند که میتوانند منجر به هر دو الگوی نفوذ ناقص و بیان متنوع گردند. در واقع، در مورد بسیاری از بیماریها، بیان متنوع فنوتیپ بیماری در بین افراد حامل جهشهای یکسان بسیار شایع است و علت این موضوع کاملا مشخص نیست. شناسایی سایر ژن های اصلاح کننده میتواند به دانشمندان در درک ماهیت تعداد فراوانی از بیماریهای انسانی کمک کند.
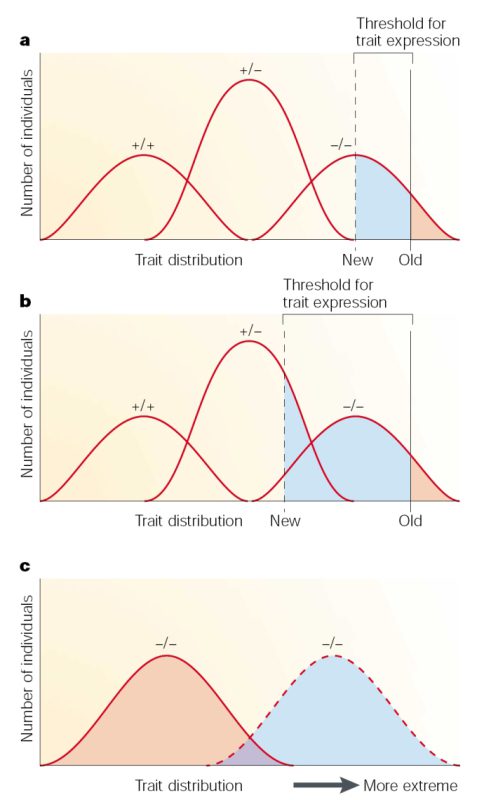

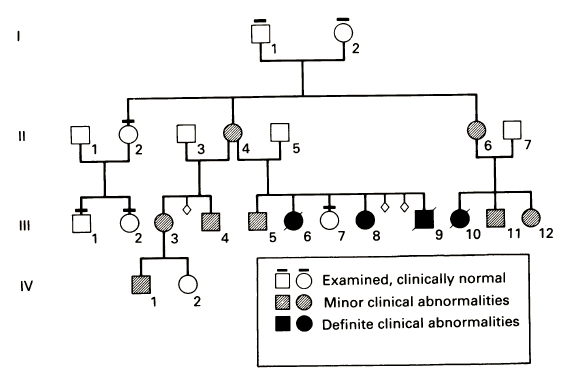 سندروم وان در وود
سندروم وان در وود