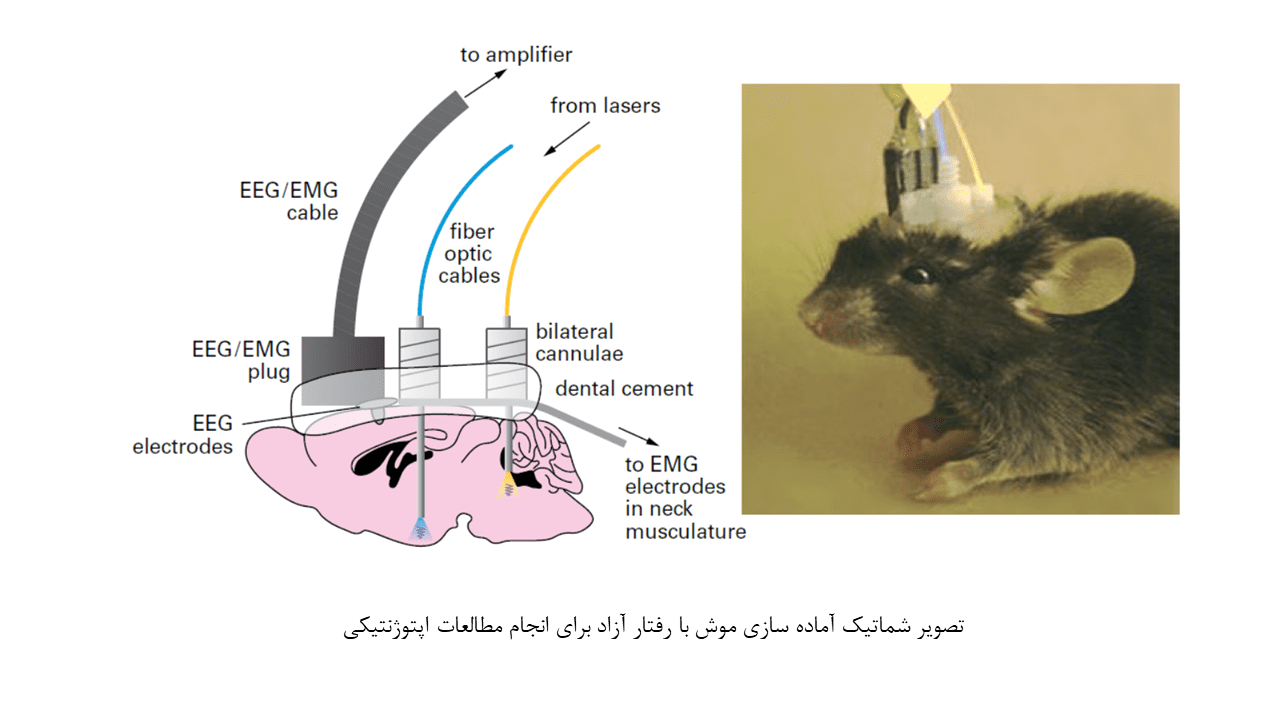
کاربرد اپتوژنتیک در مطالعات in vivo، محققان را قادر ساخته است تا به فهم عمیقتری از مدارهای عصبی دخیل در رفتارهای پیچیده دست یابند. در این بخش، به بررسی کاربرد اپتوژنتیک در مطالعات حیوانی میپردازیم.
مقاله مرتبط: مقدمه ای بر اپتوژنتیک؛ بازی نور و ژنتیک
مقاله مرتبط: مروری مختصر بر تاریخچه اپتوژنتیک
مقاله مرتبط: اپسین؛ جزء جدایی ناپذیر اپتوژنتیک
مقاله مرتبط: انتقال ژن به سلول توسط وکتورهای ویروسی در اپتوژنتیک
مقاله مرتبط: منابع نور در اپتوژنتیک
کاربردهای اپتوژنتیک در مطالعات نماتد Caenorhabditis elegans
مزیتهای Caenorhabditis elegans یا به اختصار C. elegans، از جمله سیستم عصبی با ویژگیهای مشخص، الگوهای رفتاری پیچیده، محتوا و ویژگیهای ژنتیکی پرکاربرد، و قابلیت پایش آسان در مطالعات، این موجود را به یک پلتفرم عالی برای مطالعات و دستکاریهای اپتوژنتیکی مبدل ساخته است.
elegans نقشی برجسته و امیدوار کننده در سه زمینه ایفا میکند: بررسی و اعتبار سنجی ابزارهای اپتوژنتیکی جدید؛ مشخص کردن ارتباط فیزیولوژیکی بر پایه ارتباطات آناتومیکی؛ و رویکردهای مبتنی بر غربالگری با بازده بالا.
دستکاری طولانی مدت تکامل یا عملکرد سیستم عصبی:
ابزارهای اپتوژنتیکی استاندارد مانند ChR2 برای فعالسازی نورونها و پایدار ساختن این فعالیت به مدت چند دقیقه یا بیشتر، در C. elegans مورد استفاده قرار گرفتهاند.
بررسی تمام نوری سیستم عصبی:
در سالهای اخیر، تمرکز محققان بیشتر بر روی کسب فهم عمیقتر از عملکردهای مدارهای عصبی در حیوانات زنده منعطف بودهاست. رویکردهای “تمام نوری” (all-optical) از نظر تکنیکی چالش برانگیز هستند ولی از مزیتهای بسیاری از جمله غیر تهاجمی بودن و امکان هدف گذاری جمعیتهای مشخص سلولی برخوردارند.
برای نمونه، محققان ژن ChR2 را در نورونهای حسی ASH و ژن سنسورهای قرمز کلسیمی R-CaMP2 را در نورونهای بینابینی AVA پس سیناپسی C. elegans وارد کرده و بیان آنها را القا کردند. با تحریک نوری ASH، سطح کلسیم درون سلولی AVA افزایش یافته و حرکت عقبگرد موقتی در موجود زنده ایجاد شد.
در مطالعهای دیگر، محققان از GCaMP3-NpHR و RCaMP-ChR2 برای بررسی جزئیات مدارهای میان نورونهای واسطهای AIY در لایهی اول قشرمغز و نورونهای واسطهای RIB و AIZ استفاده کردند.
ایجاد گونههای فعال اکسیژن (ROS) برای از بین بردن سلولها، غیر فعالسازی پروتئینها یا ایجاد جهش در DNA:
زمانیکه کروموفورها فوتون جذب میکنند، میتوانند گونههای فعال اکسیژن تولید کنند. این گونههای فعال اکسیژن با مولکولهای اطراف وارد واکنش شده و آسیب بافتی را منجر میشوند. بخاطر واکنش پذیری سریع و شدید این ترکیبات، اثر آنها موضعی است. بهمین دلیل، کروموفورها میتوانند بعنوان ابزارهای اپتوژنتیکی در از بین بردن سلولها، غیر فعال سازی برگشت ناپذیر پروتئینها یا ایجاد تغییرات سلولی مورد استفاده قرار گیرند.
دو ابزار اپتوژنتیکی با این قابلیت که در مطالعات بر روی C. elegans مورد استفاده قرار گرفتهاند، عبارتند از: KillerRed، و miniSOG (mini singlet oxygen generator).
KillerRed، اولین پروتئین فلورسنت فوتوتوکسیک معرفی شده است. این ترکیب در پی تابش نور سبز (حداکثر تحریک در طول موج ۵۸۵ nm)، باعث تولید سوپراکسید میشود. این کروموفور به کوفاکتور دیگری نیاز ندارد. در کنار مزیتهای این ترکیب، فعالیت آن تنها در حالت هومودیمر بعنوان یکی از ضعفهای killerRed محسوب میشود.
miniSOG، یک فلاووپروتئین فلورسنت است که در پی تابش نور آبی (حداکثر تحریک در طول موج ۴۴۸ nm) ، تولید اکسیژن تک ظرفیتی و دیگر ROSها را منجر میشود. این ترکیب مونومریک بوده و بدون تداخل در عملکرد دیگر پروتئینها، به آنها متصل میشود. miniSOG به فلاوین بعنوان کوفاکتور نیاز دارد؛ و فلاوین به فراوانی در سلولهای C. elegans یافت میشود.
دستکاری اپتوژنتیکی مسیرهای سیگنالینگ سلولی:
تعدادی از ابزارهای اپتوژنتیکی جدید، هدف گیری و کنترل پروتئینهای سیگنالینگ درون سلولی را ممکن ساخته و پنجرهای برای بررسی مسیرهای داخل سلولی درگیر در رفتارهای سلولی غیر طبیعی میگشاید.
محققان از PACα (آدنیلیل سیکلازی که از Euglena gracilis استخراج شده و توسط نور فعال میشود) برای تنظیم سطوح cAMP در نورونهای کولینرژیک C. elegans استفاده کردند. تحریک نوری این پروتئین توسط نور آبی شدید، سرعت حرکت را افزایش داده و باعث کاهش فرکانس تغییر جهت میشود. بررسیهای الکتروفیزیولوژیک نشان داده است با انجام این تحریک، آزاد سازی نورورترنسمیتر در شکاف سیناپسی افزایش مییابد. با این اوصاف، زمان بندی و محل تحریک cAMP برای دستکاری پاسخهای نورونی اساسی است.
در مطالعهای دیگر، محققان از BeCyclOp (یک گوانیلیل سیکلاز که از Blastocladiella emerdoni استخراج شدهاست و در عین حساسیت به نور سبز، به نور بنفش و قرمز نیز پاسخ میدهد) برای بررسی نحوهی کد گذاری سیگنالهای حسی اولیه در C. elegans بهره بردهاند. این پروتئین در نورونهای BAG که بعنوان حسگرهای کربن دی اکسید و اکسیژن عمل میکنند، بیان شدهاست.
در مطالعهای برای دستکاری سیگنالینگ درون سلولی و خارج سلولی، محققان از دی آسیل گلیسرولهای حساس به نور (PhoDAGs) استفاده کردهاند. این ترکیبات برای تحریک به تابشی با طول موج UV-A نیاز دارند.
بهره گیری از اپتوژنتیک برای پایش اثرات دارویی:
در این مطالعات از حلق C. elegans بعنوان نمونهای از سیستم انقباض سیستمیک ماهیچهای استفاده شدهاست. حلق این جاندار شامل ۲۰ سلول ماهیچهای است که با اتصالات شکافی (gap junctions) به یکدیگر متصل هستند. سیستم عصبی حلقی C. elegans نیز شامل ۲۰ نورون است که بصورت مستقل از دیگر اجزای سیستم عصبی، برای عمل پمپاژ حلقی و زمان بندی استراحت ماهیچههای حلقی فعالیت میکنند.
با بیان ChR2 در غشای پلاسمایی سلولهای ماهیچهای حلق، یک سیستم ضربان ساز برای فراهم کردن امکان القای پمپاژ منظم با فرکانس ۵ هرتز ایجاد شدهاست.
هایپرپلاریزاسیون نورونهای حرکتی کولینرژیک توسط NpHR، اثری بر کیفیت تنظیم سرعت پمپاژ اعمال نمیکند، در حالیکه فعالسازی NpHR در حیوانات دست نخورده باعث کاهش سرعت پمپاژ میشود.
این سیستم محقق را قادر میسازد تا اثرات داروها یا جهشهای مختلف را بر پمپاژ حلقی که توسط سلولهای عضلانی کنترل میشود، مطالعه نماید.
دورنمای مطالعات اپتوژنتیک بر روی C. elegans
اپتوژنتیک باعث فراهم آمدن توسعهی آینده نگر و زمینههای مختلف مطالعاتی در نوروبیولوژی C. elegans گردیده است. ابزارهایی که در مطالعات این ارگانیسم مورد استفاده قرار گرفته، میتواند در بسیاری از جنبهها ارتقا یابد. در ذیل به برخی از ایدهها که میتوانند در آینده در مطالعات C. elegans اعمال شوند، اشاره میشود:
- ابزارها و استراتژیهای مطالعاتی جدید برای هدف قرار دادن ارگانلهای سلولی مشخص، امکان کنترل و مطالعه فرآیندهای درون سلولی را بدون تاثیر بر دیگر عملکردهای سلولی فراهم میآورد. برای نمونه، کنترل نوری جریان یون کلسیم در دو سوی غشا یا ثبت سیگنالهای الکتریکی در نمونههای آزادزی elegans، دید تازهای بر مسیرهای پیام رسانی و فیزیولوژی نورونی فراهم خواهد آورد.
- elegans از برنامههای رفتاری پیچیده و سر نخهای حسی متنوعی برای پایش محیط اطراف خود بهره میبرد. ایجاد محیطهای مجازی بر پایهی تحریک اپتوژنتیکی برای فهم عملکردهای محاسباتی نورونی که رفتارهای پایشی بر روی آنها استوار هستند، مفید واقع خواهد شد.
کاربردهای اپتوژنتیک در مطالعات Zebrafish (گورخر ماهی)
ادغام هدف گیری و تحریک نوری سیستم عصبی گورخر ماهی برای تشریح جزئیات مدارهای عصبی
لارو گورخر ماهی، فرصتهای منحصربفردی برای انجام مطالعات اپتوژنتیکی بر روی مدارهای عصبی و رفتار فراهم میآورد. انجام این مطالعات، نیازمند ابزارهای مخصوصی است و موانعی در این مسیر وجود دارد که برای بهره گیری کامل از نتایج این مطالعات، باید بر آنها غلبه شود.
مطالعات علوم اعصاب بر روی گورخر ماهی: ژنتیک + نور + رفتار
لارو گورخر ماهی به دلایل متعدد، سیستم قدرتمندی برای انجام مطالعات اپتوژنتیکی است. رویان گورخر ماهی و لاروهای آن، پیکری شفاف داشته و اندازه مغز لارو این حیوان کوچک است. به این دو دلیل این حیوان، امکان تصویر برداری عمقی مغز با کمک میکروسکوپی دو فوتونی را در مطالعات in vivo فراهم میآورد. دلیل سوم، وجود ابزارهای اپتوژنتیکی مناسب برای بهره گیری در مطالعات گورخر ماهی است که میتوانند به سادگی در سلولهای مشخصی از پیکر این حیوان بیان شوند.
در نهایت، گورخر ماهی مجموعهای غنی از رفتارها را بروز میدهد؛ از جمله عملکردهای حسی پایه (مانند بینایی، شنوایی و حواس دهلیزی) و پاسخهای حرکتی. برای مثال، لارو گورخر ماهی انواع مختلفی از رفتارهای ایجاد شده توسط حس بینایی از جمله پاسخهای حرکتی به تغییرات محیطی، دنبال کردن شکار و جلوگیری از برخورد با موانع را از خود نشان میدهد.
تمامی این ویژگیها در کنار یکدیگر، مزایای مطالعاتی منحصربفردی برای گورخر ماهی در رویکردهای اپتوژنتیکی محسوب میشود.
تحریک نوری در گورخر ماهی که قادر به بروز رفتار است
تحریک نوری ابزارهای اپتوژنتیکی در گورخر ماهی، اغلب در وضعیتی نیمه محدود که لارو گورخر ماهی در آگاروز بیحرکت است، صورت میگیرد. البته آگاروز در ناحیه دم و چشمهای لارو برای پایش رفتارهای آن با کمک دوربینهای سرعت بالا وجود ندارد. این وضعیت، امکان محدود ساختن حجم تابش نور به منطقه مشخصی از مغز لارو را فراهم میآورد.
همچنین در این حالت، بدلیل شفاف و کوچک بودن مغز لارو گورخر ماهی، بسیاری از نقاط مغزی میتوانند بدون انجام اعمال جراحی تهاجمی، تحت تابش نور قرار گیرند.
در برخی مطالعات، لارو گورخر ماهی بدون محدود بودن در آگاروز قادر به بروز رفتارهای مدنظر است. این مطالعات از Aequorin که یک نشانگر بیولومینست است، بهره میبرند. با این وجود، روش مشخص و مدونی برای دستکاری اپتوژنتیکی سلولها در گورخر ماهی آزادزی وجود ندارد.
گزینههای تحریکی بسیاری در مطالعات گورخر ماهی مورد استفاده قرار گرفته است؛ از جمله فیبر نوری، تحریک تک فوتونی، و تحریک دو فوتونی.
تفسیر عملکردهای رفتاری نورونهای گورخر ماهی با بهره گیری از اپتوژنتیک
استفاده از تکنیکهای اپتوژنتیک در گورخر ماهی، عملکردهای نورونهای مشخص در دستگاه عصبی این موجود را روشنتر ساختهاست. در زیر، به مواردی از این یافتهها اشاره میشود.
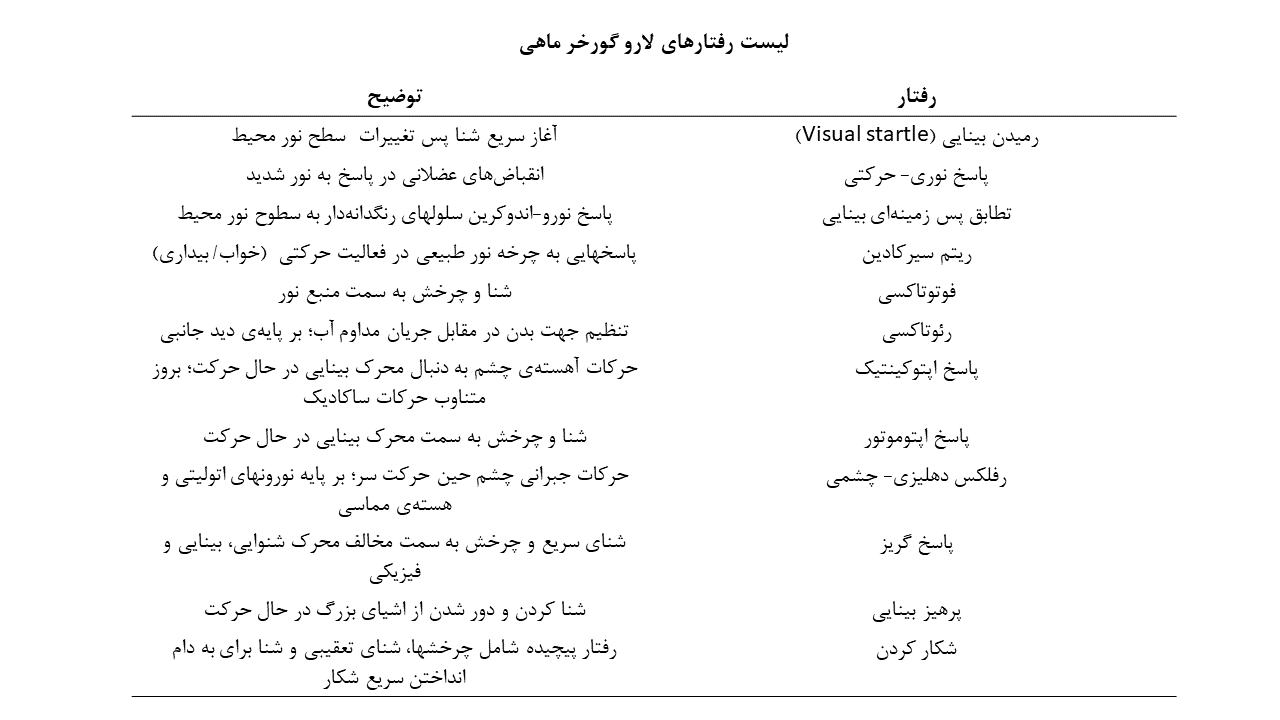
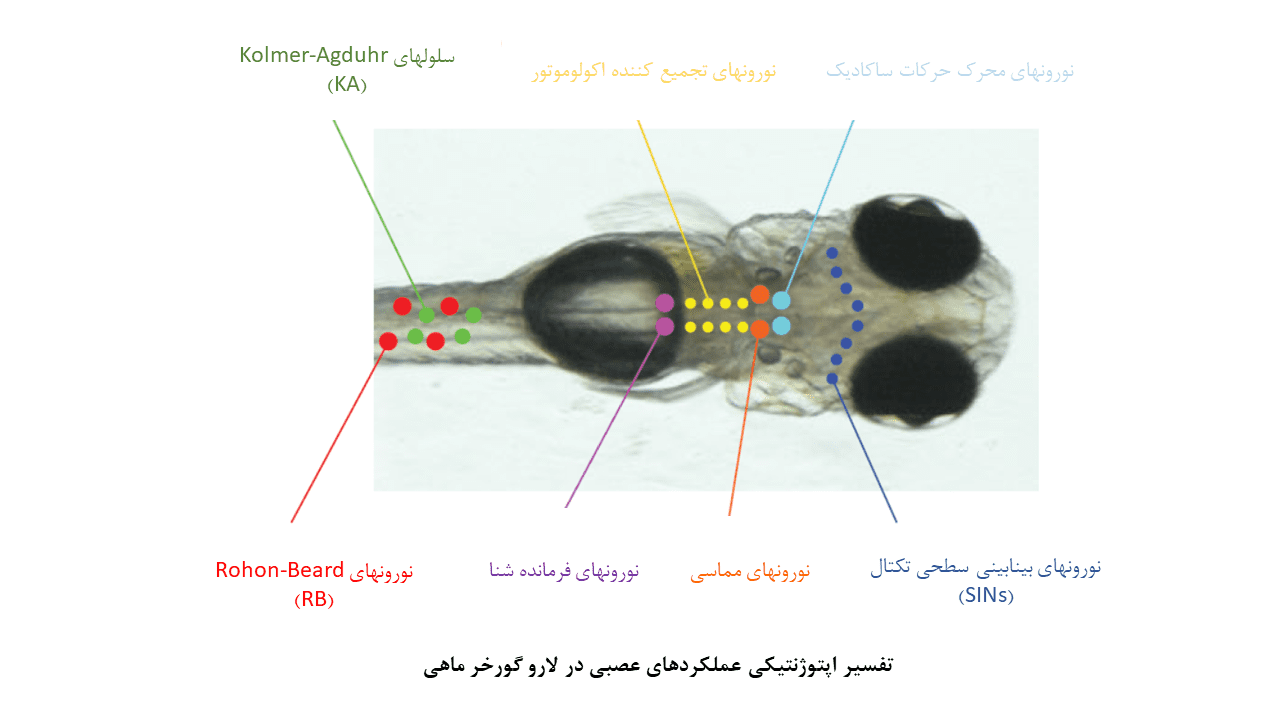
نورونهای طناب نخاعی (سلولهای Kolmer-Agduhr و Rohon-Beard):
نورونهای Rohon-Beard یا RB در رفتار برانگیخته شده توسط تماس فیزیکی، دخیل هستند. فعال ساختن این نورونها با تحریک گیرنده گلوتاماتی پاسخ دهنده به نور (LiGluR) و چنلرودوپسین-۲ (ChR2)، باعث بروز پاسخهای گریز میشود. همچنین تحریک دوطرفهی نورونهای RB باعث فلج شدن لارو میگردد.
نورونهای Kolmer-Agduhr یا KA، سلولهای گابائرژیک (نورونهای آزاد کنندهی نوروترنسمیتر GABA) هستند که در زمان تحریک نوری LiGluR، باعث بروز حرکات ضربهای دم لارو و حرکت به جلو میشوند.
نورونهای فرمانده حرکتی در مغز پسین :
هالورودوپسین (eNpHR) و ChR2 به طور موفقیت آمیزی در گورخر ماهی بمنظور تشریح ارتباطات نورونی در مدارهای پیش حرکتی مرتبط با حرکات چشم و دم، مورد استفاده قرار گرفتهاند. این مطالعات، جمعیتهای متمایز نورونی (مانند نورونهای فرمانده برای حرکت رو به جلو، نورونهای محرک حرکات ساکادیک و نورونهای تجمیع کننده اکولوموتور) را در مغز پسین گورخر ماهی مشخص کردهاند. با مشخص شدن این جمعیتهای سلولی، جهت گیریهای مطالعاتی جدیدتری برای بررسی مدارهای کنترل حرکتی پدید آمده است.
نورونهای مماسی (Tangential neurons) در سیستم دهلیزی:
سیگنالهای دهلیزی که توسط حرکات سر یا بدن ایجاد میشوند، حرکات جبرانی چشم را تحت عنوان رفلکس دهلیزی- چشمی (VOR) برای تثبیت چشمها، رقم میزنند. در لارو گورخر ماهی، اطلاعات دهلیزی که توسط ارگان اتولیتی در گوش درونی لارو شناسایی میشوند، به گروهی از نورونها در مغز پسین تحت عنوان نورونهای مماسی ارسال میشوند. نورونها مماسی، این سیگنالها را به نواحی حرکتی/ پیش حرکتی منتقل ساخته و VOR چرخشی را پایه ریزی میکنند.
نورونهای فیلتر کننده سایز در تکتوم:
نشانگرهای کلسیمی بسیاری از جمله GCaMp در مطالعات گورخر ماهی مورد استفاده قرار گرفتهاست. برای مثال، این نشانگرها در تکتوم بینایی برای شناسایی ویژگیهای عملکردی نورونهای تکتال که در عمق قابل توجهی از مغز قرار گرفتهاند، کاربردی بودهاند. این نورونها با حضور موارد کوچک و در حال حرکت در میدان بینایی، فعال میشوند؛ درحالیکه نورونهای بینابینی گابائرژیک (نورونهای سطحی مهاری، SINها) که در لایههای سطحی تکتوم واقع شدهاند، به محرکهای بینایی بزرگ پاسخ میدهند.
تصویر برداری کلسیمی کل مغز برای بررسی انطباق حرکتی در مقیاس سلول منفرد:
مطالعات تصویر برداری کلسیمی دو فوتونی، وجود یک نقشه فعالیتی وسیع در مغز لارو به هنگام تطبیق پذیری حرکتی را به اثبات رساندهاند. محققان با بیان GCaMP2 در جمعیت وسیعی از نورونهای لارو گورخر ماهی دریافتهاند به هنگام فازهای مشخص حرکت تطبیقی، جمعیتهای نورونی مشخصی فعال میشوند.
دورنمای مطالعات اپتوژنتیک بر روی گورخر ماهی
گورخر ماهی یک سیستم قدرتمند مطالعاتی برای اپتوژنتیک محسوب میشود. بکارگیری اپتوژنتیک در کنار تصویر برداری in vivo با دقت بالا، دید جدیدی برای مرتبط ساختن فعالیت مدارهای عصبی با اصول کنترل پایهای رفتارها فراهم کردهاست. از اهداف آینده مطالعات اپتوژنتیک بر روی گورخر ماهی میتوان به آنالیز رفتارهای پیچیده که بر پایهی فعالیت مشترک ۴ جزء تنظیمی از جمله شرایط درونی، انگیزهها، پاسخهای تطابقی به محیط، و فرآیند تصمیم گیری استوار است، اشاره کرد. چنین رفتارهای پیچیدهای نمیتوانند به درستی با بکارگیری گورخر ماهی دستکاری نشده، مطالعه شوند؛ بهمین دلیل، مطالعات آینده اپتوژنتیک بر روی گورخر ماهی بر پایه دستکاریهای دقیق و پیچیده ژنتیکی و آنالیز بسیار دقیق رفتار در گورخر ماهیهای آزادزی استوار خواهد بود.
کاربردهای اپتوژنتیک در مطالعات بر روی جوندگان
جوندگان بعنوان یک مدل حیوانی پیشرفته برای انجام این مطالعات مورد استفاده قرار گرفتهاند.
تنظیم خواب/ بیداری:
اختلالات خواب/ بیداری به طرز قابل توجهی با بسیاری از اختلالات روانی، مانند افسردگی، اعتیاد و اختلالات اضطراب مرتبط هستند. تغییر حالتهای خواب/ بیداری، تعاملات پیچیدهی جمعیتهای مختلفی از نورونها را شامل میشود که برقرار کردن حالت بیداری و حالت خواب را بر عهده دارند.
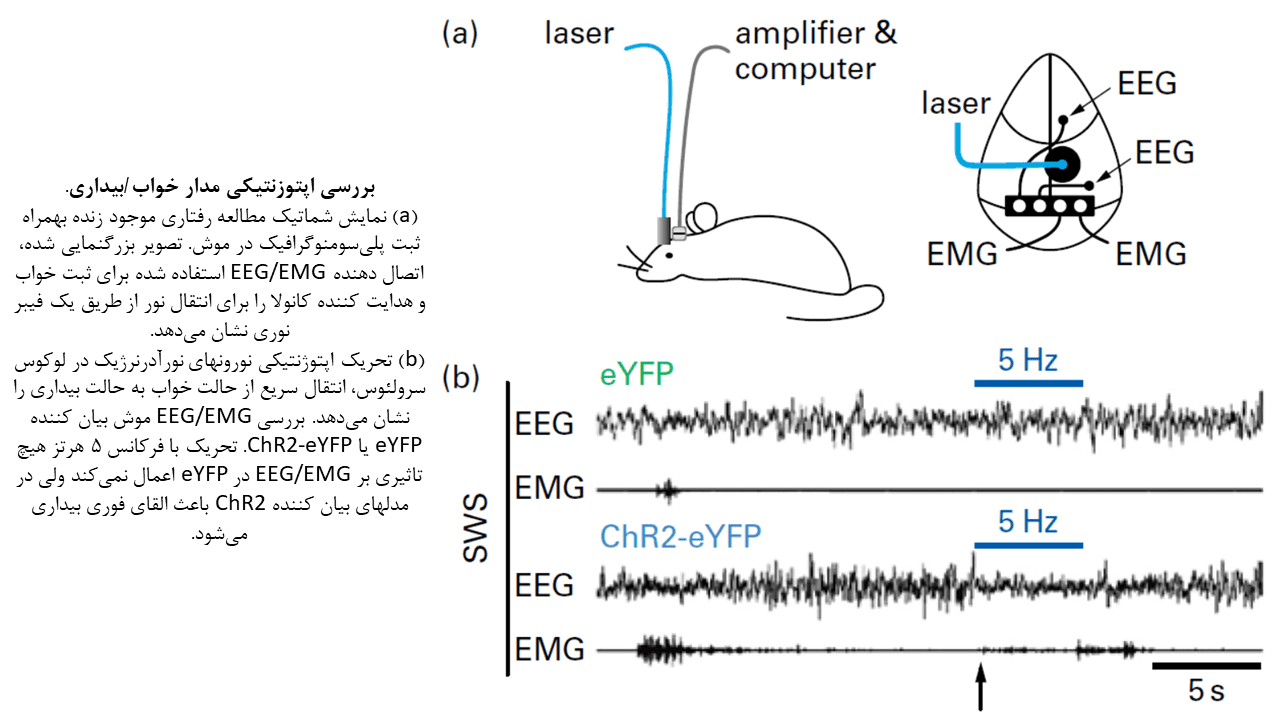
بهره جستن از اپتوژنتیک به پیشرفتهای قابل توجهی در مطالعات دو جمعیت نورونی متمایز منجر شدهاست: نورونهای بیان کنندهی هیپوکرتین، و نورونهای نورآدرنرژیک واقع در لوکوس سرلئوس (LC).
هیپوکرتینها (Hcrt1 و Hcrt2؛ همچنین بعنوان اورکسینها نیز شناخته میشوند) پپتیدهای تحریک کننده عصبی هستند که منحصرا در جمعیتی از نورونهای واقع در هیپوتالاموس جانبی تولید میشوند. این نورونها نقش اساسی در پایدار ساختن بیداری دارند. مهار اپتوژنتیکی این نورونها (نورونهای Hcrt) القای خواب را در زمان روشنایی در پی دارد؛ درحالیکه در زمان تاریکی، باعث القای خواب نمیشود. در عوض، تحریک اپتوژنتیکی این نورونها باعث بیدار شدن حیوان پس از ۲۰ تا ۳۰ ثانیه میشود.
در مطالعه جمعیت دوم، تحریک اپتوژنتیکی نورونهای نورآدرنرژیک LC باعث تغییر سریع از حالت خواب (هم REM و هم NREM) به حالت بیداری میشود. شایان ذکر است این حالت بیداری در عرض کمتر از ۵ ثانیه پس از تحریک ایجاد خواهد شد.
مهار نورونهای LC در کنار تحریک نورونهای Hcrt، باعث متوقف شدن تغییر حالت از خواب به بیداری با واسطه Hcrt میگردد. در حالیکه با تحریک نوری همزمان نورونهای LC و نورونهای Hcrt تسریع تغییر حالت خواب به بیداری مشاهده خواهد شد.
نتایج این مطالعات نشان میدهد فعالیت نورونهای نورآدرنرژیک LC برای ایجاد حالت بیداری و برانگیختگی عمومی حرکتی، کافی است.
اعتیاد:
سوء مصرف طولانی مدت داروها یا الکل باعث القای تطابقهای نورونی دائمی در مسیرهای پاداش میگردد که اختلالات اعتیادی بسیاری را در پی دارد.
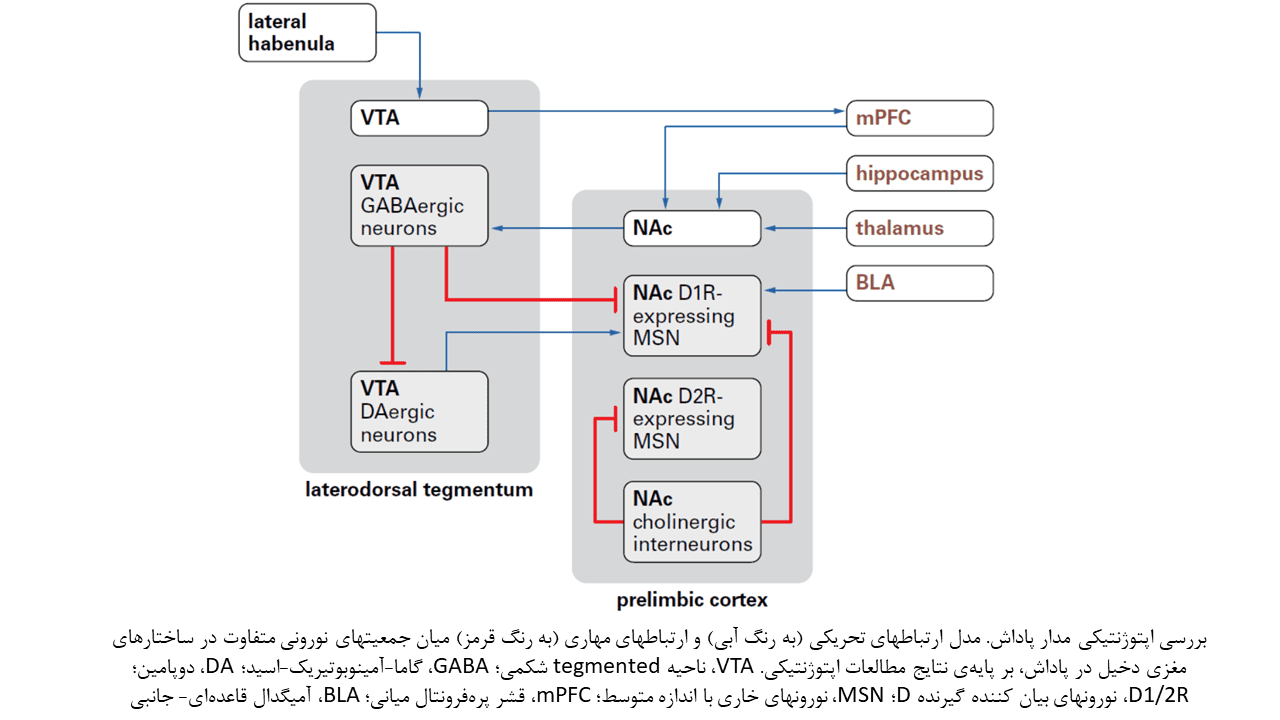
اپتوژنتیک برای تشریح مدارهای نورونی مرتبط با پاداش و شناسایی تطابقهایی که در این مدارها پس از مواجهه با سوء مصرف داروها صورت میگیرد، مورد استفاده قرار گرفته است. دو منطقه مغزی که ارتباط قابل توجهی با یکدیگر داشته و نقش اساسی در تنظیم حس پاداش ایفا میکنند، عبارتند از: منطقه تگمنتال شکمی (VTA)، و هسته اکومبنس (NAc).
VTA، یک ساختار مغزی ناهمگون است که جمعیتهای نورونی مختلفی، از جمله سلولهای دوپامینرژیک، گابائرژیک و گلوتاماترژیک، را در خود جای میدهد. نورونهای دوپامنرژیک، تاثیر گذارترین جزء در مسیر پاداش هستند. این نورونها بصورت تونیک تحریک میشوند که القای حس پاداش را در پی دارد.
مطالعات اپتوژنتیک نشان دادهاست تحریک نوری نورونهای دوپامینرژیک باعث آشکار شدن الگوهای طبیعی آزادسازی دوپامین در استریاتوم میشود. تحریک اپتوژنتیکی این نورونها بصورت فازیک، و نه بصورت تونیک، باعث القای ترجیح مکانی شرطی میشود.
مشخص شدهاست تحریک نورونهای دوپامینرژیک باعث آزادسازی همزمان گلوتامات میشود. آزادسازی گلوتامات نمیتواند مستقیما در پاسخهای معمولی مرتبط با پاداش نقشی ایفا کند، ولی در تنظیم انعطاف پذیری طولانی مدت ورودیهای قشری و لیمبیک که به اعتیاد منجر میشود، دخیل است.
تحریک نوری نورونهای گابائرژیک VTA باعث مهار فعالیت نورونهای دوپامینرژیک میشود و رفتارهای پایانی پاداش را مختل میسازد.
همچنین مطالعات نشان داده است نورونهای دوپامینرژیک به پیامد پاداش و نورونها گابائرژیک واقع در VTA به سر نخهای پیش بینی کننده حساس هستند.
با انجام مطالعات بیشتر مشخص شدهاست بیش از ۹۰ درصد جمعیت نورونهای NAc را نورونهای متوسط خاری گابائرژیک تشکیل میدهند. این نورونها منحصرا نورونهای گابائرژیک VTA را هدف قرار داده و بر اساس گیرنده دوپامین، به دو جمعیت D1 و D2 دسته بندی میشوند.
تحریک اپتوژنتیکی نورونهای بیان کننده گیرنده D1 (یا به اختصار نورونهای DR1)، باعث القای مقاومت مداوم و تحریک نورونهای بیان کننده گیرنده D2 ( یا نورونهای DR2) باعث القای حس تنبیه در فعالیتهای شرطی سازی مکانی میشود.
کمتر از ۱ درصد جمعیت نورونهای NAc را نیز نورونهای بینابینی کولینرژیک تشکیل میدهند که بر عملکرد نورونهای متوسط خاری تاثیر گذار بوده و آنها را مهار میسازند.
در کنار ارتباطات عصبی موضعی، NAc فیبرهای ورودی گلوتاماترژیک را از آمیگدال، قشر پرهفرونتال، هیپوکامپ و تالاموس دریافت میکند. مطالعات اپتوژنتیک نشان دادهاند آزادسازی دوپامین از نورونهای VTA و تحریک فیبرهای گلوتاماترژیک آمیگدال باعث فعالسازی نورونها D1R شده و جستجوی پاداش را تسهیل میکنند. در حالیکه ورودی گابائرژیک از VTA و نورونهای بینابینی موضعی (نورونهای کولینرژیک و D2R) باعث مهار نورونهای D1R و سرکوب رفتار جستجوی پاداش میشود.
مسیرهای جسجتوی پاداش پس از سوء صرف مستمر داروها، متحمل تطابقهایی میشود که اغلب اوقات، اختلالات اعتیادی را در پی دارد. مطالعات اپتوژنتیکی بسیاری نشان میدهد مصرف طولانی مدت کوکائین باعث اختلال مدار پاداش شده و القای پاسخهایی را منجر میشود که در حیوانات سالم، مشاهده نمیشود.
فعالسازی اپتوژنتیکی نورونهای D1R در NAc تاثیری بر فعالیت حرکتی موشهای سالم اعمال نمیکند، در حالیکه همین تحریک در موشهایی که بطور مستمر کوکائین دریافت کردهاند، باعث ارتقای فعالیت حرکتی میگردد. همچنین تحریک نورونهای D1R یا D2R در NAc به تنهایی قادر به القای هیچ یک از شرطی سازیهای مکانی نیست. با این حال، تحریک اپتوژنتیکی نورونهای D1R بهمراه دوز تحت آستانهای کوکائین، القای ترجیح مکانی شرطی شده را منجر میشود. در عوض، کارآیی کوکائین در القای ترجیح مکانی شرطی شده با فعالسازی اپتوژنتیکی نورونهای D2R کاهش مییابد.
تحریک یا مهار نورونهای بینابینی کولینرژیک در NAc، هیچ تاثیر رفتاری در موش سالم ایجاد نمیکند. با این حال، مهار اپتوژنتیکی نورونهای بینابینی کولینرژیک NAc باعث کاهش قابل توجه کارآیی ترجیح مکانی شرطی شده بوسیله کوکائین میشود.
سیگنالهای ورودی گلوتاماترژیک به NAc، خصوصا از قشر پرهلیمبیک، نقشی اساسی در انعطاف پذیری القا شده بوسیله مصرف کوکائین ایفا میکند. مطالعات اپتوژنتیکی نشان میدهد تحریک فیبرهای ورودی اینفرالیمبیک به NAc، باعث معکوس شدن حساس سازی رفتاری القا شده توسط کوکائین میشود. همچنین، مهار مسیرهای آوران قشر پرهلیمبیک به NAc، باعث متوقف شدن جستجوی کوکائین القا شده توسط کوکائین و سر نخ ارائه شده میشود.
به طرز قابل توجهی، مهار مدار پاداش ممکن است باعث القای بیزاری شود. فعالسازی اپتوژنتیکی نورونهای GABA در VTA باعث مهار نورونهای دوپامینرژیک و القای بیزاری مکانی شرطی شده میشود؛ و محرک بیزار کننده، میزان فعالیت نورونهای گابائرژیک را افزایش میدهد. بعلاوه، تحریک اپتوژنتیکی نورونهای واقع در هابنولای کناری، که فیبرهایی به VTA داخلی ارسال میکنند، باعث مهار نورونهای VTA داخلی و القای بیزاری مکانی شرطی شده میگردد.
این نتایج (هم تحریک و هم مهار نورونهای VTA که باعث القای بیزاری میشود) که متضاد بنظر میرسند، ممکن است بدلیل تفاوتهای الگوهای تحریک یا به کارگیری گروههای مختلف نورونهای دوپامینرژیک باشد. با این حال، تمامی این نتایج نشان میدهد مدارهای عصبی که در مسیرهای بیزاری و پاداش دخیل هستند، بطور قابل توجهی مرتبط میباشند.
ترس، اضطراب و افسردگی:
مواجهه طولانی مدت یا شدید با شرایطی که باعث القای ترس یا اضطراب میشوند، دلیل عمدهای برای اختلالات روانی مانند اختلال اضطراب عمومی، اختلال استرس پس از حادثه (PTSD)، و افسردگی محسوب میشود. با بهره گیری از تکنیکهای مرسوم، یک توضیح پایهای برای مدار ترس تعریف شدهاست؛ با این حال، بهره گیری از اپتوژنتیک محققان را قادر میسازد تا به فهم عمیقتری از آناتومی عملکردی جمعیتهای نورونی دخیل در حس ترس و اضطراب دست یابند.
حوادث ناگوار باعث تشکیل خاطرات قوی و ماندگار میشوند. انسانها و حیوانات از طریق یادگیری راتباطی که شرطی سازی ترس نامیده میشود، میآموزند سر نخهای حسی مخصوص یا محرک شرطی شده (CS)، وقایع ناگوار یا محرک غیر شرطی شده (US) را پیش بینی میکنند.
آمیگدال، یک محل اساسی برای شرطی سازی ترس بوده و به هستههای متفاوتی تقسیم میشود که بوسیله مدارهای سازمان یافته، با یکدیگر مرتبط هستند. آمیگدال جانبی (LA)، CS و US را ادغام کرده و انعطاف پذیری ارتباطی را القا میکند. مطالعات اپتوژنتیکی نشان دادهاست تحریک نورونهای هرمی واقع در LA به همراه یک سرنخ حسی شنوایی، همانند یک محرک بیزار کننده، باعث القای شرطی سازی ترس میشود. فیبرهای عصبی خارج شده از LA بصورت مستقیم و غیر مستقیم به هسته مرکزی آمیگدال (CE) منتهی میشوند. زمانیکه LA باعث ادغام CS و US میشود، CE، ایجاد و درک پاسخ شرطی شده (CR) را کنترل میکند.
هسته مرکزی آمیگدال به دو هسته فرعی تقسیم میشود: بخش جانبی هسته مرکزی آمیگدال (CEl)، و بخش داخلی هسته مرکزی آمیگدال (CEm). بخش داخل هسته مرکزی آمیگدال، مدارهای کوچک سازمان یافتهی مشتکل از نورونهای مهاری گابائرژیک را شامل میشود.
مطالعات اپتوژنتیک نشان میدهند فیبرهایی که مستقیما از LA خارج میشوند، نورونهای واقع در CEl را تحریک میکنند. همچنین، CEl باعث انتقال پیام به CEm میشود، و CEm اطلاعات را به دیگر مناطق که خارج از آمیگدال واقع شدهاند، منتقل میکند. مطالعات همچنین نشان میدهند CEl شامل دو جمعیت نورونی است که پاسخهای متضادی به حضور CS پس از شرطی سازی ترس ایجاد میکنند. در حضور CS، نورونهای “روشن” CEl فعال شده و نورونهای “خاموش” CEl غیر فعال میشوند. نورونهای “روشن” CEl، فعالیت نورونهای “خاموش” CEl را کنترل کرده و نورونهای “خاموش” CEl، فعالیت نورونهای “روشن” CEl و نورونهای CEm را تنظیم میکنند.
کاهش فعالیت نورونهای “خاموش” CEl باعث خروج CEm از مهار و القای بی حرکت ماندن میشود. نکته قابل توجه اینکه اکثر نورونهای “خاموش” CEl، گیرندههای اکسی توسین بیان میکنند، و مطالعات اپتوژنتیک نشان داده است تحریک اپتوژنتیکی آکسونهای اکسی توسینرژیک CE، باعث ضعیفتر شدن شرطی سازی ترس میشود. همچنین مطالعات نشان میدهد جسم سلولی نورونهای اکسی توسینرژیک در زیرمجموعه ماگنوسلولار هسته پاراونتریکولار در هیپوتالاموس واقع شدهاند.
نواحی از مغز که CS را انتقال و پردازش میکنند، بصورت مستقیم از US اثر میپذیرند. مطالعات اپتوژنتیکی نشان میدهد قشر شنوایی با US بیزار کننده، فعال میشود. Foot-shock (شوک الکتریکی خفیفی که در زمان انجام مطالعات روان شناختی، در پای حیوان آزمایشگاهی اعمال میشود) باعث فعال شدن نورونهای کولینرژیک در نواحی قاعدهای مغز پیشین میشود که فعال شدن نورونهای بینابینی گابائرژیک در لایه اول قشر شنوایی را در پی دارد. سپس، نورونهای بینابینی لایه اول، نورونهای بینابینی گابائرژیک لایه دوم و سوم قشر شنوایی را که پاروآلبومین بیان میکنند، مهار میکنند. نورونهای بینابینی گابائرژیک لایه دوم و سوم بصورت همزمان، باعث غیر فعال شدن نورونهای هرمی واقع در لایه دوم و سوم میشوند. بهمین دلیل، حضور محرک بیزار کننده باعث القای رفع مهار در قشر شنوایی میشود. رفع مهار نورونهای هرمی توسط محرک بیزار کننده ممکن است در قشر بینایی نیز صورت گیرد؛ این رخداد نشان میدهد محرک بیزار کننده از طریق مسیرهای جانبی به سمت آمیگدال، بر نواحی که CS را برای شرطی سازی ترس ادغام میکنند، تاثیر میگذارد.
شرطی سازی ترس، جزء خاطرهای بسیار قوی دارد، و هیپوکامپ نقش مهمی در تثبیت خاطرههای مرتبط با ترس ایفا میکند. محققان نورونهای جایروس دندانهای را که در زمان شرطی سازی ترس فعال هستند، با بهره گیری از ابزارهای اپتوژنتیکی مانند ChR2 مورد مطالعه و بررسی قرار دادهاند. تحریک دوبارهی این نورونها با الگویی جدید برای القای بی حرکت ماندن، کافی بود. این مشاهده نشان میدهد فعالسازی گروه بخصوصی از سلولها که در رمز گذاری خاطرات دخیل هستند، برای بازیابی خاطرات ترس کافی است. همچنین در مطالعات دیگر نشان داده شدهاست هیپوکامپ برای بازخوانی خاطرات ترس در زمانهای طولانی (نزدیک به یک ماه) پس از شرطی سازی ضروری است.
برخی از مدارهای فوقالذکر، نه تنها ترس را کنترل میکنند بلکه وظیفه کنترل اضطراب را نیز برعهده دارند. مطالعات اپتوژنتیکی نشان میدهد فیبرهای گلوتاماترژیک از آمیگدال قاعدهای-جنبی (BLA) به CE، نقش مهمی در اضطراب ایفا میکنند. فعالسازی نوری این فیبرها باعث کاهش اضطراب میشود، در حالیکه مهار این فیبرها افزایش اضطراب را در پی دارد.
همچنین مطابق نتایج مطالعات متعدد، دانشمندان این فرضیه را مطرح میسازند که فیبرهای گابائرژیک از CE به سمت هسته بستری نوار انتهایی (BNST) نقش اساسی در کنترل اضطراب ایفا میکنند.
افسردگی در میان اختلالات ناتوان کننده قرار دارد و نگرانی عمومی جدی را ایجاد میکند. بسیاری از بیماران از افسردگی مقاوت به درمان رنج میبرند که تنها درمان کارآمد آن تاکنون، تحریک عمقی مغز (DBS) است. با اینکه DBS در درمان بسیاری از بیماریهای روان شناختی و نورودژنراتیو به کار میرود، مکانیسم دخیل در فواید درمانی آن هنوز ناشناخته باقی مانده است.
مطالعات نشان داده است اهداف مستقیم DBS در هسته ساب تالامیک (که برای بیماری پارکینسون مور بررسی قرار گرفته است)، فیبرهای آورانی هستند که از دیگر نقاط مغز منشا میگیرند. شواهد در انسان و موش حاکی از آن است فعالیت نورونی در PFC در افسردگی مقاوم به درمان کاهش مییابد. محققان دریافتهاند تحریک اپتوژنتیکی نورونهای PFC در موشهایی که از نظر اجتماعی به دفعات شکست خوردهاند، باعث بازیابی تعاملات اجتماعی طبیعی و ترجیح سوکروز میشود ولی تاثیری بر رفتارهای مرتبط با اضطراب اعمال نمیکند. در مقابل، برخی مطالعات نشان میدهد تحریک نوری مزمن نورونهای PFC باعث کاهش رفتارهای مرتبط با اضطراب میگردد. با دست یابی به این نتایج متضاد، نیاز به انجام مطالعات بیشتر و دقیقتر احساس میشود.
اوتیسم و اسکیزوفرنی:
اختلال عملکرد اجتماعی یک علامت شناخته شده در بسیاری از بیماریهای روان شناختی است. با اینکه رفتار اجتماعی انسان از بسیاری از مدلهای جوندگان غنیتر است، طیف وسیعی از رفتارهای اجتماعی میتواند با بهره گیری از جوندگان در آزمایشگاه مورد مطالعه قرار گیرد.
این فرضیه مطرح است که نقایص رفتاری مرتبط با اختلالات روان شناختی، مانند اوتیسم و اسکیزوفرنی، از افزایش تعادل سلولی تحریک و مهار (تعادل E/I) در مدارهای نورونی ناشی میشود. این فرضیه با افزایش اپتوژنتیکی تعادل E/I در قشر پروهفرونتال داخلی با بهره گیری از یک اپسین step-function (SSFO) به همراه اپسینهای red-shifted (C1V1) مورد بررسی قرار گرفته است. افزایش میزان تحریک نورونهای هرمی تحریکی به اختلال عملکرد اجتماعی و شناختی که با ویژگیهای اوتیسم مشابه است، منجر میشود.
امواج گاما قشری یک نشانگر برای افزایش پردازش اطلاعات هستند که در بیماران اسکیزوفرنیک شدیدا تحت تاثیرقرار میگیرد. محققان با انجام مطالعات دریافتهاند نورونهای گابائرژیک مهاری که پاروآلبومین را بعنوان پروتئین متصل شونده به کلسیم بیان میکنند، نقشی قابل توجه در تولید امواج گاما برعهده دارند.
با این حال، مطالعات بیشتری برای ارتقای دانستهها در مورد اختلالات تعادل سلولی دخیل در پردازش اطلاعات، مورد نیاز است.
تهاجم:
از جنبههای دیگر حیات اجتماعی که باور منفی عظیمی درباره آن بر جامعه ما حاکم بوده و اطلاعات زیادی در مورد پایه و اساس ژنتیکی آن در دسترس نیست، تهاجم است.
محققان برای بررسی بیشتر مدارهای تهاجم، یک جمعیت نورونی در سطح شکمی – جانبی قسمت شکمی – داخلی هیپوتالاموس را مورد هدف قرار دادند. باور عمومی بر این است که این جمعیت نورونی در زمان تهاجم و جفت گیری فعال میشود. نتایج این مطالعات نشان میدهد زیرمجموعههای نورونی مجزاییی در تهاجم و جفت گیری دخیل هستند. فعالسازی اپتوژنتیکی این نورونها باعث القای تهاجم میشود، در حالیکه مهار دارویی این مجموعههای نورونی، فروکش کردن تهاجم را در پی دارد. نکته قابل توجه اینکه نورونهایی که در زمان تهاجم فعال میشوند، به هنگام جفت گیری مهار میشوند.
تنفس:
آسیبهای طناب نخاعی یا ساقه مغز میتواند به فلجی، و در موارد شدید به ناتوانی در تنفس منجر شود. با این وجود، مدارهای عصبی دخیل در کنترل تنفس بطور کامل آشکار نشدهاند.
محققان فرضیهای مبنی بر فعالیت نورونهای بیان کننده Phox2b واقع در هسته خلف تراپزوئید (RTN) بعنوان کمورسپتورهای تنفسی مرکزی در تنظیم تهویه تنفسی در پستانداران مطرح میکنند؛ ولی اثبات این فرضیه بدون بهره گیری از تکنیکهای نوین، عملا غیر ممکن بود. بهمین منظور، محققان از ابزارهای اپتوژنتیکی برای نشان دادن نقش این نورونها در حس تغییرات شیمیایی مرتبط با تنفس بهره بردند. تحریک نوری نورونهای بیان کننده Phox2b در موشهای بیهوش شده و موشهای بیدار باعث افزایش تنفس میشود.
همچنین محققان با انجام مطالعات اپتوژنتیکی نشان دادند نورونهای سروتونرژیک واقع در رافهی آبسکیوروس (RO) باعث قویتر شدن رفلکس شیمیایی تنفسی مرکزی میشوند.
حملات صرعی:
با اینکه صرع نزدیک به یک درصد جمعیت جهان را تحت تاثیر قرار میدهد، هنوز درمان تاثیر گذاری برای آن وجود ندارد. درمانهای ضد صرع کنونی در اغلب اوقات ناموفق بوده و بسیاری از بیماران، حملات صرعی ادامه دار را تجربه میکنند.
اخیرا محققان با بهره گیری از ابزارهای اپتوژنتیکی به بررسی مکانیسمهای دخیل در حملات صرعی و تشنج پرداخته و تکنولوژیهای جدیدی برای پایش، شناسایی و متوقف ساختن آنها در زمان وقوع ابداع کردهاند.
محققان از مدل موشی صرع با بهره گیری از توکسین کزاز استفاده کردهاند. سلولهای هرمی در قشر مخ این مدلها برای بیان هالورودوپسین دستکاری شده و مهار نوری این نورونها باعث کاهش فعالیت الکتریکی مرتبط با صرع میشود.
همچنین مهار ادامه دار تولید پتانسیل عمل با استفاده از کانال پتاسیمی مهره داران (Kv1.1)، که در حالت طبیعی تحریک پذیری نورونی و آزادسازی نوروترنسمیترها را کنترل میکند، محافظت طولانی مدتی در برابر حملات صرعی فراهم آورد. علاوه بر این، بیان بیش از حد Kv1.1 در طی هفتههای متعدد باعث از بین رفتن کامل حملات صرعی در موشها میشود.
محققان همچنین به دنبال کشف نواحی مغزی دخیل در حملات صرعی پس از سکته مغزی بودند و با انجام مطالعات اپتوژنتیکی دریافتند نورونهای تالاموسی- قشری که به نواحی آسیب دیده قشری مرتبط هستند، پس از سکته مغزی دچار تحریک پذیری بیش از حد میگردند. مهار نوری این نورونها باعث اختلال در تولید حملات صرعی و جلوگیری از گسترش آن در شبکهی تالاموسی- قشری میشود.
در مطالعهی دیگر با استفاده از مدل موشی صرع در لوب تمپورال، محققان نشان دادند فعالسازی نورونهای مهاری و غیر فعال ساختن نورونهای تحریکی واقع در هیپوتالاموس در پی آغاز حملات صرعی، باعث ختم موفقت آمیز حملات صرعی میشود.
کاربردهای اپتوژنتیک در مطالعات پریماتهای غیر انسانی (NHPs)
مغز پریماتهای غیر انسانی (NHP)، نزدیکترین مدل به مغز انسان است. مغز این موجودات، نقشی اساسی در فهم نحوه انجام عملکردهای عصبی، شناخت و رفتار مغز انسان ایفا میکند. تلاشهای مستمر برای رمز گشایی کدهای عصبی در مغز پریماتهای غیر انسانی با ابزارهای جدید و تکنولوژیهای نوینی که با سرعت توسعه یافته و از توانایی کنترل فعالیت سلولهای مدنظر برخوردار هستند، بصورت قابل توجهی ارتقا یافته است.
موفقیتهای اخیر در بهره گیری از تکنیکهای اپتوژنتیکی بر روی پریماتها، اعمال کنترل دقیق بر روی سلولهای مشخص یا نواحی مشخص مغزی را در مقیاس زمانی میلی ثانیه امکان پذیر ساخته است و امکان انجام بررسیهای لازم برای تشریح مدارهای عصبی مغز را فراهم نموده است.
همچنین، نتایج امیدوار کنندهای که از مطالعات اپتوژنتیکی پریماتها حاصل شده است، گام اساسی پیش بالینی در مسیر توسعه درمانهای مبتنی بر دستکاری سلولها محسوب میشود.
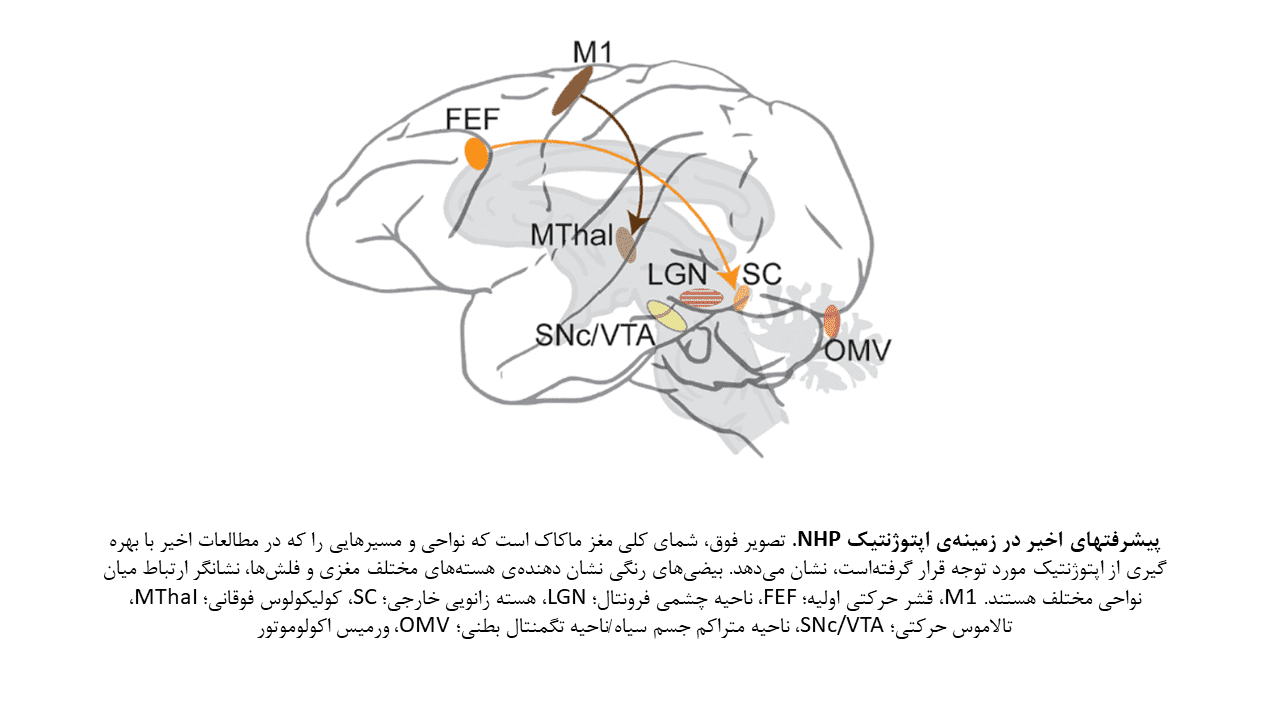
اولین مطالعات اپتوژنتیکی بر روی NHPs، از تحریک نوری بمنظور فعال ساختن نورونهای واقع در قشر حرکتی (M1) و ناحیه چشمی فرونتال (FEF) بهره میبرد. مطالعات بعدی، شواهدی مبنی بر اینکه اپتوژنتیک میتواند در دستکاری رفتارهای NHPs مورد استفاده قرار گیرد، فراهم کردند. بهمین دلیل، اپتوژنتیک بصورت گستردهای در دستکاری فعالیت عصبی و کسب اطلاعات در مورد عملکردها و اختلالات عملکردی مدارهای مغزی در NHPs استفاده شده است.
استفاده از پروموتر CaMKIIα برای هدف گیری سلولهای koniocellular LGN:
سازمان بندی لایهای هسته زانویی خارجی (LGN) در پریماتها به ایجاد سه مسیر ارتباطی که از نورونهای koniocellular، magnocellular و parvocellular منشا گرفته و در قشر بینایی اولیه (V1) پایان مییابد، منجر میشود. وکتور آدنوویروسی ناقل CaMKIIα با موفقیت برای هدف قرار دادن نورونهای konio استفاده شده است.
تحریک بینایی شبکیه نشان داد بسیاری از سلولهای konio که بصورت اپتوژنتیکی قابل شناسایی بودند، پاسخ بینایی ایجاد نمیکنند. این نتایج با یافتههای مطالعات قبلی که نشان میدادند پاسخ سلولهای konio به سیگنالهای خارج شبکهای نیز بستگی دارد، همخوانی داشت.
تحریک اپتوژنتیکی جسم سلولی نورونهای konio در LGN، باعث فعال شدن سلولهای V1 میشد و این مورد، پایان یافتن فیبرهای koniocellular در لایههای سوپراگرانولار V1 را آشکار میساخت.
استفاده از پروموتر TH برای هدف قرار دادن نورونهای دوپامینرژیک:
پروموتر TH در نورونهای دوپامینرژیک، فعال است. TH، آنزیمی است که سنتز دوپامین را کاتالیز میکند. برای هدف قرار دادن نورونهای دوپامینرژیک در میمونهای Rhesus، وکتور ویروسی برای حمل ژن پروموتر TH مورد استفاده قرار گرفت.
در روند انجام این مطالعه، تحریک نوری با پاداشهای مایعات بمنظور تعدیل ارزش پاداش، همراه شد. نورونهای دوپامینرژیک در زمان ارائه علامتی که تحریک اپتوژنتیکی این نورونها را در پی داشت، در مقایسه با حالتی که علامت ارائه شده تنها پاداش را پیش بینی میکرد، پاسخ قویتری ایجاد میکردند.
پاسخهای دوپامینی قویتر نشان میدهد این حیوانات، گزینهای را که تحریک اپتوژنتیکی را شامل میشود، انتخاب میکنند. در واقع، حیوانات علامتی را که با تحریک پاداش اپتوژنتیکی همراه بود، به خاطر پسرده و آن را با فرکانس بیشتری انتخاب میکردند. بهمین ترتیب، تحریک اپتوژنتیکی نورونهای دوپامینرژیک منجر به همبستگی نورونی و رفتاری یادگیری ارزش گردید.
بهره گیری از پروموتور L7 برای هدف قرار دادن سلولهای پورکنژ در مخچه:
ژن L7 و پروموتور آن، نمونهای از تنظیم افتراقی ژن در انواع مختلف نورونهاست. در مخچه، ژن L7 تنها در سلولهای پورکنژ فعال است. القای بیان پروتئین L7 با ساختار پذیری مورفولوژیک دندریتهای سلول پورکنژ و تشکیل سیناپسها همراه است.
در مطالعهای، پروموتور L7 برای بیان ChR2 (در قالب وکتور AAV) بمنظور اِعمال کنترل بر سلولهای پورکنژ ماکاک Rhesus مورد استفاده قرار گرفت. تحریک نوری نقاط مختلف مخچه باعث ثبت پاسخهای تحریکی گردید. برای مثال، تحریک اپتوژنتیکی ورمیس اکولوموتور (ناحیهای که در به وقوع پیوستن دقیق ساکادها دخیل است) باعث بروز دیسمتریهای ساکادیک پیوسته میشد. نتایج حاصل از این مطالعه، امکان بهره گیری از AAV-L7-ChR2 را در بررسی عملکردهای سلول پورکنژ، نشان میدهد.
هدف قرار دادن جمعیتهای نورونی بر اساس گسترش زوائد آنها:
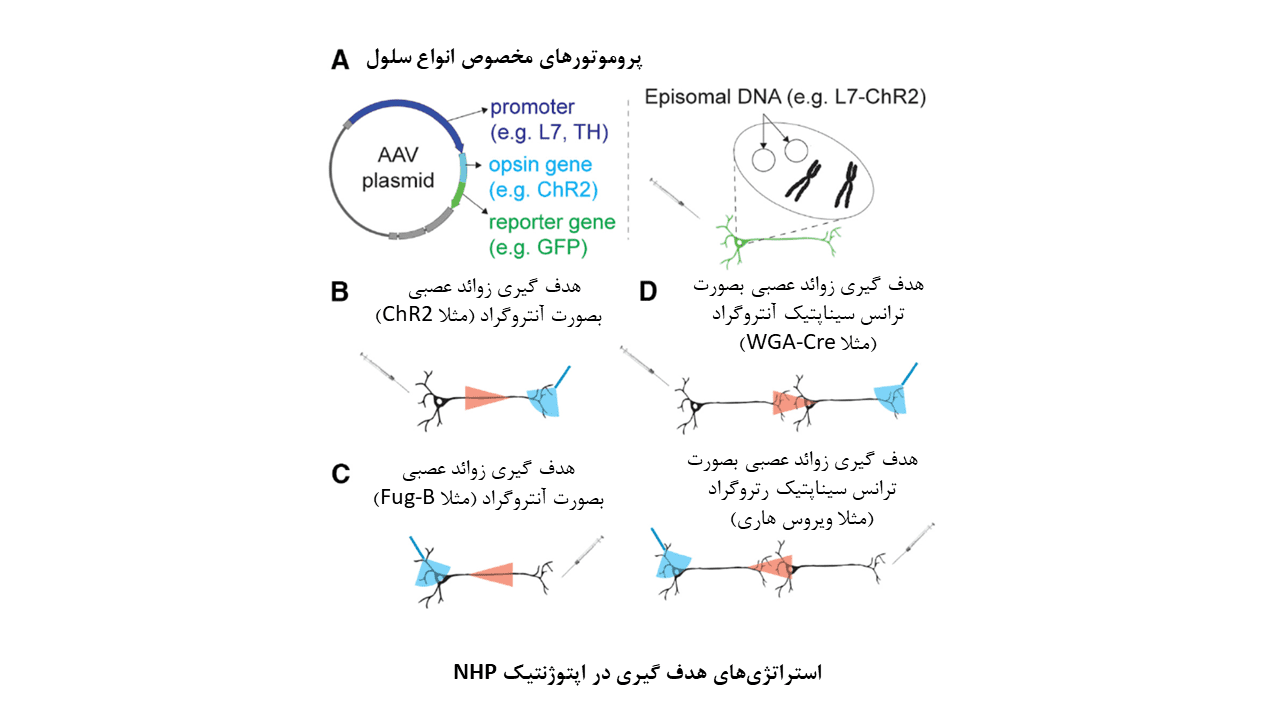
یکی از مزیتهای اساسی اپتوژنتیک، امکان استفاده از آن برای دستکاری انتخابی فعالیت مسیرهای عصبی است که دو ناحیه از مغز را به یکدیگر مرتبط میسازند. تحریک نوری اپتوژنتیکی مسیرهای عصبی بصورت انتخابی میتواند با مکانیسمهای انتقال آنتروگراد، رتروگراد، یا ترانس سیناپتیک همراه باشد.
هدف گیری زوائد عصبی بصورت آنتروگراد، که در آن اپسینهای بیان شده در پایانههای آکسونی فعال میشوند، برای روشن ساختن عملکردهای شبکه عصبی در مغز پریماتها انجام شدهاست.
نمونههایی از هدف گیری زوائد عصبی:
– بصورت آنتروگراد:
- استفاده از وکتور AAV-CMV-ChR2 برای دستکاری انتخابی فیبرهای عصبی میان Frontal Eye Field (FEF) و کولیکولوس فوقانی (SC)
- استفاده از وکتور AAV-CaMKIIα-ChR2 یا AAV-CaMKIIα-C1V1 برای مطالعات مدارهای حرکتی قشری- تالاموسی
– بصورت رتروگراد:
بهره گیری از وکتورهای لنتی ویروسی (LV) با گلیکوپروتئینهای تغییر یافته، هرپس سیمپلکس، آدنو ویروس سگ نوع ۲، AAV با ویژگیهای رتروگراد ذاتی و AAV مهندسی شده با قابلیتهای رتروگراد
دورنمای مطالعات اپتوژنتیک بر روی پریماتهای غیر انسانی
هیجان بکارگیری تکنیکهای اپتوژنتیک در مدلهای حیوانی به مدلهای میمون نیز طی چند دهه اخیر گسترش یافتهاست. با افزایش منابع مالی در دسترس، دانشمندان اکنون میتوانند از وکتورهای ویروسی با کیفیت بالا و استراتژیهای ساده و کارآمد بمنظور ثبت و کنترل فعالیتهای عصبی در پریماتهای غیر انسانی بهره جویند.
در زمان حال مزیت عمدهی مطالعات اپتوژنتیکی بر روی پریماتهای غیر انسانی، توانایی تحریک مستقیم نورونها و غیر فعالسازی آنها با دقت زمانی میلی ثانیه است. همچنین فعالسازی مسیرهای عصبی مخصوص در مغز پریماتها بکمک بیان رتروگراد اپسینها، از دیگر مزیتهای مطالعات میباشد.
در نقطه مقابل این مزیتها، اپتوژنتیک با برخی چالشها در مطالعات پریماتها مواجه است. در این مطالعات، بکارگیری فیبرهای نوری کاشت شده به مدت طولانی، ممکن نیست و محققان باید برای تسهیل انجام مطالعات، به دنبال راهکار قابل قبولی باشند. همچنین، جعبه ابزار اپتوژنتیکی که برای این مطالعات مورد استفاده قرار میگیرد، ابزارهای اندکی را شامل شده و برای مقاصد مطالعاتی دیگر، ابزارهای بیشتر و پیشرفتهتری مورد نیاز است.