پیشرفتها و چالشهای پیش روی ایمونوتراپی سرطان
ایمونوتراپی سرطان، یک روش درمانی است که توانایی سیستم ایمنی فرد را در مبارزه با سلولهای سرطانی، با هدف دست یابی به سلامت کامل و طولانی مدت، ارتقا میبخشد. گزینههای درمانی جدید در این روش، آنتی بادیهای مونوکلونال، واکسنهای سرطان، مهارکنندههای نقاط وارسی ایمنی، و درمان برپایهی سلولهای T با گیرنده آنتی ژنی کایمریک (CAR-T) را شامل میشود.
ایمونوتراپی سرطان بعنوان یکی از استراتژیهای درمانی امیدوارکننده برای ایجاد پاسخهای پایدار در بیماران محسوب میشود. این درمان خارق العاده، یک یا چند گام از “چرخهی ایمنی سرطان” را مورد هدف قرار میدهد. در بیماران مبتلا به سرطان، سلولهای توموری موانع متعددی برای مختل ساختن تکمیل این چرخه سرکوب کننده تومور، ایجاد میکنند. سیگنالهای انکوژنیک با القای بیان کموکاینهای درونزاد باعث اختلال مهاجرت سلولهای دندریتیک (DCs) و نقص فعال شدن لنفوسیتهای T سیتوتوکسیک (CTLs) میگردند. همچنین این سیگنالها، تمایز DC را مختل ساخته و در شرایطی باعث تبدیل DCهای ضد توموری به DCهای پیش توموری میشوند. در حقیقت، ایمونوتراپی بر پایه DC بدلیل دشواریهای تثبیت مرحله بلوغ DCها و عدم توانایی مهاجرت DCهای تزریق شده به عقدههای لنفی درناژ کنندهی تومور (dLNها)، در بسیاری از بیماران مبتلا به سرطان از کارآیی کافی و امیدوارکنندهای برخوردار نمیباشد. علاوه بر این موارد، سلولهای سرطانی میتوانند یک میکرومحیط ضد سرکوب توموری برای جلوگیری از ارتشاح سلولهای T و کاهش عملکرد سلولهای T عملکردی، ایجاد کنند.
از میان تمامی مراحل چرخه ایمنی سرطان، فعالسازی سلول T در dLNها بعنوان عامل تعیین کننده در قدرت پاسخ ایمنی ضد توموری محسوب میشود. سلولهای T به دو سیگنال برای ایجاد پاسخ ایمنی کارآمد، نیازمند هستند: سیگنال فعالسازی ۱ که از طریق اتصال گیرنده سلول T یا TCR با آنتیژن مکمل ارائه شده بر روی DCها منتقل میشود؛ و سیگنال کمک تحریکی ۲ که با تعامل میان مولکول CD28 و مولکول B7) CD80/86) ایجاد میشود.
تلاشهای اولیه برای اِعمال رویکردهای زیست شناختی مصنوعی بمنظور تنظیم سلولهای T در اکثر موارد به افزایش قدرت سیگنالینگ فعالسازی لنفوسیتها منجر میشد. پس از سالها مطالعه محققان با ترکیب واحدهای کلیدی سیگنالینگ TCR و گیرندههای کمک تحریکی، سلولهای T درمانی مهندسی شده را معرفی کردند که گیرندههای آنتی ژنی کایمریک (CARs) بیان میکردند. این سلولها از توانایی بالقوه برای درمان بدخیمیهای خونی برخوردار هستند.
یک CAR معمولی از یک قطعه متغیر تک زنجیرهای (scFv)، یک ناحیه خلال غشایی و دو توالی داخلی که از CD28 و ۴-۱BB مشتق شدهاند، تشکیل میشود. scFV آنتی ژنهای مختص تومور را شناسایی میکند. ناحیه خلال غشایی، زنجیره CD3z میباشد که سیگنال فعالسازی ۱ را برای سلولهای T فراهم میآورد. دو توالی داخلی نیز سیگنال ۲ را فراهم میکنند.
با این وجود، کاربرد درمان CAR-T cell بدلیل اثرات بالینی شدید و اثرات جانبی سمیت “بر روی هدف، خارج از تومور”، از جمله سندرم آزادسازی سیتوکاین که از آزادسازی نامحدود سیتوکاینها توسط سلولهای T فعال شده ناشی میشود، محدود است. بهمین دلیل، هنوز نیاز بالینی به توسعه درمانهای CAR-T ایمنتر که پاسخ ضد توموری را بتوان با دقت فضایی-زمانی بالا کنترل کرد، مرتفع نشدهاست.
پیشرفتهای اخیر در زمینه درمانهای ضد سرطان طیف وسیعی از روشها، از فعالسازی سلولهای T تا خارج ساختن ایمنی ضد توموری از سرکوب را شامل میشود.
در پی فعالسازی سلولهای T، سیگنالهای کمک مهاری نیز با واسطهی پروتئین مرتبط با لنفوسیت T سیتوتوکسیک ۴ (CTLA-4) و پروتئین مرگ برنامه ریزی شده ۱ (PD1) برای محدود ساختن پاسخهای ایمنی با واسطه سلول T، ایجاد میشوند. سلولهای سرطانی نیز با دستکاری این نقاط وارسی ایمنی درونی مرتبط با سلولهای T، از شناسایی و آسیب توسط سیستم ایمنی میگریزند. اغلب اوقات افزایش بیان PD-L1 در سطح سلولهای توموری از طریق مکانیسمهای با واسطه سلولهای ایمنی (سیگنالینگ اینترفرون I/II) یا با واسطه انکوژنها (مانند Myc) برای تسهیل گریز از سیستم ایمنی، القا میشود. در پروتکلهای درمانی از آنتی بادیهای مونوکلونال ضد نقاط وارسی ایمنی (ipilimumab علیه CTLA-4، یا nivolumab و pembrolizumab علیه PD-1) برای از سرگیری دوبارهی چرخه ایمنی سرطان استفاده میشود. برخلاف پیشرفتهای ایجاد شده در این زمینه، ایدهآلترین درمان باید امکان هدف گیری دقیق و کنترل برگشت پذیر شبکه سیگنالینگ ایمنی را فراهم کند. بدین صورت درمانگران میتوانند به هنگام درمان شخصی شده بیماران مبتلا به سرطان، زمان، مکان، و دوز عوامل درمانی را برای کاهش اثرات جانبی تنظیم کنند. بمنظور نیل به این هدف، محققان ترکیب اپتوژنتیک و مهندسی ایمنی (immunoengineering) را برای توسعه ایمونوتراپیهای هوشمندتر با کارآیی و ایمنی بالا پیشنهاد میدهند.
زمانیکه اپتوژنتیک، ایمنی شناسی را ملاقات میکند
بدلیل عدم امکان غلبه بر انعطاف پذیری و دقت فضایی زمانی در دستکاری مسیرهای بیوشیمیایی، حیطهی اپتوژنتیک مبتنی بر مولکولهای غیر اپسین به پیشرفتهای زیادی در زمینه زیست شناسی سلولی دست یافته است. طی دهه اخیر، ما شاهد افزایش ناگهانی واحدهای حساس به نور با کدگذاری ژنتیکی بودهایم.
مهندسی ایمنی زمینه مطالعاتی در حال رشدی است که به تلاشهای چند زمینهای مهندسان، متخصصان شیمی نانومواد، ایمونولوژیستها، و زیست شناسان سرطان نیازمند است. یکی از ایدههای نسبتا جدید در زمینه مطالعات ایمنی شناسی، ادغام اپتوژنتیک با مهندسی ایمنی میباشد. این رویکرد که تحت عنوان optoimmunoengineering شناخته میشود، از مزایای منحصربفردی نسبت به تلاشهای کنونی برای ارتقای ایمونوتراپی برخوردار است. در وهله اول این رویکرد برخلاف روشهای مرسوم دستکاری ژنتیکی (مانند کاهش بیان، ایجاد جهش، یا القای بیان بیش از حد) که ویژگیهای فضایی-زمانی شبکه سیگنالینگ را دستکاری میکنند، از سوئیچهای نوری با کد گذاری ژنتیکی که میتوانند بدون به جای گذاشتن اثرات جانبی طولانی مدت باعث فعال یا غیرفعال شدن پروتئینها یا بیان ژن با دقت زمانی بالا شوند، بهره میبرد. همچنین رویکردهای اپتوژنتیکی محققان را قادر میسازد تا کنترل فضایی-زمانی دقیقی بر سلولهای مهندسی شده اعمال کنند.
در مقایسه با سلولهای CAR-T مرسوم که فاقد امکان کنترل با دقت زمانی بالا هستند، طراحی سلولهای CAR-T فعال شونده توسط نور میتواند امکان فعالسازی انتخابی “عوامل درمانی” را در محل دلخواه تومور بمنظور به حداقل رساندن سیتوتوکسیسیتی خارج توموری فراهم آورد.
زمانیکه تکنیکهای اپتوژنتیکی در مطالعه و مداخلات چرخه ایمنی سرطان وارد میشوند، نه تنها امکان غلبه سلولهای ایمنی بر موانع انرژی ایجاد شده توسط میکرومحیط سرکوب کننده ایمنی را فراهم میآورند، بلکه مکانیسمهای جدیدی را که در ایمنی ضد توموری و مقاومت به ایمونوتراپی دخیل هستند، آشکار میسازد. در ادامه، به مواردی از نمونههای بیشمار optoimmunoengineering که رویدادهای سیگنالینگ مورد نیاز برای فعالسازی سلولهای T را هدف قرار میدهند، اشاره میشود.
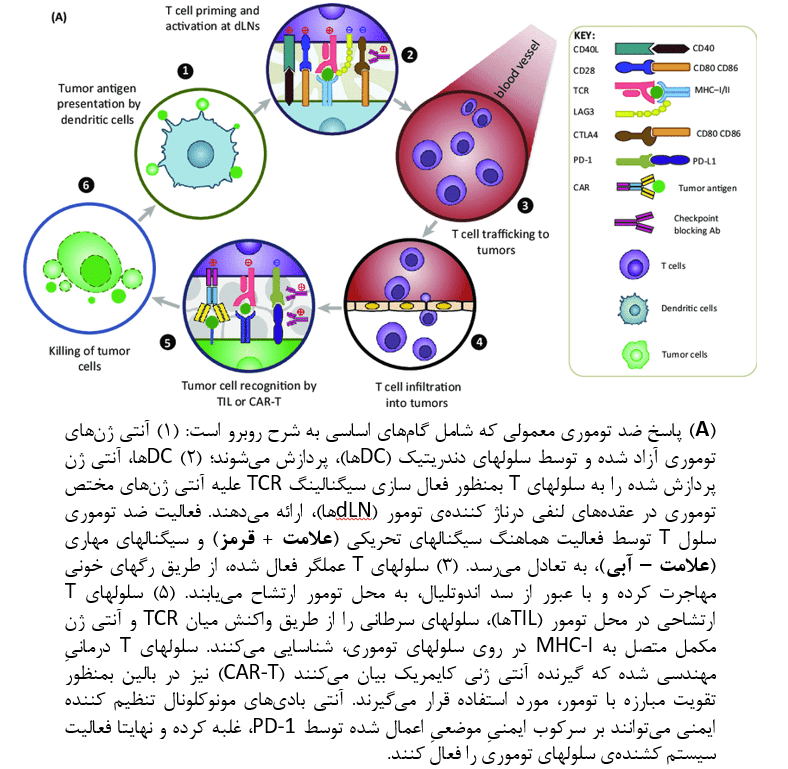
Opto-CRAC
کانالهای کلسیمی فعال شونده با آزادسازی کلسیم (کانالهای CRAC)، که از مولکول تعامل استرومایی (STIM) و ORAI تشکیل میشود، بمنظور میانجی گری در ورود کلسیم به درون سلول و کنترل بیان ژن وابسته به کلسیم، بر سطح بسیاری از سلولهای ایمنی وجود دارد.
پس از اتصال گیرندههای ایمنی با آنتی ژنها و تخلیه کلسیمی متعاقب در رتیکولوم آندوپلاسمی، کانالهای CRAC بمنظور از سر گیری جابجایی هستهای فاکتور هستهای سلولهای T فعال (NFAT)، فعال میشود. فعالسازیNFAT، القای بیان سیتوکاینها و دیگر ژنهای دخیل در پایداری عملکرد سلولهای ایمنی را در پی خواهد داشت. علاوه بر نقش اثبات شدهی جابجایی درون سلولی کلسیم در به جریان انداختن فعالسازی لنفوسیتهای T، این فرآیند باعث فعالسازی اینفلامازوم در ماکروفاژها، بلوغ DCها، و ارائه آنتی ژن در این سلولها میگردد.
محققان برای مرتفع ساختن نیاز به محرک فیزیولوژیک یا تخلیه کلسیم ذخیره شده برای ورود کلسیم به درون سلول، با شبیه سازی یک سوئیچ ساختاری در STIM1، یک سیستم Opto-CRAC برای فعالسازی نوری جریان کلسیم به درون سلول و به جریان انداختن پاسخهای وابسه به کلسیم در سلولهای ایمنی، طراحی کردهاند.
زمانیکه این سیستم در DCهای درمانی در یک مدل موشی ملانوما بیان شد، کانالهای Opto-CRAC مهندسی شده بعنوان “ادجوانتهای فعال شونده توسط نور” بمنظور ارتقای بلوغ DCها و ارائه آنتی ژن عمل کردند. بهمین ترتیب بلوغ و فعالسازی سلولهای T تسهیل شده و از بین بردن سلولهای ملانوما و متاستازهای آن در نقاط دوردست، تسهیل گردید.
همچنین سیستم Opto-CRAC میتواند برای اعمال کنترل دقیق بر سیگنالینگ کلسیم/NFAT در سلولهای CAR-T درمانی مورد استفاده قرار گیرد. بدین ترتیب بعنوان یک عامل سینرژیست در کنار سیگنال ۱ با واسطهی TCR برای تقویت پاسخ ایمنی ضد توموری در محل تومور، عمل میکند.
این مورد که سیگنالینگ کلسیم در الگوهای موقتی یا نوسانی، فعالیت NFAT پایین دست را بصورت دینامیک کنترل میکنند، اثبات شده است. با این حال، این مورد که دامنه، فرکانس و چرخه عملکردی نوسان کلسیم چگونه در رونویسی ژن دخیل است، هنوز آشکار نیست.
سیستم Opto-CRAC که منحصرا باعث تولید سیگنالهای کلسیمی شده و پیچیدگیهای پیام رسانهای ثانویه دیگر را ندارد، میتواند بعنوان یک ابزار رونویسی اپتوژنتیکی برای مدلسازی و تنظیم نوری خروجی رونویسی وابسته به کلسیم/NFAT مورد استفاده قرار گیرد.علاوه بر کلسیم، لیپیدهای فسفواینوزیتید نیز نقشی اساسی در شکل دهی مدت و قدرت سیگنالینگ TCR، و کنترل حرکت و کموتاکسی سلول برعهده دارند. با بکارگیری برگشت پذیر دامنههای فسفاتاز یا کیناز موجود در آنزیمهای تبدیل کنندهی لیپید بهمراه دیمرایزرهای حساس به نور در غشای پلاسمایی (PM)، به راحتی میتوان مقدار فسفواینوزیتیدهای ساکن غشای پلاسمایی، خصوصا PI(4,5)P۲ و PI(3,4,5)P۳، را با واسطهی نور بمنظور کنترل عملکرد عملگرهای پایین دست، دستکاری کرد. سهولت دسترسی به این ابزارها میتواند باعث پیشرفت بیشتر کنترل اپتوژنتیکی سلولهای ایمنی گردد.
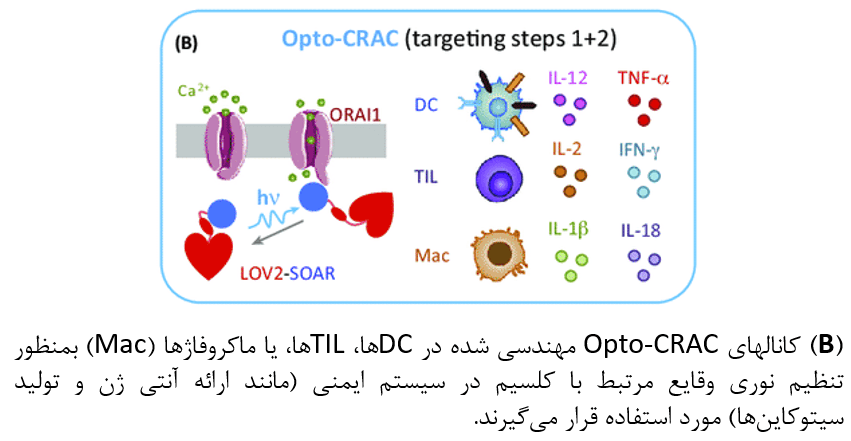
PA-CXCR4
مهاجرت و ارتشاح ناکارآمد سلولهای ایمنی درمانی به محل تومور، یکی از چالشهای عمدهی کنونی در درمانهای انتقال سلول گیرنده (ACT) میباشد.
محققان با بکارگیری مزیت روابط ساختاری-عملکردی مشترک میان گیرندههای کموکاینی و رودوپسینهای پاسخ دهنده به نور، یک گیرنده کموکاین C-X-C نوع ۴ که توسط نور فعال میشود (PA-CXCR4)، طراحی کردهاند. محققان از این گیرنده برای کنترل حرکت و مهاجرت سلول T استفاده میکنند.
CTLهای بیان کنندهی PA-CXCR4، مهاجرت جهت دار یا فوتوتاکسی را هم در مطالعات in vitro و هم در مطالعات in vivo از خود بروز دادهاند. تحریک نوری در محل تومور باعث افزایش ارتشاح درون توموری CTLها بمنظور ارتقای اثر گذاری درمان ACT شدهاست. با توجه به نقش اساسی شبکهی گیرنده کموکاین-کموکاین در هدایت چرخه ایمنی سرطان، این رویکرد میتواند بصورت مشابه برای اعطای ویژگی حساسیت به نور در انواع گیرندههای کموکاینی دیگر که در مکانیسم homing سلولهای دندریتیک به dLNها دخیل هستند (CCR7) یا موجب بکارگیری سلولهای T در محل تومور میشوند (CXCR3 و CCR5)، مورد استفاده قرار گیرد.
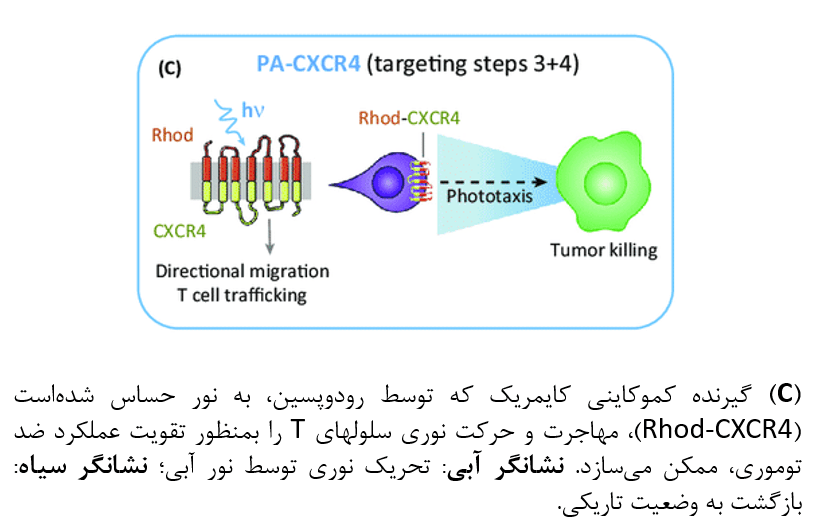
CARهای فعال شونده توسط نور
یکی از اثرات جانبی با اهمیت درمانهای CAR-T کنونی، سیتوتوکسیسیتی “در بیمار هدف، خارج از تومور” (on-target,off-tumor) میباشد. این مسئلهی ناخواسته، از بیان مشترک آنتی ژنهای هدف در بافت طبیعی و بافتهای سرطانی ناشی میشود، بهمین دلیل سلولهای CAR-T در بافتهای غیر پاتوژن نیز باعث آسیب میگردند. تلاشهای اخیر برای تخفیف این اثر جانبی شامل طراحی یک گیرندهی کوچک مولکولِ کایمریک برای سلول T است که در آن، سیگنال ۱ (تحریک آنتی ژنی) و سیگنال ۲ (سیگنال کمک تحریکی) تنها در حضور یک مولکول هترودیمریزه کننده برونزاد تولید میشوند.
از نظر تئوری بازیابی عملکرد این گیرندههای آنتی ژنتی کایمریک جدا در حضور تابش نور، با جایگزین ساختن دامنههای دیمریزاسیون شیمیایی با توالیهای دیمریزاسیون القا شونده توسط نور، قابل بازیابی است. همچنین در یک استراتژی طراحی مشابه، تبدیل سیگنالهای کمک مهاری به سیگنالهای تحریکی از طریق ایجاد دوبارهی گیرندههای کایمریک جدا که شامل دامنه خارج سلولی PD1 و دامنههای داخل سلولی مولکولهای کمک تحریکی میباشند، امکان پذیر است.
سیستمهای بیان ژنی تنظیم شونده توسط نور
استراتژی مهندسی ایمنی دیگری که نیاز به بررسی بیشتری دارد، دستکاری نوری بیان ژنهای تنظیم ایمنی است. برای نمونه، سیستم Opto-CRAC که پیشتر مطرح شد، میتواند برای القای نوری تولید IL-12 توسط سلولهای T در محل تومور که مختص آنتی ژنهای توموری و وابسته به کلسیم میباشد، باز برنامه ریزی شود. IL-12 یک القا کنندهی بالقوهی ایمنی ضد توموری با تقویت پاسخ سلول T سیتوتوکسیک و سلول کشنده طبیعی (NK) میباشد. برخلاف تجویز سیستمیک IL-12 که بنظر میرسد سمیت عمومی را منجر میشود، تولید IL-12 تحت کنترل نور در میکرومحیط توموری امیدها را در مورد جلوگیری از بروز اثرات جانبی خارج از تومور، زنده نگه داشته است.
علاوه بر موارد عنوان شده، سیستمهای ویرایش ژنومی و رونویسی فعال شونده توسط نور، که بر پایهی Cas9 جدا یا dCas9 با قطعات دیمریزاسیون القا شونده توسط نور ایجاد شدهاند، پلتفرمهای ساده و پرکاربردی برای دست یابی به مهندسی ژنومی و باز برنامه ریزی رونوشتی در ژنهای درونزاد فراهم میآورند. ابزارهای ویرایش اپی ژنومی مشابه میتوانند از طریق هترودیمریزاسیون Cas9 غیر فعال با تنظیم کنندههای اپی ژنومی که توسط نور القا میشود، تولید شوند.
بازسازی نوری (اپی)ژنومی در سطوح رونویسی یا اپی ژنتیک میتواند بعنوان یک مدخل قوی برای ورود به محیط کنترل برگشت پذیر بیان ژن در لوکوسهای تعریف شده توسط بیمار (مانند CTLA-4، PD1، یا PD-L1) بدون تغییر کد گذاری ژنتیکی، محسوب شود. این ابزارها در آینده نه چندان دور در تشریح مکانیسم اثرات معمول (اپی)ژنوتیپ بر بیماریهای فنوتیپی، پاسخ دارویی، و مقاومت به ایمونوتراپیها، مورد استفاده قرار خواهند گرفت.
واحدهای حساس به نورِ طراحی شده برای Optoimmunoengineering
در اپتوژنتیک تا بحال مجموعهی گستردهای از دامنههای حساس به نور یا گیرندههای نوری، که به انواع مختلفی از پرتوها از پرتو فرابنفش (UV) گرفته تا تابش نزدیک فروسرخ (NIR) حساس هستند، توسعه یافتهاند که نشان دهندهی ظرفیتهای متفاوت نفوذ در بافت میباشد. ویژگیهای فیزیکی-شیمیایی این ابزارها و کاربرد آنها مورد مطالعه قرار گرفته و نتایج این مطالعات بصورت گسترده منتشر شدهاست. در این بخش، ۳ استراتژی طراحی عمومی که میتوانند در دستکاری شبکه سیگنالینگ ایمنی و ایجاد مدارهای مصنوعی در سلولهای ایمنی مورد استفاده قرار گیرند، بررسی خواهد شد.
- هترومولتیمریزاسیون پروتئین-پروتئین (القا شونده با نور)
پرکاربردترین استراتژی برای دستکاری نوری سیگنالینگ سلولی، از تغییرات ساختاری ایجاد شده در پی جذب فوتون برای هترودیمریزاسیون دو پلی پپتید، بهره میبرد. این سیستمهای نوری دو جزئی معمولا از یک پروتئین حساس به نور (جزء A) و یک دامنه عملگر (جزء B) تشکیل میشوند. جزء B در حالت تاریک، ترجیحا به جزء A اتصال مییابد.
اغلب اوقات یکی از این اجزا بمنظور فراهم کردن امکان جابجایی پروتئین حساس به نور، به یک جزء تحت سلولی یا غشای پلاسمایی متصل است. بهمین ترتیب، با متصل کردن پروتئینهای سیگنالینگ به، یا حذف پروتئینهای سیگنالینگ از، محل طبیعی عملکرد آنها، فرآیند انتقال سیگنالی در سلولهای ایمنی میتواند با سرعت پس از تحریک نوری، آغاز یا متوقف شود.
در حالت ایدهآل میتوان با هترودیمریزاسیون اجزای عملکردی که بصورت جداگانه باعث انتقال سیگنالهای فعالسازی ۱ و کمک تحریکی ۲ میشوند، یک سیگنال “فعال” القا شده توسط نور در زمینه مهندسی CARهای فعال شونده توسط نور ایجاد کرد. از سوی دیگر، یک ابزار تفکیک القا شونده توسط نور (مانند تله LOV2 و آزادسازی پروتئین، یا سیستم LOVTRAP) میتواند طراحی انواع هوشمندتر CAR را که در حالت تاریکی فاقد عملکرد درمانی هستند، ممکن سازد. برای نمونه، یک جفت مولکول حساس به نور که در حالت تاریکی به یکدیگر اتصال مییابند، میتوانند باعث جلوگیری از شناسایی آنتی ژن توسط scFv گردند. با تحریک نوری، این دو جزء از هم جدا شده و محل شناسایی آنتی ژن توموری را در معرض سلولهای CAR-T مهندسی شده قرار میدهند.
علاوه بر موارد عنوان شده، امکان طراحی یک دستگاه خودکشی اپتوژنتیکی نیز وجود دارد که یک سطح ایمنی اضافی به درمان CAR-T میافزاید. بعنوان نمونه، محققان با بهره گیری از اپتوژنتیک، پروتئین پیش آپوپتوزی Bax را برای حرکت به سمت غشای خارجی میتوکندری و آغاز آپوپتوز، مهندسی کردهاند. این استراتژی میتواند برای وادار ساختن سلولهای CAR-T به خودکشی پس انجام ماموریتشان در محل تومور، مورد استفاده قرار گیرد.
- تجمیع پروتئینها با القای نوری
دامنههای حساس به نور بسیاری از گیاهان و باکتریها استخراج شدهاند که در پی تحریک نوری، متحمل گذار مونومر به الیگومر میشوند. این ویژگی منحصربفرد بمنظور القای الیگومریزاسیون موضعی پروتئینها برای فعالسازی GTpaseها، ورود کلسیم به درون سلول، سیگنالینگ Wnt، یا گیرندههای تیروزین کینازی مورد استفاده قرار گرفتهاست.
در مقایسه با دیمرایزرهای نوری که پیشتر معرفی شدند، این استراتژی اپتوژنتیکی تنها به یک ساختار واحد نیاز دارد. طبیعت مولکولی این رویکرد، آن را برای اعطای ویژگی حساسیت به نور در مولکولهای سیگنالینگ شبکه تنظیم ایمنی، مناسب میسازد.
- به دام انداختن برگشت پذیر نوری از طریق تنظیم آلوستریک
سومین استراتژی به ترکیب طراحی منطقی و بررسی بسیار دقیق نیازمند است. این طراحی اغلب شامل ادغام دامنههای عملگر با انتهای C دامنهی نور-اکسیژن-ولتاژ ۲ (LOV2) از طریق مارپیچ Jα و توالیهای ارتباط دهنده میباشد. در تاریکی، فعالیت یک دامنه عملگر بدلیل مانع استریک (steric hindrance) تحمیل شده توسط جسم هستهای LOV2، سرکوب میشود. حین تابش نور، تغییر ساختاری LOV2 باعث باز شدن پیچ و تاب مارپیج Jα، خارج شدن دامنه عملگر اتصال یافته از سرکوب و بازیابی عملکردی میگردد.
این سیستم نشانه گذاری میتواند برای اِعمال کنترل فضایی-زمانی دقیق بر فعالیت پروتئینهای sequester (مانند فاکتورهای رونویسی که تکامل و تمایز سلولهای ایمنی را کنترل میکنند) در نواحی دور از محل عمل آنها، مورد استفاده قرار گیرد. با این وجود بدلیل بروز خطاهای متعدد، هنوز با دست یابی به مطلوبترین سیستمهای به دام انداختن پروتئین فاصله داریم.
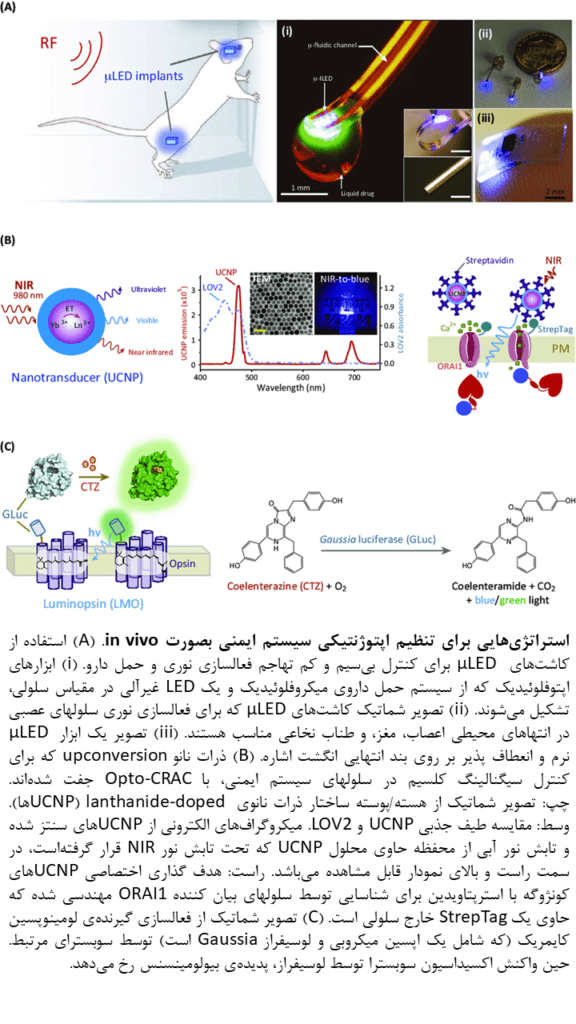
اپتوژنتیک بیسیم برای فراهم ساختن امکان تنظیم ایمنی In Vivo
برای عبور از مطالعات ex vivo (مطالعات صحت ایدهها) و ورود به مطالعات ایمونولوژیک in vivo، باید با این چالش روبرو شویم: چگونه میتوانیم بطور کارآمد و با تهاجم حداقل، نور را به سلولهای ایمنی که دائما در حال حرکت بوده و/یا در عمق بافتها فعالیت میکنند، حمل کنیم؟
بسیاری از ابزارهای اپتوژنتیکی کنونی، از طیف فعالیت در بازهی ۴۰۰ تا ۵۰۰ نانومتر و عمق نفوذ بسیار اندک (کمتر از ۱ میلیمتر) برخوردارند؛ بهمین دلیل، کارآیی بالینی آنها محدود است.
سیستمهای حمل نور کوچک که بر روی سر قرار میگیرند، و µLEDهایی با مقیاس کوچکتر از سلول که با فرکانسهای رادیویی کنترل میشوند، امکان انجام دستکاریهای اپتوژنتیکی بیسیم را در مطالعات سیستم عصبی مرکزی حیوانات آزاد بصورت in vivo، فراهم کردهاست. با این حال، این ابزارها محدود به مطالعات علوم اعصاب بوده و در مطالعات سیستم ایمنی، بدلیل حرکت بالا و توزیع گستردهی سلولهای ایمنی در سراسر بدن، نمیتوان از آنها بهره برد.
در ادامه، برخی از راه حلهای مطرح شده که میتوانند راه را برای جستجوی کاربردهای تنظیم ایمنی اپتوژنتیکی در پستانداران هموارتر سازند، معرفی خواهد شد.
- نانوذرات upconversion
نانوذرات upconversion (به اختصار: UCNPs) که lanthanide-doped هستند، قادر به تولید لومینسانس آنتی استوکس از طریق تبدیل نور نزدیک به فروسرخ (NIR) به تابشهایی با طول موج کمتر میباشند. در این نوع تابش پرتو در مقایسه با دیگر روشها، پراکندگی بافتی و سمیت نوری (phototoxicity) کاهش مییابد. همچنین در منطقه NIR، نفوذ بافتی عمیق و تحریک از راه دور امکان پذیر است.
فوتونهای ساطع شده در این استراتژی از انرژی کافی برای فعال کردن تقریبا همهی ساختارهای اپتوژنتیکی (از جمله LOV2، CRY2، و ChR2) که از کوفاکتورهای جذب کنندهی نور مرئی بهره میبرند، برخوردار است.
UCNPهای ساطع کنندهی NIR-به-نور آبی، در ترکیب با Opto-CRAC، بصورت موفقیت آمیزی برای تقویت پاسخ ضد توموری، سرکوب رشد تومور و سرکوب متاستاز در حیوانات زنده با منبع NIR خارجی، مورد استفاده قرار گرفتهاند.
هدف گیری اختصاصی سلولی میتواند از طریق ایجاد تغییرات آسان در سطوح UNCP با آنتی بادیها یا لیگاندهای مشخص، حاصل شود. این هدف گیری امکان اِعمال کنترل فضایی دقیق بر منبع نور را فراهم میآورد.
سیستمهای اپتوژنتیکی بر پایهی UCNP که توسط NIR تحریک میشوند، از سازگارترین سیستمها برای آزمایشهای انتقال سلول گیرنده یا ایمونوتراپیهای گیرنده، که بصورت گسترده در مطالعات پایه و مداخلات درمانی مورد استفاده قرار میگیرند، میباشند.
باور عمومی بر این است تطابق پذیری گسترده این رویکرد با ابزارهای نوری موجود میتواند فرصتهای جدیدی برای دستکاری فرآیندهای سلولی کنترل پذیر با نور، که حداقل تداخل را با فیزیولوژی میزبان ایجاد میکند، در تمامی حیوانات فراهم آورد.
- فعالسازی نوری با بیولومینسانس
بیولومینسانس ایجاد شده توسط واکنش آنزیمی میان لوسیفراز Gaussia (GLuc) و coelentrazine (سوبسترای توزیع پذیر GLuc)، روش کموژنتیکی جدیدی برای فعالسازی یا مهار نورونهای بیان کنندهی لومینوپسینها فراهم میکند. در این نورونها، GLuc به انتهای N یا C اپسینهای میکروبی متصل میشود.
با اینکه این رویکرد، سادهترین و غیر تهاجمیترین روش برای اپتوژنتیک in vivo است، آنالیزهای کمی شدت نور ایجاد شده توسط واکنش آنزیمی، چالش برانگیز بوده و کفایت آن برای فعالسازی دیگر پروتئینهای حساس به نور، هنوز مشخص نشدهاست. این رویکرد ترکیبی مانند دیگر تکنیکهای کموژنتیک که بر پایهی تزریق و توزیع زیستی متعاقب سوبسترای اگزوژن استوار هستند، از کنترل فضایی دقیق و برگشت پذیری سریع برخوردار نیست. فقدان این دو فاکتور، استفاده عملی از این روش در تنظیم سیستم ایمنی را غیر ممکن میسازد.
جمع بندی و چشم انداز آینده
ایمونوتراپی سرطان به جمع روشهای درمانی مرسوم (اعمال جراحی، رادیوتراپی، شیمی درمانی، و درمان هدفدار) پیوسته است و بعنوان پنجمین ستون درمان سرطان از آن یاد میشود.
بنظر میرسد در آینده نه چندان دور، مهندسی ایمنی با رویکردهای اپتوژنتیکی، یک روش غیر تهاجمی برای تنظیم دقیق عمق و وسعت پاسخ ضد توموری فراهم خواهد آورد و شخصی سازی بیشتر روشهای درمانی را ممکن خواهد ساخت.
در دسترس بودن ابزارهای حساس به نور متعدد باعث بوجود آمدن فرصتهای هیجان انگیز بیشتری برای بکارگیری حساسیت به نور در شبکه سیگنالینگ ایمنی، اِعمال کنترل نوری بر درمانهای مهار نقاط وارسی ایمنی و اعطای عملکردهای نوین به سلولهای ایمنی شدهاست.
یکی از موانع اساسی بر سر راه استفاده از ابزارهای اپتوژنتیکی در سیستم ایمنی، کارآیی اندک این ابزارها بهنگام تحریک نوری در داخل بافتهای بیولوژیک است. گسترش حساسیت به نور به طیف NIR میتواند چند سانتیمتر بر عمق نفوذ پرتوها در بافتها افزوده و امکان بهره گیری از اپتوژنتیک بیسیم را در پستانداران زنده، فراهم آورد. بهمین دلیل، یکی از سادهترین راه حلها برای فراهم کردن امکان تنظیم ایمنی in vivo بصورت از راه دور، ترکیب جعبه ابزار موجود با مبدلهای نانو مانند UNCPها است که توسط NIR تحریک میشوند. همچنین میتوان عناصر پاسخ دهنده به NIR را که بصورت ژنتیکی کدگذاری شده و در شبکه سیگنالینگ ایمنی دخالت دارند، طراحی کرد.
تمامی این تلاشها، یک زمینهی قابل اعتماد برای مطالعات آینده و ایجاد سیستمهای زیست سازگار اپتوژنتیکی فراهم میآورد.
