پیرو مطالب پیشین، در این بخش به بررسی مطالب مرتبط با اپتوژنتیک قلبی میپردازیم.
اپتوژنتیک یک واژهی جدید است که برای اولین بار در سال ۲۰۰۶ بمنظور معرفی یک رویکرد زیست-پزشکی که در آن سلولهای تحریک پذیر با بیان اپسینهای میکروبی مخصوص، امکان دستکاری نوری پتاسنیل خلال غشایی را فراهم میکنند، معرفی شد. نام گذاری این تکنولوژی پس از موفقیتهای سریعی که از سال ۲۰۰۲ تا ۲۰۰۶ با کلون کردن ChR1 و ChR2 کسب شد، انجام گردید.
بیشتر بخوانید: https://virtualdr.ir/2018/09/14/%d8%aa%d8%a7%d8%b1%db%8c%d8%ae%da%86%d9%87-%d8%a7%d9%be%d8%aa%d9%88%da%98%d9%86%d8%aa%db%8c%da%a9/
تا سال ۲۰۱۰، استفاده از اپتوژنتیک بمنظور فراهم کردن امکان کنترل انتخابی جمعیتهای سلولی خاص، در علوم اعصاب گسترش یافت. بصورت همزمان، محققانی چون Bruegmann (مطالعه امکان استفاده از نور برای ایجاد ضربان در قلب موشهای ترانس ژنتیک بصورت in vivo) و Arrenberg (مطالعه تنظیم فعالیت ضربانسازی قلب گورخر ماهی با بهره گیری از تحریک نوری)، اولین مطالعات قلب مبتنی بر اپتوژنتیک را در نشریههای علمی منتشر ساختند. همچنین مدتی بعد دانشمندانی چون Jia (ایجاد تک لایههای متشکل از کاردیومیوسیتهای حساس به نور برای انجام مطالعات الکتروفیزیولوژی in vitro) و Abilez (ایجاد سلولهای شبه کاردیومیوسیت از سلولهای بنیادی رویانی انسان که با وکتورهای لنتی ویروسی، حساس به نور شده بودند) از کاربردهای بیشتر اپتوژنتیک در مطالعات قلب، پرده برداشتند.
این پیشرفتها نهایتا به توسعهی یک چارچوب جامع برای انجام تحریک اپتوژنتیکی در مدلهای محاسبهای چند مقیاسی قلب انسان منجر شد. این مدلها، یک ساختار پایهی غنی برای بررسی طیف وسیعی از کاربردها و شناسایی محدودیتهای بالقوه اپتوژنتیک در مطالعه فیزیولوژی و حتی درمان اختلالات قلبی، فراهم میآورد.
در بطن تمامی این مطالعات تنها یک مفهوم نهفته بوده و هست: اپتوژنتیک قلبی.
در سال ۲۰۱۳، Entcheva در مقاله مروری خود، ۶ ویژگی متمایز کننده اپتوژنتیک را برای استفاده در مطالعات الکتروفیزیولوژی این چنین بیان کرد: سادگی بیان اپسین، کمترین تداخل با عملکرد درونزاد کاردیومیوسیتها، امکان پذیری هدف گیری انواع خاص سلولی بمنظور بیان انتخابی، دقت فضایی و زمانی بالای دستکاری، تنوع عملکرد اپسین (فراهم بودن امکان تنظیم تحریکی یا مهاری)، و نیاز به انرژی نسبتا اندک.
پیشرفتهای متدولوژیک
- انواع اپسینهای جدید
یکی از گستردهترین شاخههای مطالعاتی در اپتوژنتیک، تنظیم و دستکاری ChR2 برای دست یابی به انواع جدیدتر این پروتئین با کاربردهای اپتوژنتیکی بیشتر است. یکی از اولین مطالعات، تولید ChR2-H134R بود که نسبت به ChR2 دست نخورده از هدایت پذیری بیشتر برخوردار است. اخیرا محققان با دستکاری ChR2، به CatCh دست یافتهاند که از نفوذ پذیری بیشتر به کلسیم و حساسیت بالاتر به نور برخوردار است. همچنین انواعی از ChR2 با بیان و جریان نوری بیشتر (ChR2-XXL) و طیف جذبی red-shifted برای تسهیل افزایش عمق نفوذ در بافتهای زیستی (ReaChR) توسعه یافتهاند.
تمامی این مولکولها به حیطه اپتوژنتیک قلبی ارتباط دارند و بمنظور مرتفع ساختن نیاز به اپسینها برای ایجاد تحریک در دیواره میوکاردی که باعث پراکنده شدن فوتونها میشود، مورد استفاده قرار میگیرند.
در کنار ابزارهایی مانند ChR2 که ایجاد تحریک را تسهیل میکنند، دستهی جداگانهای از اپسینها وجود دارند که میتوانند برای سرکوب پتانسیل عمل، مورد استفاده قرار گیرند. بعنوان نمونه، پمپهای یونی حساس به نور که از باستانیان (archaea) استخراج شدهاند، بمنظور سرکوب فعالیت خودبخودی در قلب گورخر ماهی و کوتاهتر ساختن پتانسیل عمل در مطالعات in vitro، مورد استفاده قرار گرفتهاند. اخیرا محققان نشان دادهاند پرتوهای نور باعث سرکوب تپش در تک لایههای کاردیومیوسیتی میشود که GtACR1/2 (پمپهای یونی منتقل کننده یون کلر) بیان میکنند. با این اوصاف بنظر میرسد اِعمال سرکوب در قلب حیوانات با GtACR، بدلیل نیاز به پرتوی نور با شدت کمتر، آسانتر است.
- حساس سازی بافت قلبی به نور
یکی از مهمترین جنبههای مطالعات اپتوژنتیک قلبی، واسطههایی هستند که ویژگی حساسیت به نور را به سلولهای قلبی اعطا میکنند. پیشرفتهای اخیر در این حیطه نشان میدهد با اتخاذ رویکردهای مناسب میتوان بیان قوی ChR2 و دیگر اپسینها را در سلولهای قلبی، انجام داد. بیان ChR2 با وکتور ویروسی AAV و پروموتر β- اکتین مرغ، میتواند یکی از رویکردها باشد که حساسیت به نور را در مدت بیش از یک سال، در سلولهای قلبی حفظ میکند. این رویکرد از کمترین بیان در دیگر سلولهای بدن (مانند سلولهای عضله اسکلتی) برخوردار است و امیدها را برای بهره گیری از اپتوژنتیک قلبی در مطالعات قلب انسان بصورت in vivo، زنده نگه میدارد.
اخیرا دانشمندان، کارآیی نسبی سروتایپهای مختلف AAV را برای بیان ChR2 در تک لایههای کاردیومیوسیتی القا شده از سلولهای بنیادی انسانی مورد مطالعه قرار دادهاند. نتایج این مطالعات نشان میدهد وکتورهای AAV1 و AAV6 نسبت به AAV9، عملکرد بهتری در بیان ترانس ژن و سهولت تحریک با محرک اپتوژنتیکی دارند. این نتیجه بسیار مهم است، زیرا پیش از این باور بر این بود AAV9 نسبت به دیگر سروتایپها در ترانسفکشن in vivo، بهینهتر عمل میکند.
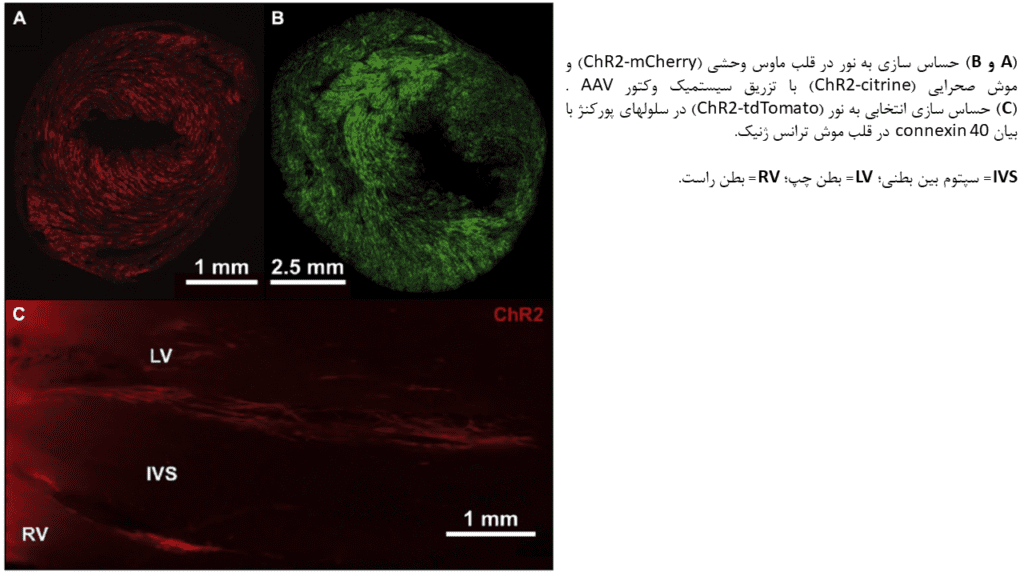
اخیرا محققان در تعدادی از مطالعات اپتوژنتیک قلبی در مدلهای حیوانی از recombination Cre-Lox برای تولید موشهای ترانس ژنیک که ChR2 را تنها در جمعیتهای سلولی هدف، بیان میکنند، بهره جستهاند. برای مثال، دانشمندان با اتخاذ این رویکرد در یک مطالعه، به بررسی امکان بیان ChR2 در سلولهای قلبی (با پروموتر زنجیره سنگین α- میوزین) و بیانِ تحت هدایتِ connexin 40 که به حساس سازی اختصاصی کاردیومیوسیتهای دهلیزی و فیبرهای پورکنژ منجر میشود، پرداختهاند.
در یکی از مطالعات، Wang و همکارانش سلولهای قلبی خاصی را که بیان ژن فنیل اتانول آمین N- متیل ترنسفراز (Pnmt) در آنها صورت میگیرد، بصورت انتخابی نسبت به نور حساس ساختند. این رویکرد باعث تسهیل توسعه تکنیکی بنام تشریح عملکردی گردیدهاست. در تشریح عملکردی، از ابزارهای اپتوژنتیکی برای شناسایی زیرگروههای سلولهای قلبی با ساختار ژنتیکی مشخص استفاده میشود. برای نمونه در این مطالعه مشخص شد که سلولهای بیان کننده Pnmt برخلاف دودمان سلولی نورواندوکرینی، بعنوان میوسیت در قلب فعالیت میکنند.
در مطالعهای دیگر، Hulsmans و همکارانش، بیان ChR2 را در ماکروفاژهای ساکن گره دهلیزی-بطنی که با connexin 43 به کاردیومیوسیتها متصل هستند، القا کردند؛ تحریک نوری این ماکروفاژها باعث بهبود هدایت دهلیزی-بطنی گردید. این نتیجه، فرضیهی “مشارکت ماکروفاژهای گره دهلیزی-بطنی در تسهیل هدایت الکتریکی طبیعی در قلب” را تایید میکند.
همچنین چندی پیش محققان دریافتند افزودن یک یا دو میکرومول رتینال all-trans برونزاد به بافت مورد مطالعه باعث افزایش قابل توجه پاسخ به نور در تک لایههای کاردیومیوسیتی میگردد. این افزایش حساسیت به نور باعث کاهش نزدیک به ۳۰ برابری انرژی مورد نیاز برای تحریک نوری میگردد. این مطالعه با وجود محدودیتهای بسیار در افزودن رتینال all-trans، از جمله طولانی شدن زمان پتانسیل عمل و سمیت در دوزهای بالاتر، نشان میدهد نیازهای انرژی را میتوان با افزایش نسبی مقدار رتینال all-trans در بافت، به طور قابل توجهی کاهش داد.
در نهایت، با وجود اینکه تلاش قابل توجهی با هدف حساس سازی بافت قلبی انسان به نور صورت نگرفته است، مطالعات در زمینههای دیگر باعث فراهم آمدن دید کلی در رابطه با ملاحظات عملی در کاربردهای اپتوژنتیک قلبی، از جمله روشهای انتقال ژن، کارآیی ترانسفکشن و مسائل ایمنی، شدهاست. نکته قابل توجه اینکه در مطالعات اپتوژنتیک قلبی، انتقال ژن بمنظور درمان نارسایی قلبی باعث بروز واکنشهای ایمنی نشده است ولی کارآیی طولانی مدت این درمانها محدود بودهاست.
- انتقال و تابش نور در اپتوژنتیک
یکی دیگر از موضوعات قابل توجه در اپتوژنتیک قلبی، انتقال نور به قلب بمنظور ایجاد پاسخ مورد نظر است. مسئله اصلی در این رابطه، نفوذ ضعیف نور مرئی در بافت قلبی است (البته میزان نفوذ نور در بافت به طول موج نور بستگی دارد). بمنظور برطرف ساختن این مورد، محققان دستگاههای اپتوالکترونیکی بسیار نازک قابل تزریق و غشاهای زیستسازگار منعطف با منابع نوری ادغام شده را تولید کردهاند. اخیرا مطالعات دانشمندان، بر دور زدن نیاز به تابش مستقیم نور مرئی بر اپسینها بمنظور جلوگیری از ضعیفتر شدن نور، متمرکز بودهاست. بعنوان نمونه، دانشمندان استراتژیهای X-optogenetics و U-optogenetics را معرفی کردهاند. در این استراتژیها، بیان اپسینها در بافت بهمراه عوامل نانوفسفر یا سونولومینسنت تحریک پذیر با پرتوی X صورت میگیرد. سپس با دریافت پرتوی X یا امواج فراصوت، آزادسازی فوتون در مجاورت کانالهای حساس به نور، آغاز میشود. همچنین گروهی از محققان، استفاده از نانوذرات up-conveting را که باعث تبدیل پرتوی نزدیک فروسرخ به نور مرئی میشوند، پیشنهاد دادهاند. هر ۳ روش معرفی شده، ایدهی مرکزی یکسانی دارند. این ایده، بهره گیری از پرتوهایی با قدرت نفوذ بیشتر از نور مرئی را شامل میشود که باعث غلبه بر محدودیتهای اعمال شده از طرف حساسیت طیفی اپسینها میگردد. این رویکردها هنوز بطور کامل در ساختارهای قلبی بررسی نشدهاند، ولی در آیندهی نه چندان دور میتوانند بعنوان عوامل مهمی در بهره گیری از رویکرد اپتوژنتیکی در مطالعات قلبی، مشارکت کنند.
- مدلسازی محاسباتی
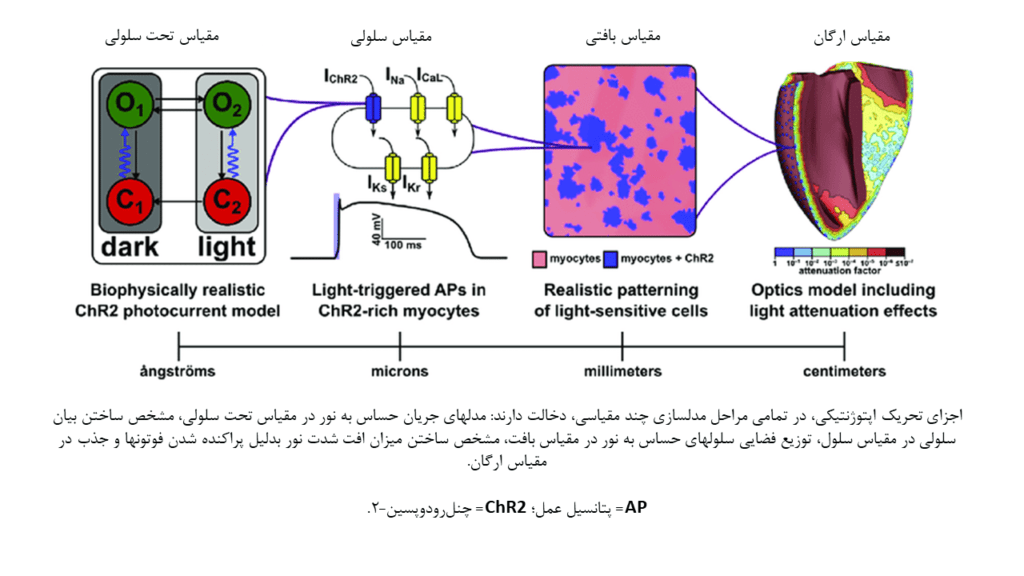
اپتوژنتیک قلبی از توسعه ابزارهای ادغام تصاویر واقع گرایانهی اجزای سیستم قلبی در مدلهای محاسباتی چند منظوره، بیشترین بهره را برده است. شبیه سازیهای انجام شده در این مدلها، در سرعت بخشیدن به ارزیابی نتایج حاصل از اتخاذ رویکردهای اپتوژنتیکی در مدلهای حیوانی و مدلهای قلب انسان، نقش قابل توجهی داشته است.
بطور خلاصه، این فرآیند شامل مدلسازی کینتیک چرخهی نوری اپسین در مقیاس پروتئین (با معادلات دیفرانسیل معمول که توسط مطالعات تایید شدهاند)، شبیه سازی روشهای مختلف حساس سازی به نور در مقیاس سلول (رویکرد انتقال مستقیم ژن در مقایسه با رویکرد tandem cell unit) ، مشخص ساختن نحوه توزیع سلولهای حساس به نور در مقیاس بافت، و محاسبهی میزان افت شدت نور بدلیل پراکنده شدن فوتونها و جذب نور در مقیاس ارگان، میباشد.
کاربردهای in vitro
روشها و مطالعات مختلف برای مشخص ساختن ویژگیهای الکتروفیزیولوژیک
یکی از جذابترین ویژگیهای اپتوژنتیک قلبی، امکان استفاده از ابزارهای نوری برای اندازه گیری سریع و کمی ویژگیهای الکتروفیزیولوژی تک لایههای کاردیومیوسیتی تحت شرایط متنوع است. این رویکردها برای پایش کاملا اتوماتیک و بدون تماس، بسیار مناسب هستند. با توجه به این موارد، این تکنولوژی میتواند در مطالعات کاردیوتوکسیسیتی (سمیت قلبی) داروها کارگشا باشد.
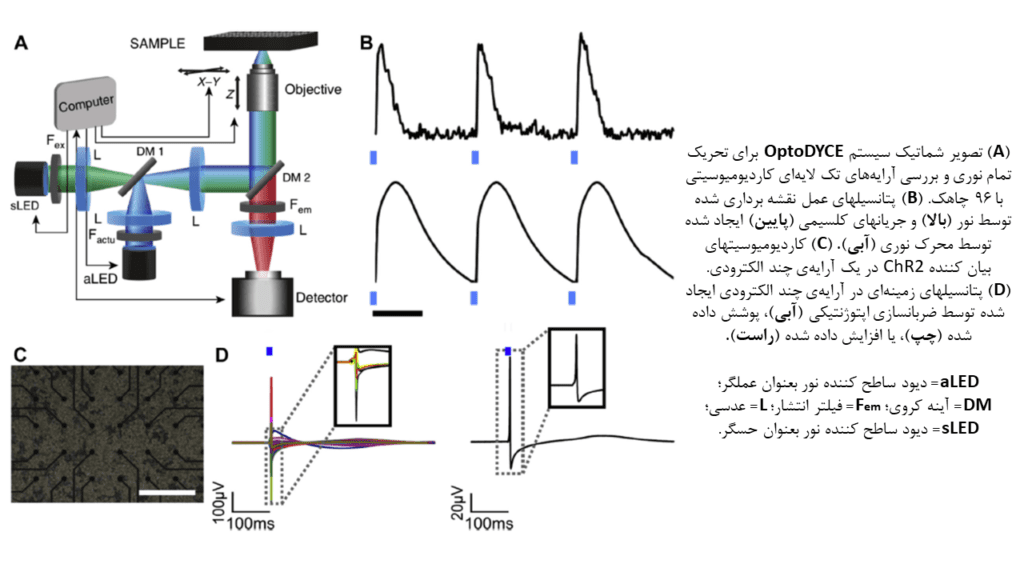
یکی از این رویکردها که قالب عملکردی مطالعات نوری الکتروفیزیولوژی قلبی است، OptoDyCE میباشد. OptoDyCE توسط Klimas و همکارانش توسعه یافتهاست. این سیستم، کاردیومیوسیتهای کشت شده در ۹۶ چاهک را شامل میشود که تک لایههایی را تشکیل میدهند. این تک لایهها با انتقال ژن یا انتقال سلولی ChR2، به نور حساس میشوند. همچنین در این تک لایهها از رنگهای حساس به ولتاژ و کلسیم بمنظور فراهم کردن امکان پیگیری نوری پاسخ به محرک، استفاده میشود. در این رویکرد، دادههای بیش از ۶۰۰ نمونه در هر ساعت، جمع آوری و پایش میشود. دانشمندان از این رویکرد در مطالعات متعددی برای محاسبه کمی افزایش مدت پتانسیل عمل (APD) و مدت انتقال کلسیم، که معیاری تقریبی برای سمیت قلبی هستند، بهره جستهاند.
Optopatch، رویکرد دیگری است که از یک ChR2 با کینتیک غشایی سریعتر (CheRiff) بعنوان عملگر و یک حسگر ولتاژ و کلسیم (CaViar) با قابلیت کدگذاری ژنتیکی، برای شناسایی اثرات حاد و مزمن داروها بر روی APD و مدت انتقال کلسیم، بهره میبرد. Dempsey و همکارانش، این روش را ابداع کردهاند.
اخیرا، Lapp و همکارانش، روش دیگری برای ارزیابی اثرات داروهای آنتی آریتمیک معرفی کردهاند. محققان در این روش پتانسیلهای زمینهای ثبت شده در تک لایههای کاردیومیوسیتی مشتق از سلولهای بنیادی پرتوان القایی انسانی را که به نور حساس شدهبودند، مورد بررسی قرار میدهند. برخلاف روشهای تمام نوری که به فرکانسهای کمتر از ۱ هرتز محدود هستند، سیگنالهای پتانسیل نوری میتوانند در شرایط بیش از ۱۰ فرکانس نیز ثبت شوند. این ویژگی باعث میشود رویکرد ثبت پتانسیلهای زمینهای به گزینه مناسبی برای توصیف تغییرات ایجاد شده در سرعت تولید پتانسیل عمل توسط داروها (مانند بلوکه شدن کانالهای سدیمی) مبدل شود.
مطالعه ویژگیهای مکانیکی آریتمی
یکی دیگر از کاربردهای مهم اپتوژنتیک، دستکاری الکتروفیزیولوژیک عملکردهای قلبی است. این کاربرد برخلاف محرکهای مرسوم که انتقال غیر اختصاصی جریانهای الکتریکی به فضای خارج سلولی را رقم میزنند، از توانایی محرک اپتوژنتیکی برای القای جریانهای خلال غشایی پایدار در بافت حساس به نور بهره میبرد. متعاقبا، ابزارهای اپتوژنتیکی میتوانند برای دستکاری فضایی-زمانی بافت تحریک پذیر بصورت دلخواه، با ایجاد شرایط پروآریتمیک، مورد استفاده قرار گیرند. بعنوان نمونه دانشمندان دریافتهاند با تابش الگویی نور بر تک لایههای کاردیومیوسیتی که ChR2 بیان میکنند، میتوان هدایت جریان را بصورت یک طرفه متوقف ساخت و سرعت هدایت آن را تغییر داد. همچنین میتوان با تابش نور با الگوی چرخان، جریانهای در حال گردش ایجاد کرد.
تحریک اپتوژنتیکی طولانی مدت مناطق مشخص سلولی، میتواند برای تحریک ناپذیر ساختن ناحیهای از بافت بصورت موقتی، مورد استفاده قرار گیرد. در نتیجه بدلیل اینکه امکان انتقال رو به جلوی جریان در این نواحی فراهم نیست، با تابش نور میتوان “ضایعات تخریبی” موقتی در بافت ایجاد کرد که به محض قطع تابش نور، به شرایط اولیه خود باز میگردند. در یکی از این مطالعات، Feola و همکارانش بمنظور مطالعه اثرات “ضایعات تخریبی” ایجاد شده توسط نور بر ویژگیهای دینامیکی آریتمی، تک لایههای کاردیومیوسیتی دهلیزی با بیان CatCh ایجاد کردند. نتایج این مطالعه نشان میدهد اِعمال محرک نوری بر مسیر میان کانون آریتمی و یکی از انتهاهای تک لایه، به طور موفقیت آمیزی باعث خاتمهی پدیدهی “ورود مجدد” (re-entry)، که اساس پیدایش آریتمی است، میگردد. در حالیکه تابش نور تنها بر کانون آریتمی، آریتمی را پایان نمیدهد. در مطالعه دیگری نیز از صفحات سلولی با بیان CatCh برای القای اپتوژنتیکی پدیدهی ورود مجدد استفاده شدهاست. در نهایت، اپتوژنتیک میتواند برای ایجاد جریانهای خلال غشایی تحریکی در زیرگروههای مشخص سلولی مورد استفاده قرار گیرد. بعنوان نمونه، Zaglia و همکارانش از موشهای ترانس ژنیک با بیان اختصاصی ChR2 در سلولهای پورکنژ و کاردیومیوسیتها با هدف مشخص ساختن میزان تابش نور آستانه بمنظور تحریک انتخابی این سلولها، استفاده کردند. در واقع محققان با انجام این مطالعه قصد داشتند میزان انرژی نوری مورد نیاز را برای آغاز موج اکتوپیک پیش رونده، مشخص سازند. نتایج حاصل نشان میدهد انرژی مورد نیاز برای آغاز جریان خارج سیستولی در بطن چپ به میزان ۲ تا ۳.۵ برابر انرژی مورد نیاز در بطن راست و ۸ تا ۲۰ برابر انرژی مورد نیاز در سیستم پورکنژ میباشد.
کاربردهای بالقوهی بالینی
تکنولوژی اپتوژنتیک از تواناییهای بالقوه بعنوان جایگزینی جدید برای تحریک الکتریکی مرسوم در ابزارهای درمانی، مانند ضربانسازهای قابل کاشت و دفیبریلاتورها، برخوردار است. در این بخش، به بررسی تعدادی از مطالعات که باعث نزدیکتر شدن این رویکرد به کاربردهای بالینی شدهاست، میپردازیم.
ضربانسازی:
تلاشهای اولیه در این زمینه، امکان غلبه بر فرکانس ضربان درونی یک قلب تپنده را با استفاده از محرک نوری، به چالش میکشید. بعنوان نمونه، Bruegmann و همکارانش در مدلهای پیش بالینی موشهای ترانس ژنیک با بیان ChR2 به دنبال یافتن پاسخی برای این پرسش بودند. مطالعه آنها نشان داد در قفسه سینه با وضعیت باز، پرتوهای نوری خارج شده از یک منبع میتوانند برای افزایش فعالیت بطنی با فرکانسی بیشتر از ریتم سینوسی طبیعی، مورد استفاده قرار گیرند. در این مطالعه، جریانهای الکتریکی القا شده توسط نور، از نقاط مختلف قلب (مانند نواحی دهلیزی یا بطنی) آغاز میشدند. محققان در این مطالعه دریافتند با متمرکز ساختن نور به یک منطقه بسیار کوچک ( ناحیهای با وسعت نزدیک به ۰.۰۵ میلیمتر مربع) میتوان ریتم سینوسی قلب را دوباره ایجاد کرد که نشان از قدرت بالای ضربانسازی اپتوژنتیکی است. مطالعات in vitro و in vivo بیشتر در این رابطه نشان داد ضربانسازی اپتوژنتیکی در چند ناحیه قلب بصورت همزمان، امکان پذیر است.
با وجود تمامی این پیشرفتها، اشتیاق اندکی برای توسعهی ابزارهای ضربانساز نوری و جایگزین ساختن آنها با ضربانسازهای مرسوم وجود دارد؛ زیرا مطابق باور بسیاری از متخصصان، ضربانسازهای مرسوم ایمنی، کارآیی و اطمینان بالایی داشته و بهمین ترتیب، بعنوان اولین گزینه درمان در بسیاری از آریتمیها، مطرح هستند. در کنار کارآیی بالای ضربانسازهای مرسوم، این ابزارها محدودیتهایی نیز دارند که با بهره گیری از اپتوژنتیک میتوان آنها را برطرف ساخت. برای نمونه، ضربانسازی مستقیم دسته هیس (HB) نسبت به ضربانسازی مرسوم بطن راست از برتریهای قابل توجهی برخوردار است؛ ولی این تکنیک بدلیل نیاز به آستانههای ضربانسازی بالا و دشواری مشخص ساختن دسته هیس، در نزدیک به ۲۰ درصد بیماران قابل استفاده نیست. مطالعات محاسبهای و تجربی اخیر نشان میدهد ضربانسازی اپتوژنتیکی، توانایی لازم را برای برطرف ساختن این دو مشکل دارد؛ بطوریکه در رویکرد اپتوژنتیکی میتوان سلولهای دسته هیس را بصورت اختصاصی و با نیازهای انرژی نسبت اندک، تحریک کرد.
دفیبریلاسیون:
ایدهی بهره گیری از نور برای دفیبریله کردن قلب همانند ضربانسازی اپتوژنتیکی، بسیار جذاب است. تحریک قلب توسط نور در مقایسه با شوکهای الکتریکی با انرژی بالا، میتواند آریتمی را با انرژی مورد نیاز کمتری از بین ببرد. همچنین در دفیبریلاسیون اپتوژنتیکی بدلیل هدف گیری اختصاصی سلولهای قلبی، تحریک جانبی در عضلات اطراف قلب صورت نمیگیرد و احساس درد و ناراحتی در بیمار ایجاد نمیشود.
اولین ایدهی دفیبریلاسیون اپتوژنتیکی، توسط Bruegmann و همکارانش مطرح شده و مورد بررسی قرار گرفت. مطالعه آنها نشان داد تابش اپیکاردی نور آبی میتواند به دورههای تاکیکاردی بطنی (VT) مداوم در قلب موشهای Langendorff-perfused، خاتمه بخشد. نکته قابل توجه اینکه در حیواناتی که بیش از ۱۲ ماه از انتقال وکتورهای ویروسی به آنها میگذرد، تابش نور همچنان باعث خاتمهی دورههای تاکیکاردی میگردد. در مطالعهی دیگری، محققان مدل محاسبهای مخصوصِ بیمارِ VT پس از انفارکتوس میوکاردی را برای تشریح مکانیسمها و ارزیابی امکان استفاده بالینی از دفیبریلاسیون اپتوژنتیکی، مورد مطالعه قرار دادند. بررسیهای محاسباتی نشان داد مکانیسم پایهی ختم VT با واسطهی نور، دپلاریزاسیون ایجاد شده با واسطهی ChR2 در میوکارد است. محققان در این مطالعه نشان دادند تنها در صورتی تحریک نوری میتواند برای خاتمه بخشیدن به VT در قلب انسان نیز مورد استفاده قرار گیرد که اقدامات لازم برای غلبه بر کاهش قابل توجه پرتوهای نور در دیوارههای بطنی قلب انسان، که در مقایسه با قلب موش از ضخامت بسیار بیشتری برخوردار هستند، اتخاذ شود. همچنین نتایج این مطالعه و مطالعات محاسباتی پیشین، استفاده از ChR2 حساس به نور قرمز را بجای ChR2 استاندارد (حساس به نور آبی)، پیشنهاد میدهند؛ زیرا ختم فیبریلاسیون بطنی در قلب انسان با واسطهی اپتوژنتیک، نیازمند پرتوهای نور با قدرت نفوذ عمیقتر بوده و نور قرمز در مقایسه با نور آبی، از این ویژگی برخوردار است.
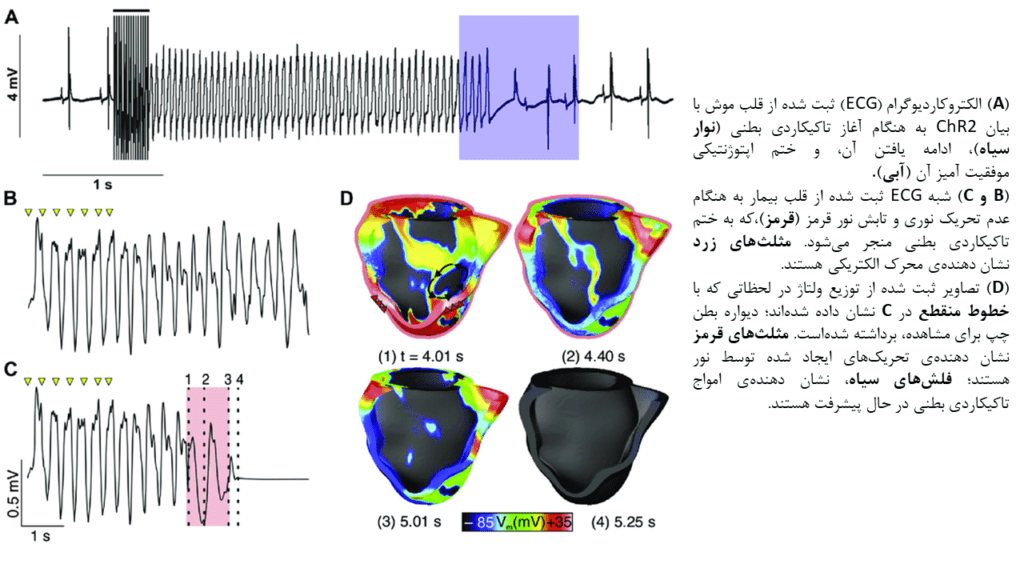
اخیرا گروه مطالعاتی Nyns و همکارانش، دفیبریلاسیون اپتوژنتیکی را در قلب موشهایی که سلولهای آنها ReaChR را بیان کرده و با di-4-ANBDQBS رنگ آمیزی شده بودند، مورد بررسی قرار دادهاست. در این مطالعه مشابه مطالعات پیشین، تابش اپیکاردی نور آبی به طرز کارآمدی باعث پایان دورههای VT میشد. نقشه برداری نوری از نواحی بافتی دیستال به ناحیهی تحریک شده با نور، نشان میدهد افزایش مدت زمان آخرین پتانسیل عمل پیش از خاتمهی VT، مکانیسم دخیل در دفیبریلاسیون این مدل است. نکته شایان ذکر اینکه نتایج این مطالعه، هیچ تداخلی میان جریانهای ثبت شده از ReaChR و سیگنالهای ثبت شده از رنگ مورد استفاده در این آزمایش، نشان نمیدهند؛ این مورد بیانگر آن است که برخلاف باور قبلی، میتوان بصورت همزمان از نقشه برداری نوری و تحریک اپتوژنتیکی در مطالعات استفاده کرد.
در نهایت یکی از هیجان انگیزترین تواناییهای اپتوژنتیک قلبی در حیطه کاربردهای بالینی، امکان استفاده از تابش الگویی نور برای ایجاد توالیهای دپلاریزاسیونی مخصوص است که باعث به حداکثر رساندن احتمال ختم آریتمی میشوند. Crocini و همکارانش با تابش نور در ۳ ناحیه استوانهای شکل در سطح اپیکاردی قلب، امکان ختم VT را در قلب موشهای ترانس ژنیک با بیان ChR2، مورد مطالعه قرار دادهاند. کاهش میزان انرژی منتقل شده به قلب، توجیه این استراتژی است که تحت عنوان “triple-barrier” نیز شناخته میشود. در این مطالعه، میزان موفقیت قویترین (۴۰ mW/mm2) و طولانیترین پالسهای نور، ۱۰۰ درصد بود. نتایج این مطالعه بیان میدارد در صورتیکه اطلاعات کافی از مورفولوژی مدار جریانهای ورود مجدد در دسترس باشد، تابش نور بصورت محدود به مناطق مشخص میتواند برای بهینهتر کردن ختم آریتمی، مورد استفاده قرار گیرد.
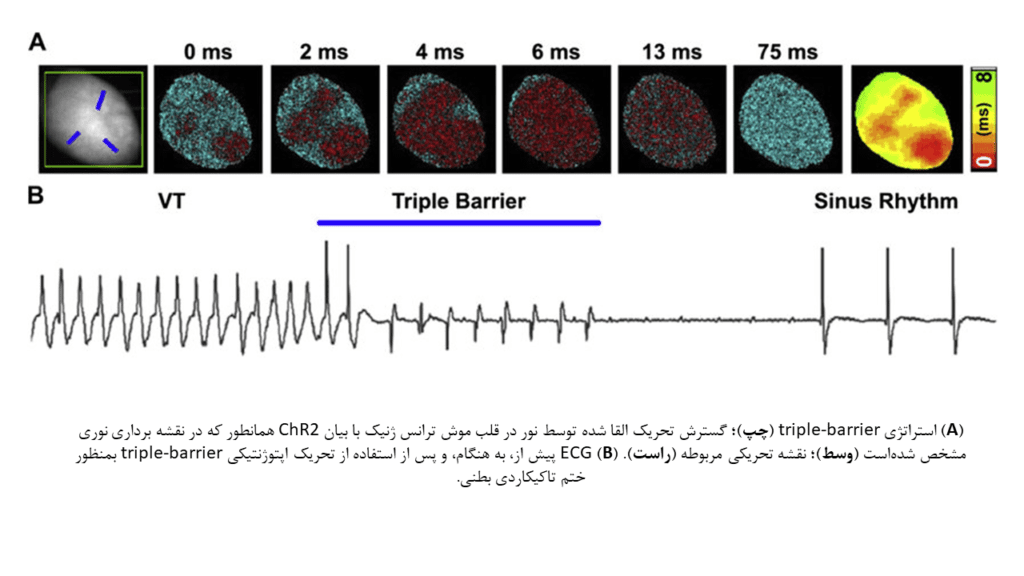
دستکاری و تنظیم ویژگیهای الکتروفیزیولوژیک:
برخلاف استراتژیهای ضربانسازی و دفیبریلاسیون که پیشتر مطرح شد، برخی از کاربردهای بالقوه اپتوژنتیک در حیطه بالینی، مبهم بوده و امکان استفاده قابل توجهی در مسائل مرتبط با الکتروفیزیولوژی ندارند. یکی از این کاربردها، امکان استفاده از محرک نوری با دامنه کوتاه و طول موج طولانی برای دستکاری دینامیک اؘشکال پتانسیلهای عمل قلبی است. در این رابطه میدانیم بسیاری از شرایط آریتموژنیک کشنده، از کوتاه شدن مدت زمان پتانسیل عمل بصورت پاتولوژیک ناشی میشوند؛ ولی درمانهای داروییِ اندکی، قادر به بر طرف ساختن این مشکل بدون اثرات جانبی قابل توجه در خارج از قلب هستند. Karathanos و همکارانش با مطالعه یک مدل محاسباتی از کاردیومیوسیتهای دهلیزی که در شرایط سندرم QT کوتاه قرار داشتند، نشان دادند کوتاه شدن پتانسیل عمل که از جهش کانال پتاسیمی ناشی میشود، میتواند با اِعمال پرتوهای نوری بصورت کامل برطرف شود. با این حال، زمانیکه رویکرد اپتوژنتیکی را با رویکرد دارویی مقایسه میکنیم، بدلیل کاهش شدت پرتوهای نور در داخل بدن، میزان کارآیی رویکرد اپتوژنتیکی بطرز قابل توجهی کاهش مییابد. با در نظر گرفتن تمامی جوانب، پیشرفت ابزارهای اپتوژنتیکی و فراهم شدن سیستمهایی که توانایی غلبه بر محدودیتهای داخلی را دارند، محققان و دانشمندان را به بازبینی این کاربردها، وادار خواهد ساخت.
جمع بندی
پس از اینکه در سال ۲۰۱۰ گامهای ابتدایی در حیطه اپتوژنتیک قلبی برداشته شد، این حیطه بصورت پیوسته در حال رشد بودهاست. پیشرفتهای متدولوژیک و مدلسازیهای محاسباتی، کاربردهای نوآورانه و خلاقانهی اپتوژنتیک قلبی را بصورت قابل توجهی افزایش داده و مسیر را برای نزدیکتر ساختن این رویکرد به حیطهی بالینی، هموارتر ساخته است. تمامی محققان و دانشمندان بر این باورند اپتوژنتیک، افقهای دید تازهای در مطالعات قلبی پایه و بالینی فراهم خواهد آورد.
