Pan در صورتیکه پیشوند واقع شود، به منظور اشاره به مرتبط بودن کلمه مابعد آن با دستهای از اعضا با خصوصیات مشابه استفاده میشود. Pan-PCR نیز به تکنیکهایی از PCR اطلاق میشود که تنها دستهای از توالیهای highly informative را که با خصوصیات مشخصی از جاندار ارتباط دارند، بررسی میکنند. این اهداف، میتوانند توالیهایی باشند که قادر به تمییز سویههای مختلف از یک باکتری بوده و یا میتوانند توالیهایی باشند که در بین تعدادی از گونههای قارچی و … مشترک هستند. مورد اول، Pan-PCR باکتریایی و مورد دوم Pan-PCR قارچی نام دارد که از موارد مشهور آن، Pan-AC میباشد. انواع دیگری از pan-PCR برای تشخیص ارگانیسمهای دیگر، به عنوان مثال ویروسها نیز وجود دارند، اما در این مقاله تنها به بررسی دو متد گفتهشده خواهیم پرداخت.
مقالات مرتبط:
- معرفی تکنیک Ligation-mediated PCR
- معرفی تکنیک Methylation-specific PCR
- هر آنچه باید در مورد PCR بدانید!
- پرایمرها در PCR
Pan-PCR باکتریایی
با افزایش روزافزون میزان مقاومت دارویی، درمان عفونتهای باکتری دشوارتر شده است و این موضوع اهمیت بررسی این پاتوژنها (surveillance) و پیشگیری از بروز عفونتها را برجستهتر میکند. بررسی موثرتر پاتوژنها وابسته به قابلیت دسترسی آسان به متدهایی سریع و مقرون به صرفه برای تایپینگ نمونههای باکتریایی است. متدهایی که بر پایه PCR هستند، سریع و ارزانقیمت بوده، ولی کاربرد آنها در اثر نبود توالیهای هدفی که بتوانند بین سویههای موجود در یک گونه تمایز قائل بشوند، محدود میگردد. Pan-PCR برای شناسایی اهداف PCR حاوی اطلاعات پراهمیت از بین شمار روزافزون توالیهای ژنومی شناختهشده از باکتری ها توسعه یافته است و میتواند چنین کاری را به انجام برساند.
این الگوریتم کامپیوتری از توالیهای ژنومی موجود استفاده کرده و در مورد گونه موردنظر، مجموعهای از ژن ها را که الگوهای حاصل از حضور یا عدم حضورشان موجب تمایز میان سویهها میگردد، مشخص میکند. در مرحله بعدی، مجموعهای از پرایمرهای PCR که ژنهای تشخیصدادهشده را هدف قرار میدهند، طراحی میشوند، به نحوی که اندازه محصولات با یکدیگر متفاوت شده و امکان مالتیپلکس کردن PCR فراهم شود. این نواحی هدف DNA و پرایمرهای PCR به منظور تایپینگ نمونههای باکتریایی به کار گرفته خواهند شد. قدرت تشخیصی این تست به حدی است که میتواند بین سویههای موجود در نمونههای بالینی با پروفایل MSLT (multilocus sequence typing) یکسان تمایز قائل شود. طراحی و بهکارگیری این متد آسان بود و میتوان از آن به عنوان ابزار تشخیصی مناسبی در تمامی مراکز استفاده نمود.
پس از اینکه آزمایشگاههای میکروبشناسی بالینی، ارگانیسمی را شناسایی کردند که multi-drug resistant است، باید بتوانند سویه آن را تشخیص داده و بررسی کنند که آیا این گونه قبلا مشاهده شده است یا نه. تمییز سرایت عفونتهای بیمارستانی از ورود گونههای جدید به محیط، این امکان را برای تیمهای کنترل عفونت میدهد که پاسخ هدفمندتری را در جلوگیری از گسترش عفونت برگزینند. درنتیجه متدی موثر برای تعیین سویههای باکتریها موردنیاز است که بتواند انتقال داخل بیمارستانی را از بین بیمارستانی تشخیص دهد.
متدهای تایپینگ با رزلوشن مطلوب غالبا از تفاوتهایی که در توالی نوکلئوتیدی DNA، محتوای ژنتیکی و یا ساختمان ژنومی وجود دارد، استفاده میکنند. متدی ایدهآل است که ارزان قیمت و سریع بوده و قادر به تمایز میان سویههای مشابه هم از همدیگر باشد. این متد همچنین باید بتواند نمونههای کنونی را از نمونههایی که پیشتر با استفاده از computational analysis، بررسی شدهاند، افتراق دهد. متدهای کنونی مانند PFGE (pulsed-field gel electrophoresis)، MLST و تعدادی از متدهای وابسته به PCR ماننند Rep-PCR و RAPD-PCR، میتوانند این کار را انجام دهند، ولی ممکن است هزینه بالا و یا سرعت و رزلوشن پایینی داشته باشند. متد دیگری که میتواند به این منظور استفاده شود، توالییابی کل ژنوم (whole-genome sequencing) است که استفاده روتین از آن به علت هزینه بالا و نبود ابزارهای بیوانفورماتیکی که بتوانند این دادهها را به سهولت به دادههای موردنیاز برای تایپینگ سویهها تبدیل کنند، محدود شده است. البته دادههای حاصل از این روش، این پتانسیل را دارند که به منظور توسعه تکنیکهای تشخیص مولکولی جدید تایپینگ به کار گرفته شوند.
طراحی متد PCR تایپینگ با استفاده از دادههای توالی ژنومی، از مفهوم pan-genome گونههای باکتریایی بهره میگیرد. این واژه برای اشاره به تنوع ژنی موجود بین سویههای گونه موردنظر به کار میرود که حین تکامل باکتریها ایجاد میشود. وجود واریانتهای ژنتیکی میان سویههای مختلف، این امکان را فراهم میسازد تا با پروبینگشان، متوجه حضور و یا عدم حضور این واریانتها و درنتیجه افتراق میان سویهها شد. مهمترین بخش طراحی این متدها، تعیین مجموعهای از ژنها است که حضور متغیرشان در ژنوم معیار تشخیص سویههای مختلف باشد. یکی از رویکردهایی که منجر به ماشینی شدن این فرایند شده است، آنالیز کامپیوتری به منظور یافتن امضاهایی ژنتیکی است که در گروهی از ژنوم های هدف وجود دارند ولی در ژنومهای بکگراند نه. محدودیت این رویکرد در آن است که تنها خواهد توانست عضویت یک نمونه در سویهای مشخص را تایید کند، اما قادر به تعیین ارتباط میان سویههای مختلف نخواهد بود.
فرایند Pan-PCR
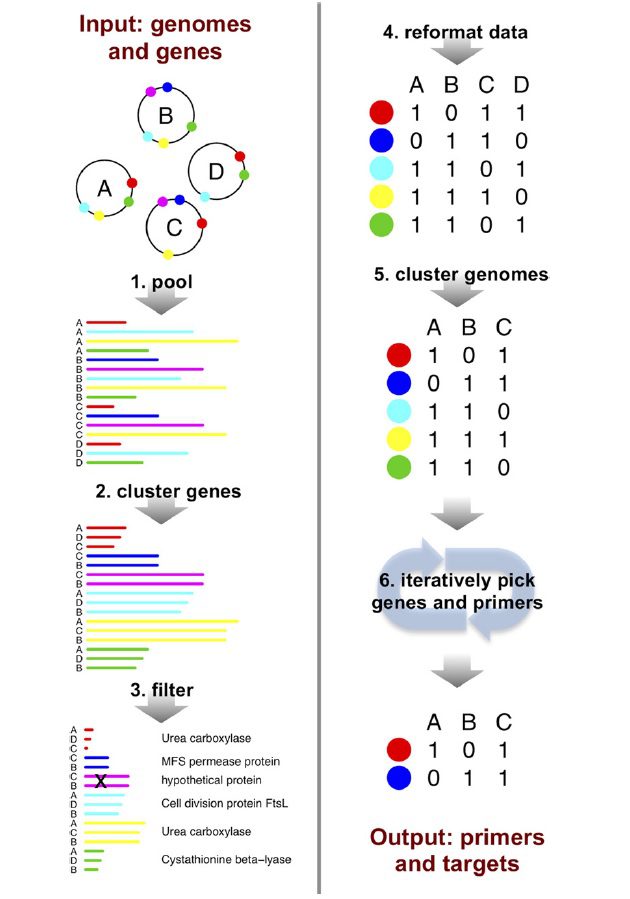
Pan-PCR، متدی در قالب computational است که از شمار روزافزون ژنوم های باکتریایی که به طور کامل توالییابی شدهاند بهره میگیرد. طی این تکنیک، محققان از pan-genome گونه موردنظر به عنوان دادههای ورودی استفاده کرده و به صورت اتوماتیک پرایمرهایی را تولید میکنند که میتوانند در تستهای multiplex PCR به منظور تشخیص سویه موجود استفاده شوند. به عبارت دیگر، Pan-PCR از قدرت کامپیوتر به منظور طراحی اتوماتیک حداقل پرایمرهای multiplex PCR ای استفاده میکند که بتوانند میان سویههای ورودی تمایز قائل شوند. این نتیجه با تعیین مجموعهای از ژنها که الگوی حضور و یا عدم حضورشان در مجموعه ژنومهای ورودی، امضایی منحصربهفردی از هر کدام از آنها ارائه میدهد، حاصل میشود. همانطور که گفته شد، multiplex کردن این فرایند به شرطی محقق میشود که محصولات PCR به دست آمده از پرایمرهای طراحی شده، دارای اندازههای متفاوتی باشد.
در pan-PCR ابتدا مجموعهای از توالیهای ژنومی، شامل annotation ژنهای کدکننده پروتئین به عنوان ورودی استفاده میشوند. در مرحله بعدی، توالی نوکلئوتیدی نواحی کدکننده pool شده و کل مجموعه بر اساس ویژگی توالی توسط نرمافزار CD-Hit دستهبندی میشود (مرحله clustering). دستههای ژنی که با عباراتی annotate شده اند که نشاندهنده تکامل سریع آن المان هستند، حذف میشوند. این عبارات عبارتند از: phage، transpos، frame و shift، integrase و hypothetical (مرحله فیلتر). ژنومهایی که تنها دارای ۵ درصد تفاوت در پروفایل دستههای ژنی هستند، یکسان در نظر گرفته خواهند شد. این مرحله از سوگیری در انتخاب دستههایی ژنی که تنها بین سویههای نزدیک به یکدیگری که دردادههای ورودی اولیه overrepresent شده بودند، پیشگیری خواهد کرد.
سپس دستههای ژنی نهاییشده وارد الگوریتم گزینش ژنها میگردند. سیستم کامپیوتری مورد استفاده، یک کامپیوتر دسکتاپ استاندارد است و نیازی به دستگاههای محاسبهگر پیچیده نیست. در این تکنیک نیز مانند تکنیکهای دیگری که در آنها طبقبندی بر مبنای تمایز دادههای خروجی (مثل الگوی باندها در ژل) صورت میگیرد، یکی از مسائل، چگونگی ارزیابی ارتباط میان سویهها است. در pan-PCR این تفاوت به سادگی و با محاسبه تعداد تفاوتها در نوارها انجام میپذیرد. سپس مقایسه دستههای متشکل از سویهها به صورت گروهی و با اعمال دستهبندی hierarchical بر اساس تفاوتهای موجود در الگوی نوارها صورت میگیرد. به این ترتیب، pan-PCR امکان طراحی آسان تستهای تایپینگ را بدون نیاز به متخصصین انفورماتیک فراهم میکند و از این رو، میتواند کاربرد گستردهای داشته باشد. امکان بهکارگیری این تکنیک برای همه گونههایی که توالی ژنومی مرجع آنها در دسترس است میسر میباشد.
از مهمترین مسائلی که در تمام تکنیکهای تایپینگ مطرح است، تعیین آستانهای از تمایز میباشد که در آن دو سویه میتوانند متفاوت از یکدیگر در نظر گرفته شوند. در حیطه کنترل عفونتها، تعیین آستانه تمایزی مطمئن در تشخیص اینکه آیا باکتری ایزولهشده، جدید است یا به صورت بیمارستانی انتقال یافته، میتواند مفید واقع شود. ژنومهای باکتریایی دائما در حال تکامل و تغییرند و درنتیجه تایپهای باکتریایی نیز تغییر مییابند. درنتیجه، تستی میتواند دقیق و مطمئن باشد که توالیهای موردبررسی به نحوی پایدار و قابل پیشبینی عوض شوند. طراحی pan-PCR به گونهای است که المانهای ژنومی ناپایدار از لحاظ تکاملی مانند ترنسپوزونها را فیلتر کرده و از قسمتهای نسبتا پایدار بهره میگیرد. به علاوه، از آنجایی که فرایند انتخاب ژن در این تکنیک، گزینش ژنهایی را ترجیح میدهد که مستقل از همدیگر وارد ژنوم شده یا از آن خارج میشوند، برای اینکه تغییراتی چندگانه در الگوی نوارها پدید آید، چندین فرایند کسب ژن یا از دست دادن آن باید رخ داده باشد.
انقلابی که توالییابی پدید آورده است، اکنون در حال ورود به فازی جدید است که در آن قدرت علم ژنومیکس در کاربردهای بالینی به کار گرفته خواهد شد. تکنیک pan-PCR این امکان را برای آزمایشگاههای میکروبیولوژی فراهم میکند که بتوانند از دادههای ژنومی برای طراحی تستهای تایپینگ باکتریایی مقرونبهصرفه، سریع و پردقت استفاده نمایند. انعطاف این تکنیک به حدی است که تنها با تغییر دادن ژنومهای ورودی آن را برای تمام کاربردها تطبیق داد. بهعلاوه با کاهشی که در هزینه توالییابی ژنومهای باکتریایی شاهد هستیم، آزمایشگاههای میکروبیولوژی خود قادر خواهند بود، دستههای ژنومی موردنظر خود را توالییابی کرده و pool سویههای توالییابی شده را گسترش دهند. توانمندسازی آزمایشگاههای میکروبیولوژی در بهرهگیری از دادههای ژنومی، در درمان موثرتر عفونتهای باکتریایی نقش بهسزایی خواهد داشت.
تست Pan-AC
میزان شیوع آسپرژیلوزیس و کاندیدیازیس ناشی از گونههایی به جز A. fumigatus و A. albicans روز به روز در حال افزایش است که نیاز ما به روشهای تشخیصی سریع به منظور تعیین هویت دستههایی از پاتوژنهای قارچی را بالا میبرد. بیش از ۹۰ درصد کل عفونتهای قارچی در افرادی که سیستم ایمنی آنها سرکوب شده است، مربوط به گونههای آسپرژیلوس و کاندیدا میباشد. تشخیص زودهنگام پاتوژنهای قارچی در تعیین درمان ضدقارچی مناسب و بهبود سریعتر بیماران با عفونتهای قارچی تهاجمی ضروری است. تستهای استاندارد تشخیصی مانند کشت خون و تشخیص سرولوژیکی آنتیژنهای قارچی در گردش، دارای درجات متفاوتی از حساسیت و اختصاصیت میباشند. بررسی هیستولوژیک بیوپسیهایی که به روش computed tomography-guided تهیه شدهاند، حساسیت و اختصاصیت بالایی دارند، ولی در بیماران مبتلا به ترومبوسیتوپنی عوارضی مانند خونریزی شدید را ایجاد میکنند.
در نتیجه، Baskova و همکارانش با توجه به نبود تکنیکی با حساسیت کافی و صرفه اقتصادی مناسب برای شناسایی قارچهای با اهمیت بالینی بالا، تکنیکی broad-spectrum را برای تشخیص عفونتهای قارچی تهاجمی که از آسپرژیلوس و کاندیدا ناشی میشوند، توسعه دادند. این متد Pan-AC (Pan-Aspergillus و Pan-Candida) نام دارد و تنها با یک واکنش، امکان تشخیص و سنجش کمی طیف گستردهای از گونههای آسپرژیلوس و کاندیدا را که دارای اهمیت بالینی هستند، فراهم می آورد. طراحی این سیستم پرایمر/پروبی بینالمللی منحصربهفرد بوده و از پروبهای هیدرولیز pan-Aspergillus و pan-Candida بهره میگیرد. تکنیک PCR مورد استفاده، real-time PCR است و تنها با بهکارگیری یک جفت پرایمر و یک پروب universal، به انجام میرسد.
ناحیه هدف مورداستفاده در تست Pan-AC، توالی بسیار حفظشدهای است که مربوط به زیرواحد ۲۸S ژن rDNA قارچی (زیرواحد بزرگ ریبوزوم) بوده و دارای طولی کمتر از ۱۵۰ جفتباز میباشد. این ناحیه در ۱۰ گونه از آسپرژیلوسها (مانند Aspergillus fumigatus، Aspergillus flavus، Aspergillus niger، Aspergillus terreus، Aspergillus versicolor و Aspergillus nidulans) و ۶ گونه از کاندیداها (Candida albicans, Candida glabrata, Candida krusei, Candida tropicalis, Candida parapsilosis, Candida kefyr, Candida guilliermondii, Candida lusitaniae and Candida dubliniensis) یافت میشود. پس با بهرهگیری از این توالی، می توان تعداد فراوانی از سویههای قارچی را با مجموعه پرایمری universal تکثیر نمود و تاثیر جهشهای نقطهای را بر تشخیص به حداقل رساند. این تست cross-reactivity خاصی با پاتوژنهای غیرقارچی ندارد، اما به علت هومولوژی ناحیه هدف با برخی از نواحی ژنوم انسانی ممکن است cross-reactivity کمی را با نمونههای مربوط به افراد سالم بدهد. مشکل گفتهشده با افزایش stringency واکنش PCR با استفاده از فرمآمید یک درصد، برطرف میگردد. لازم به ذکر است که این ماده کارایی کلی واکنش تکثیر را به خطر نمیاندازد.
یکی از اساسیترین مسائل مربوط به تستهای PCR قارچی، خطر بالای آلودگی است که به علت حضور انواع فراوانی از اسپورهای قارچی در هوا و نیز ردپای DNA قارچی در انواع مواد اولیه PCR وسایر موارد مصرفی رخ میدهد. به منظور اجتناب از نتایج مثبت کاذب، باید تمام مواد مورداستفاده از لحاظ آلودگی قارچی کنترل شوند و در هر کدام از تستها، کنترلهای منفی مالتیپل لحاظ گردند. تستهای تشخیصی مربوط به قارچها باید در شرایطی که تجهیزات کافی موجود است، انجام بگیرند. به عنوان مثال، مراحل آمادهسازی مواد اولیه و پردازش نمونههای بالینی باید زیر جریان لامینا هود biohazard انجام شود. با توجه به کنترلها و شرایط موجود در تست Pan-AC، این متد میتواند ابزاری مطمئن برای تشخیص و سنجش کمی و نیز مانیتورینگ پاتوژنهای قارچی گفته شده واقع شود.
تست Pan-AC به علت اختصاصیت بالایی که دارد، به عنوان تکنیک غربالگری عمل کرده و حضور عفونتهای قارچی تهاجمی در نمونههای بالینی را به خوبی تشخیص میدهد. این تست نمیتواند گونهها را به صورت اختصاصی تشخیص دهد و صرف وجود طیف وسیعی از آسپرژیلوسها و کاندیداها را در نمونه میسنجد. پس مزیت این روش در غربالگری انواعی از پاتوژنهای قارچی در نمونه است، که در صورت مثبت شدن تشخیص، درمان اولیه با داروهای ضدقارچی broad-spectrum مانند voriconazole یا caspofungins به عنوان خط اول درمان، آغاز میگردد. بعد از این مرحله، میتوان تستهای تشخیصی تکمیلی را به منظور تعیین گونه عامل بیماری به انجام رساند که روش مورد استفاده معمولا PCR ناحیه ITS (internal transcribed spacer) یا هیبریداسیون اختصاصی گونه است. پس از تعیین گونه بیماریزا، داروهای ضدقارچی باریکاثر مانند fluconazole یا amphotericin B استفاده میشوند.
