پیشرفتهای عظیم در تصویربرداری از بیومولکولها؛ صحبت از همه چیز است! از سوزن باکتریها که برای ورود به سلول استفاده میکنند گرفته تا ساختار ویروس زیکا. این دستاوردها باعث شده تا جایزهی نوبل شیمی ۲۰۱۷ به سه دانشمند برسد. این جایزه به پیشگامان تکنیکی به نام میکروسکوپی کرایو-الکترون (cryo-EM) رسیده است: Jacques Dubochet از دانشگاه Lausanne سوئیس، Joachim Frank از دانشگاه کلمبیا و Richard Henderson از آزمایشگاه شورای تحقیق پزشکی برای بیولوژی مولکولی (LMB) در کمبریج، انگلستان.
مقالهی مرتبط: برندگان جایزه نوبل پزشکی ۲۰۱۷؛ ساعت بیولوژیک در کانون توجه
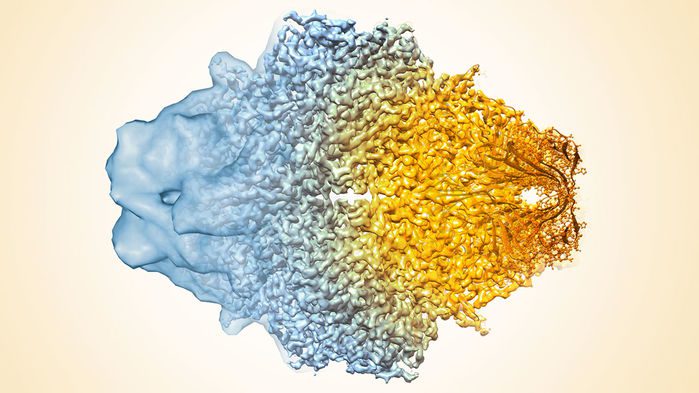
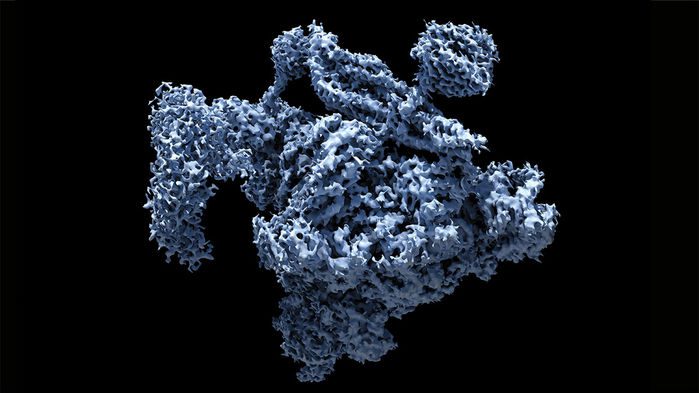
برندگانی که از ایشان نام بردیم، به صورت معناداری به بهبود وضوح مولکولهای زیستی که شامل تصاویر سهبعدی هم میشود، کمک کردهاند. آنها درِ جدیدی برای مشاهدهی این مولکولها در سلول و برهمکنششان به سوی دنیایی تازه باز نمودهاند. پیشرفتهای بیشتر کرایو-الکترون را تا حد اتم دقیقتر کرده است؛ درست مثل کریستالوگرافی اشعهی X. در حقیقت، با انقلابی در بیوشیمی روبهرو هستیم!

در اوایل کار، سال ۱۹۳۱، انواع اولیهی میکروسکوپ الکترونی در دسترس بود ولی محدودیتهای اساسی برای زیستشناسان به همراه داشت. نمونهها بایستی در خلأ قرار میگرفتند. سپس مولکولهای زیستی خشک شده و ساختارشان به هم میخورد و اشعههای حاصل از پرتوتابی ممکن بود به بیومولکولهای حساس آسیب بزنند. با آغاز دههی ۱۹۵۰، کریستالوگرافی اشعهی X به بیولوژیستها اجازه داد تا تصاویر ساکن از ساختار پروتئینها تهیه نمایند؛ البته این امکان هم در صورتی وجود داشت که بشود مولکولها را کریستالیزه کرد. بالاخره در دههی ۱۹۸۰، تشدید مغناطیسی هستهای مطالعهی ساختار پروتئینها را فراهم کرد؛ ولی بیشتر برای پروتئینهای کوچک آن هم در حالت محلول.
بخاطر کارهای دانشمندانی که جایزهی نوبل امسال شیمی را ازآن خود کردهاند، امروز، کرایو-الکترون راهی سادهتر را برای به تصویر کشیدن انواع مختلفی از مولکولها فراهم کرده است. این مولکولهای شامل اهداف دارویی جدید نیز میشوند. روش مستقیمتر است، فهم آن راحت و قدرت آن عمومیتر میباشد.
هندرسون گام بلندی برای عبور از موانع کریستالوگرافی اشعهی X برداشته است: او نتوانست پروتئینهای غشا را برای کریستالیزه کردن آماده کند؛ بنابراین غشای سلول باکتریایی، حاوی نوعی پروتئین به نام باکتریورودوپسین را داخل میکروسکوپی الکترونی قرار داد و برای حفظ رطوبت، آن را با گلوکز پوشاند. پس از این کار، و با پائین آوردن انرژی اشعهی تابشی، تصویری با کنتراست کم بدست آمد. چون مولکولها با روشی دارای ترتیب در غشا جاسازی شده بودند، هندرسون توانست الگویی انکساری بدست آورده و آن را به تصویری با وضوح بالاتر تبدیل کند.
کارها پیش رفت تا اینکه سرانجام او در سال ۱۹۷۵، تصویری سهبعدی از یک پروتئین ساخت. در آن زمان، آن تصویر ظریفترین پرترهای بود که نقاشی الکترونی از چهرهی پروتئین ساخته بود. این دستارود قابلیتهای تکنولوژی او را اثبات میکرد. موردی که گفتیم کمی ویژه بود؛ چون جاسازی ترتیبدار پروتئینها در غشای سلول بدست میآمد. این تکنولوژی میتوانست برای هر مولکولی استفاده شود.
آنها جهان کاملاً جدیدی را به ما معرفی کردهاند.
پیتر برززینسکی، دانشگاه استکهلم
مقالهی مرتبط: برندگان جایزهی نوبل فیزیک ۲۰۱۷؛ اکتشاف امواج گرانشی
هنوز چالشی باقی مانده بود: چگونه میتوان از پرتوتابی کم-انرژی برای مشاهدهی مولکولهای با نظم کمتر استفاده کرد؟ مشکل این بود که این مجموعههای مولکولی دستهبندی مغشوشی از تصاویر را ارائه میداد؛ چون به صورت تصادفی جهتگیری داشتند. بین سالهای ۱۹۷۵ و ۱۹۸۶، فرانک راهی پیدا کرد تا این اطلاعات را معنیدار کند. او تصاویر را بر اساس شکل دستهبندی و حدوسط آنها را پیدا نمود. این کار نه تنها دقت تصاویر دوبعدی را بالا میبرد، بلکه زمینهی ایجاد تصاویر سهبعدی را نیز فراهم میآورد. (این جایزه برای خود فرانک “اغراقشده” احساس میشود. او در تماس تلفنی گفت که: «من حرفی برای گفتن ندارم»).
پیشرفت مهم بعدی به کارهای Dubochet در اوایل دههی ۱۹۸۰ مربوط میشود. مشکل منجمدسازی نمونههای زیستی این بود که کریستالهای یخ پرتوهای الکترونی را پراکنده میکردند. این کار باعث تار شدن تصاویر میشد. Dubochet به این باور رسید که اگر آب به اندازهی کافی سریع منجمد شود (مثل درست کردن شیشه)، کریستالهای یخی شکل نمیگیرند. Dubochet توانست با قرار دادن نمونهها در محلول اِتنی که به وسیلهی نیتروژن تا –۱۹۶°C سرد شده، تصاویری خارقالعاده خلق کند. به گفتهی برززینسکی، افراد زیادی از سراسر دنیا برای یادگیری این تکنیک به آزمایشگاه Dubochet سفر کردند. ارزش این تکنیک بخاطر تصویربرداری از مولکولهای در موقعیتهای مختلف بود که امکان تبدیل شدن آنها را به فیلم برای بازسازی حرکاتشان فراهم میساخت.
با اعلام برندههای نوبل شیمی امسال، تعداد آمریکاییهای برندهی جایزهی نوبل از مجموع ۹ دانشمند، به هفت نفر رسید (به جز Dubochet که اهل کشور سوئیس و Henderson که بریتانیایی است). Frank و یکی از برندههای نوبل فیزیک ۲۰۱۷، Rainer Weiss، هر دو در آلمان متولد شدهاند ولی اکنون شهروند آمریکا هستند.
Göran Hansson، یکی از مسئولین آکادمی، در پاسخ به سؤال ژورنالیستی چینی دربارهی آمریکایی بودن برندگان اینگونه توضیح میدهد:
ایالات متحده پس از جنگ جهانی دوم به دانشمندان اجازه داده تا برای تمرکز روی سؤالات مهم در علم، تحقیقات پایهای راه بیاندازند. آنها را برای انجام کارهای فوری مجبور، یا در مسیری سیاسی کنترلشان نکرد. این آزادی، به همراه منابع خوب، به آمریکا کمکهای شایانی کرده است.
او به این نکته هم اشاره کرد که LMB نیز چنین آزادیای به دانشمندانش داده که تاکنون توانستهاند ۱۵ جایزهی نوبل دریافت نمایند.
برندگان جایزهی نوبل شیمی سال ۲۰۱۷، مدالهای خود را در دهم دسامبر، طی مراسمی در استکهلم دریافت خواهند کرد. آنها همچنین باید جایزهی ۱.۱ میلیون دلاری را بین خودشان تقسیم کنند!
