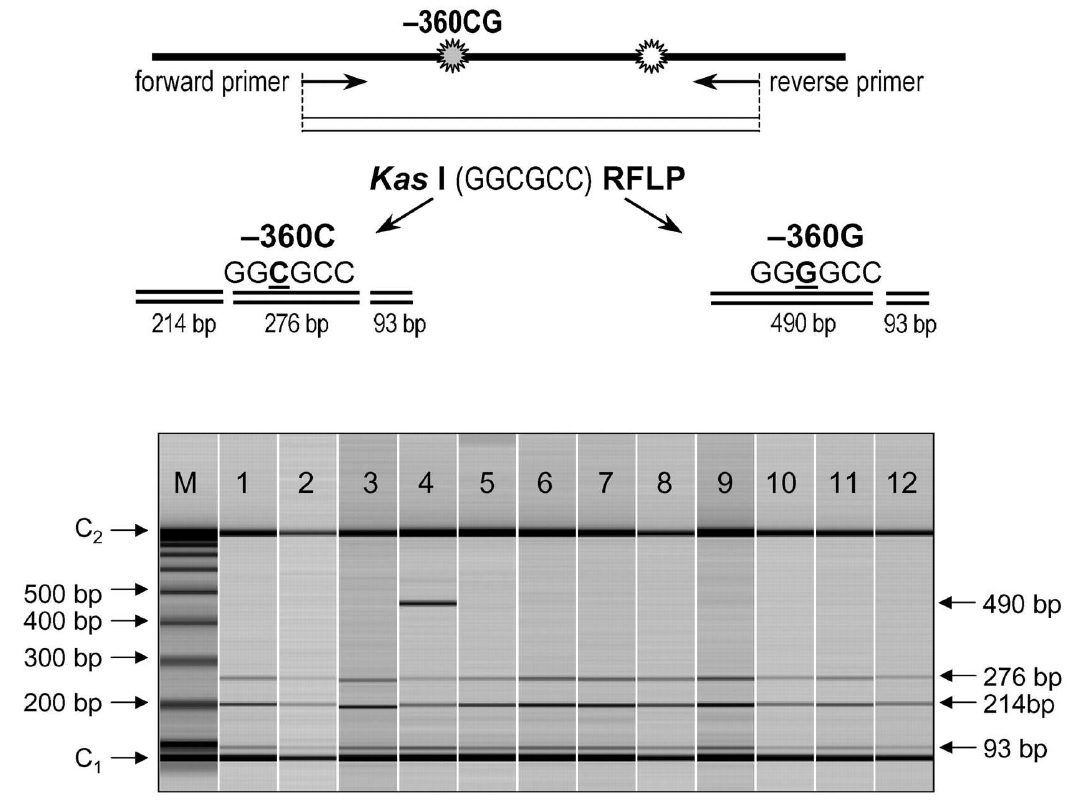
آنالیز PCR-RFLP که CAPS نیز نامیده میشود (Cleaved Amplified Polymorphic Sequence)، تکنیکی پرکاربرد در آنالیزهای ژنتیکی است. PCR-RFLP ترکیب دو تکنیک میباشد: PCR، تکنیکی است که امکان تکثیر ناحیه خاصی از DNA را که توسط دو پرایمر تعیین میشود، فراهم میکند. RFLP تکنیکی است که توسط آن، تمایز افراد از یکدیگر با آنالیز الگوهای قطعات DNA ای انجام میگیرد که در اثر برش با آنزیم محدودکننده ایجاد شده اند.
مقالات مرتبط:
این تکنیک روشی سریع، آسان و ارزان به منظور تعیین ژنوتیپ SNPها و واریانتهای داخل گونهای و بین گونهای است. این متدولوژی نیازی به استفاده گسترده از الیگونوکلئوتیدهای لیبلشده با مواد فلورسنت را نداشته و به علت عدم نیاز به تجهیزات تخصصی، برای آزمایشگاههایی که به صورت روتین ژنوتایپینگ را انجام نمیدهند، بسیار مناسب است. تکنیکهای فراوانی وجود دارند که مرتبط با PCR-RFLP بوده و از الکتروفورز در ژل نیز بهره میگیرند؛ مانند انگشت نگاری DNA و تهیه پروفایل بیان ژن.
آنزیمهای محدودکننده
آنزیمهای محدودکننده آنزیمهایی هستند که DNA دورشتهای را در توالیهای خاصی از آن برش میدهند و علت نامگذاری آنها، محدود کردن ورود مولکولهای DNA خارجی به درون سلولهای باکتریایی است. این آنزیمها در دهه ۱۹۷۰ شناسایی شدند و معمولا در ارگانیسمهای پروکاریوتی یافت میشوند. همان طور که گفته شد، آنزیمهای محدودکننده در برش مولکولهای DNA بیگانه، خصوصا باکترویوفاژها، کاربرد دارند. ارگانیسمهای تولیدکننده اندونوکلئازهای محدودکننده، با متیلاسیون نوکلئوتیدهای داخل جایگاه تشخیص اندونوکلئاز از ژنوم خود محافظت میکنند.
از زمان شناسایی نخستین آنزیم محدودکننده نوع II، آنزیم HindII که در سال ۱۹۶۸ از Haemophilus influenza جداسازی شد، این ترکیبات به جزئی اصلی در آزمایشگاههای زیستشناسی تبدیل شدهاند. از جمله کاربردهای این آنزیمها، نقشهبرداری DNA، کلونینگ DNA، ساترن بلاتینگ و RFLP است. تاکنون بیش از ۳۰۰ آنزیم محدودکننده از صدها سویه باکتریایی استخراج شدهاند و نامگذاری آنها بر اساس ارگانیسمی که از آن مشتق شدهاند، انجام میشود. به عنوان مثال EcoRI از Escherichia coli گرفته شده و نخستین آنزیمی است که از آن ارگانیسم استخراج شده است.
این آنزیمها در چهار دستهبندی قرار میگیرند. انواع I، III و IV، متشکل از یک کمپلکس آنزیمی هستند که دارای هر دو نوع فعالیت محدودکنندگی و متیلازی است. هر سه نوع آنزیم گفته شده توالیهای مشخصی را شناسایی میکنند، اما جایگاههای برش ممکن است صدها باز دورتر از جایگاه تشخیص باشد. آنزیمهای نوع II، مهمترین کلاس آنزیم های محدودکننده هستند و از این به بعد مورد بحث ما خواهند بود.
آنزیمهای نوع II، فاقد متیلاز بوده و DNA را به صورت تصادفی برش نمیزنند؛ بلکه طول DNA دورشتهای را اسکن میکنند تا بتوانند جایگاه تشخیص ۴ تا ۸ (۴تا۶؟؟ ۴ تا ۱۲ ) نوکلئوتیدی خود را پیدا کنند. این آنزیمها سپس، ناحیه داخل جایگاه تشخیص و یا نزدیک آن را برش میدهند. جایگاههای تشخیص در آنزیمهای مختلف متفاوتند و بسیاری از آنها پالیندرومیک میباشند. هر چه طول جایگاه تشخیص بیشتر باشد، احتمال تکرار آن بر حسب تصادف در کل ژنوم کمتر بوده و طول قطعات حاصل، بلندتر خواهد شد.
به علت مکمل بودن جفتبازها در مولکول DNA، آنزیم هر دو رشته DNA را برش میزند و بسته به محل برش، دو نوع انتها را ایجاد مینماید: ۱) در صورت برش هر دو رشته از مرکز تقارن، انتهاهای کور (blunt) ایجاد میگردند؛ ۲) در صورت قرارگیری محل برشها به صورت متقارن در امتداد خط تقارن، انتهاهای چسبنده را خواهیم داشت. لازم به ذکر است که هضم DNA با منبع مشخص، با آنزیم محدودکننده معین، همواره و در هر بار تکرار آزمایش، منجر به تولید مجموعه ثابتی از قطعات خواهد شد.
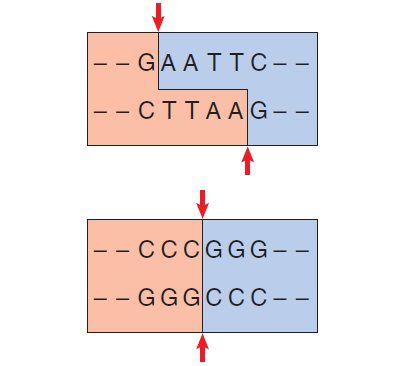
آنزیمهای محدودکننده کاربردهای متعددی دارند. از آنجایی که توالی DNA ارگانیسمهای مختلف متفاوت است، الگوی جایگاههای تشخیص نیز متفاوت خواهد بود. منبع DNA استخراجشده نیز میتواند به این نحو تعیین گردد. در صورتی که DNA ژنومی از دو نوع ارگانیسمی استخراج شده و هر دو با آنزیم محدودکننده معینی برش داده شوند، پس از الکتروفورز دو مجموعه متفاوت تشکیل خواهند شد. این تکنیک در مورد افراد مختلف یک گونه نیز میتواند اعمال شود. تفاوت در توالیها اندک خواهند بود، اما با این وجود آنزیمهای محدودکننده میتوانند آنها را شناسایی کنند.
واریانتهای ژنتیکی و RFLP ها
انواع مختلفی از واریانتهای ژنتیکی وجود دارد. واریانتهای کوچک مقیاس (small-scaled) شامل SNPها (single nucleotide polymorphisms)، MNPها (multi-nucleotide polymorphisms) و microindelها هستند. MNPها واریانتهای چندنوکلئوتیدی پیدرپی با طولی ثابت هستند و از انواع آنها میتوان DNPها (double nucleotide polymorphisms) و TNPها (triple nucleotide polymorphisms) را نام برد که به ترتیب دارای دو و سه نوکلئوتید متغیر میباشند. Microindelها نیز تغییراتی از نوع حذف شدن، مضاعف شدن و ترکیبهایی هستند که باعث افزایش یا کاهش ۱ تا ۵۰ نوکلئوتید میشوند.

ژنوم انسانی حاوی بیش از سه میلیون SNP است که به طور میانگین، حدود ۱۰۰۰ جفتباز از یکدیگر فاصله دارند. فراوانی DNPها و TNPها که شایعترین انواع MNPها هستند، حدود یک درصد تعداد کل SNPها است. البته به علت عدم دقت کافی تکنیکهای توالی یابی، احتمالا حذفها و افزایشهای کوچک کمتر از میزان واقعی تخمین زده شدهاند.
SNPها و سایر واریانتهای کوچکمقیاس در بیماریهای تکژنی تا بیماریهای پیچیده نقش دارند. آنها همچنین در تفاوت پاسخ افراد به داروها دخیل هستند. به عنوان مثال وجود SNPها و microindelها در ژنهای کدکننده آنزیمهایی مانند CYP2D6 که مسئول متابولیزاسیون داروها هستند، میتواند به از دست رفتن فعالیت آنزیم و کاهش سرعت متابولیسم تعدادی از داروها منجر شود. در نتیجه تلاشهای فراوانی به منظور توسعه تکنیکهای تعیین ژنوتیپ واریانتهای کوچکمقیاس خصوصا SNPها در حال انجام است.
از جمله روشهای ابتدایی استفاده از SNPها به عنوان مارکرهای ژنتیکی، آنالیز RFLPها (Restriction Fragment Length Polymorphisms) است. RFLP ها به هر نوع پلیمورفیسم DNA که معمولا انواعی از SNP ها هستند، اطلاق میگردند که باعث ایجاد جایگاه تشخیص آنزیمی خاص و یا از بین رفتن آنها میشوند. واضح است که برخی از افراد جمعیت دارای این جایگاهها بوده و برخی فاقد آن هستند. در صورتی که SNP در داخل جایگاه تشخیص آنزیم محدودکننده قرار بگیرد، قطعات DNA حاصل از آنزیم محدودکننده در افراد مختلف طولهای متفاوتی خواهند داشت. این موضوع به علت متصل باقی ماندن قطعات در صورت نبود جایگاه تشخیص و برعکس رخ میدهد.
در بررسی RFLP ها، میتوان DNA را توسط آنزیم محدودکننده خاصی هضم و محصولات را تحت تاثیر پروبهای هیبریداسیونی قرار داد که قسمت متغیر ژنوم را احاطه میکنند. روش آسانتر، استفاده از پرایمرهای احاطه کننده ناحیه پلیمورفیک، تکثیر این نواحی و سپس برش محصولات با آنزیمهای محدودکننده است. به این ترتیب است که RFLPها یا چندشکلی طول قطعات حاصل از آنزیم محدودکننده (restriction fragment length polymorphism) حاصل میشوند. الگوی قطعات حاصل توسط الکتروفورز به دست میآید. به ازای تفاوت در هر باز موجود در محل برش، تعداد و اندازه یک تا دو قطعه تغییر خواهد کرد.
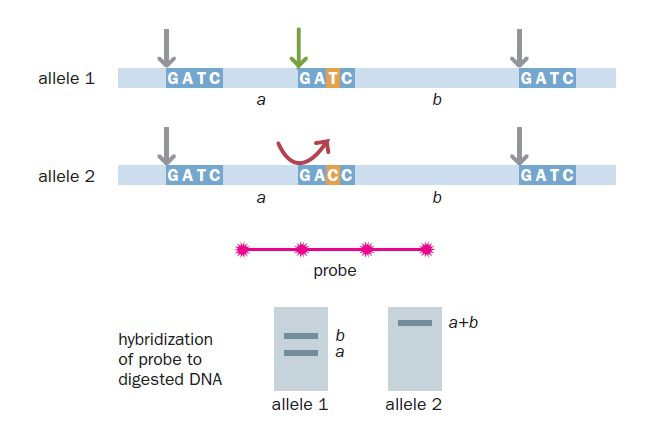
نخستین نقشه تبارشناسی ژنوم انسان که در سال ۱۹۷۸ منتشر شد، بر پایه RFLP تهیه شده بود. این نقشه علیرغم اینکه دستاورد بزرگی محسوب میشد، کاربرد بسیار محدودی داشت. علت این موضوع، تعداد بسیار کم مارکرها بود: تنها ۳۹۳ RFLP مورد استفاده قرار گرفته بودند. همچنین، از آنجایی که RFLPها تنها دارای دو الل هستند (حضور جایگاه تشخیص یا عدم حضور آن)، مارکرها درجه پلیمورفیک بودن پایینی داشتند.
با این حال RFLP ها به علت سهولت تشخیص، یکی از پرکاربردترینها هستند. در ژنومهای کوچکی مانند ژنوم مخمر، مانیتور فرکانس نوترکیبیها بین دو الل RFLP بسیار آسان است؛ به این نحو که با میوز سلولهای دیپلوئید مخمر و تشکیل چهار سلول هاپلوئید و سپس کشت هر کدام از این چهار سلول، میتوان مارکرهای RFLP را از نسلی به نسل دیگر دنبال کرد. انجام چنین کاری در انسانها بسیار دشوار است، اما می تواند در مطالعه خویشاوندان نزدیک به کار رود.
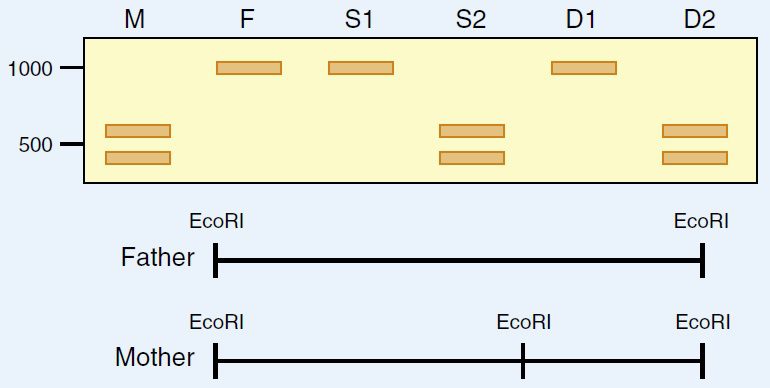
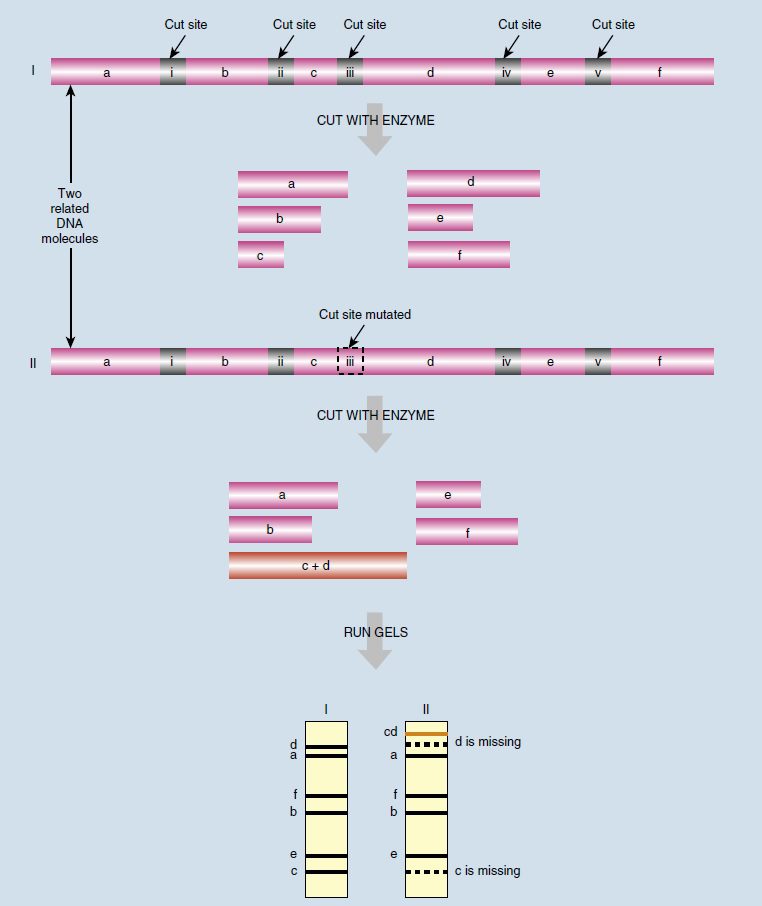
آنالیز RFLP
در روشهای قدیمی آنالیز RFLP، از یک یا چند عدد آنزیم محدودکننده به منظور برش DNA ژنومی در جایگاههای مشخص استفاده میکنند. پس از برش، قطعات حاصل بر اساس اندازه مولکولی خود توسط الکتروفورز در ژل جداسازی و به غشای نایلونی متقل میشوند. سپس این قطعات با پروبهای DNA لیبل شده، که تنها به اللهای واقع در لوکوسهای مشخص متصل میشوند، تشکیل هیبرید میدهند (ساترن بلاتینگ).
در مقایسه DNA افراد مختلف، تفاوت در اندازه قطعات حاصل، ناشی از اضافه شدن توالیها، حذف آن ها، جانشینیها و بازآراییها است که جایگاه تشخیص آنزیم را تغییر میدهند. در نتیجه، اندازه و موقعیت قطعات DNA بین افراد مختلف متفاوت خواهد بود. این روش همان طور که گفته شد، کاربردهای متعددی دارد و در تحقیقات جنایی و مطالعات تبارشناسی ژنتیکی مورداستفاده قرار میگیرد.
علیرغم مزیتهای این روش که از جمله آنها، قدرت تمایز بالا است، آنالیز RFLP معایبی نیز دارد. این روش نیازمند چندین میلیگرم (۵-۱۰ میلیگرم) از مولکولهای DNA با کیفیت بالا/ وزن مولکولی بالا است. همچنین ممکن است به منظور بصری سازی نتایج نیازمند مواد رادیواکتیو باشیم. این آنالیز سرعت پایینی داشته و نمیتواند ماشینی شود. این مشکلات استفاده از RFLP را محدود کرده اند و ظهور مارکرهای ژنتیکی جایگزینی مانند میکروستلایتها و SNPها، به میزان زیادی به این تکنیک غالب شدهاند.
PCR-RFLP
تکنیک PCR-RFLP بر پایه وجود یک SNP، MNP و یا میکروایندل خاص است، که میتواند جایگاه تشخیص آنزیم محدودکننده موردنظر را ایجاد کرده و یا آن را از بین ببرد. در صورتی که آنزیم محدودکنندهای بتواند DNA را تنها در حضور یک الل SNP موردنظر برش بزند، این آنزیم میتواند به منظور شناسایی آن SNP مورد استفاده قرار بگیرد. بررسی چنین تغییراتی در صورتی ممکن میشود که پرایمرهای مورداستفاده دارای این خصوصیات باشند: ۱) جایگاه تشخیصی را احاطه کنند که وجود SNP در داخل آن، جایگاه تشخیص را ایجاد کرده و یا آن را حذف کند. ۲) در ارتباط با SNP موردنظر، جایگاه تشخیص را ایجاد و یا آن را حذف کند (PCR-RFLP مهندسی شده یا ePCR-RFLP).
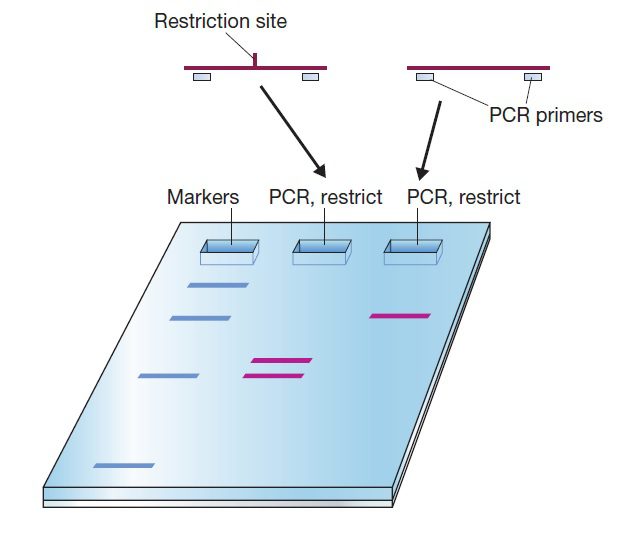
نخستین گام در آنالیز PCR-RFLP، تکثیر قطعه حاوی واریانت است. پس از این مرحله، قطعات تکثیرشده تحت تاثیر آنزیم محدود کننده مناسب قرار میگیرند. از آنجایی که وجود یا عدم وجود جایگاه تشخیص آنزیم مورداستفاده، به تولید قطعات با اندازههای مختلف منجر میشود، شناسایی اللها میتواند توسط الکتروفورز صورت بگیرد.
در مقایسه با RFLP استاندارد، PCR_RFLP مزیتهای فراوانی دارد. از جمله اینکه، آنالیز جایگاههای تشخیص بر پایه جایگاه به جایگاه، لوکوس به لوکوس و ژن به ژن است؛ مقدار DNA اولیه مورنیاز بسیار کم و در حد نانوگرم میباشد؛ در نمونههای تجزیه شده و فرسوده به خوبی عمل میکند؛ از آنجایی که نتایج میتوانند به خوبی با الکتروفورز در ژل آگارز استاندارد بصریسازی شوند، نیازی به استفاده از تجهیزات تخصصی و پیشرفته وجود ندارد؛ و طراحی PCR-RFLP معمولا آسان است و آنالیز آن به آسانی و با سرعت انجام میگیرد.
از جمله معایب PCR-RFLP، نیاز به اندونوکلئازهای اختصاصی و دشواری تعیین دقیق واریانت به علت فراوانی SNPهای تاثیرگذار بر یک جایگاه تشخیص خاص است. به علاوه، از آن جایی که PCR-RFLP دارای مراحل متعددی از جمله الکتروفورز است، به نسبت زمانبر میباشد. در نهایت این تکنیک به علت نیاز به وجود یک جفت پرایمر و آنزیم محدودکننده اختصاصی برای هر SNP، در آنالیز همزمان تعداد فراوانی از SNPها مناسب نیست. این موضوع کاربرد آن را در آنالیزهای با میزان ورودی بالا محدود کرده است.
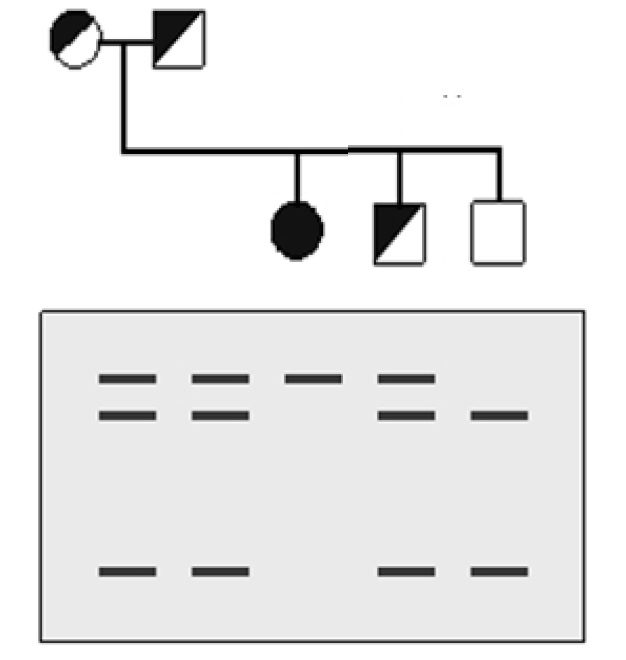
PCR-RFLP تکنیکی بسیار ارزشمند در تعیین ژنوتیپ واریانتهای اختصاصی گونهها است. این روش، معمولترین روش مورد استفاده در تعیین ژنوتیپ فاکتور V لیدن و پروترومبین G20210A میباشد. PCR-RFLP همچنین در موارد دیگری همچون تشخیص الل JK مرتبط با فنوتیپ Kidd-null و نیز تعیین اللهای آپوپروتئین E به کار میرود.