آنالیز SSCP) Single-strand conformation polymorphism analysis)
آنالیز پلیمورفیسم کانفورماسیون تکرشتهای (Single-stranded conformation polymorphism) یا SSCP، که به صورت PCR-SSCP نیز انجام میگیرد، متد غربالگری پرکاربردی است که امکان شناسایی واریانتهای ژنومی مختلف را در تعداد فراوانی از نمونهها و انواع زیادی از ارگانیسمها، از میکروارگانیسمها گرفته تا انسانها، فراهم میکند؛ به طوریکه میتواند بیش از ۹۰ درصد تغییرات تک جفتبازی را تشخیص دهد. Orita و همکارانش در سال ۱۹۸۹ تکنیک SSCP را توسعه دادند.
مقالات مرتبط:
آنالیز SSCP واریانتهای ژنومی (جهشهای نقطهای و تغییر در یک جفتباز) را از طریق تفاوت حرکت قطعات در الکتروفورز تشخیص میدهد. تئوری پشت SSCP آن است که هنگام قرارگیری DNA در ژل پلی آکریلآمید غیردناتورهکننده، توالی اولیه و طول قطعه تکرشتهای DNA، تعیینکننده کانفورماسیون آن هستند. در صورتیکه توالی DNA دارای جهشی حتی به اندازه یک جفتباز باشد و در شرایط غیردناتورهکننده قرار بگیرد، تغییر در حرکت قابل سنجشی را در الکتروفورز نشان خواهد داد.
پس از اینکه وجود جهش مشخص شد، آنالیز مستقیم توالی به منظور تعیین موقعیت دقیق توالی و باز تغییریافته در اثر جهش انجام میشود. پس علیرغم اینکه SSCP تکنیک غربالگری مفیدی است، اطلاعاتی در مورد موقعیت جهشها به دست نمیدهد. تغییر در موقعیت نوار، حضور جهش در محصولات PCR را تعیین خواهد کرد؛ اما بدون توالی یابی هیچگونه اطلاعاتی در مورد بازی که جهش یافته است، نخواهیم داشت.
توالی نوکلئوتیدی ژنوم در افراد مختلف یک گونه یکسان نیست. تخمین زده شده است که در ژنوم انسان، جایگزینیهای نوکلئوتیدی، به میزان یک در هر چند صد جفت باز احتمال وقوع دارند. روش قدیمی آنالیز این پلیمورفیسمها، آنالیز RFLP میباشد. RFLP در تعیین نقشه تبارشناسی ژنوم انسان موفق بوده و جایگاههای کروموزومی عناصر ژنتیکی ایجادکننده بیماریهای ارثی را مشخص نموده است.
علی رغم موثر بودن آنالیز RFLP در تمایز دو الل واقع در لوکوسهای کروموزومی مشخص، این روش دارای معایبی نیز هست. نخست آنکه RFLP ها تنها در صورتی میتوانند تشخیص داده شوند که پلیمورفیسم در جایگاه تشخیص آنزیم محدودکننده قرار گرفته باشد و یا حذفها و اضافهها در ناحیهای واقع باشند که بتوانند توسط پروبهای اختصاصی لوکوس تشخیص داده شوند. مورد دوم آن است که فرایند RFLP شامل تجزیه کل ژنوم تحت تاثیر آنزیم محدودکننده، ساترن بلاتینگ و تشخیص پلیمورفیسم در اثر هیبریداسیون با پروبهای رادیولیبلشده میباشد که هزینهبر و وقتگیر است.
Maniatis و همکارانش برای اینکه بتوانند فرایند تشخیص پلیمورفیسمها را کارآمدتر کنند، نشان دادند که ژلهای غیردناتورهکننده پلیآکریلآمید میتوانند جایگزینیهای تکجفتبازی را از DNA توتال ژنومی تشخیص دهند. اساس این موضوع، وقوع تغییرات در میزان حرکت است که از تغییر در کانفورماسیون قطعات تکرشتهای حاصل میشود.
بعدها نشان داده شد که پلیمورفیسمهای توالی نوکلئوتیدی میتوانند توسط آنالیز تغییرات میزان تحرک مولکولهای DNA تکرشتهای که در اثر جایگزینیهای تکجفتبازی ایجاد میشوند، شناسایی گردند. این آنالیز، آنالیز پلیمورفیسم کانفورماسیون تکرشتهای یا SSCP (Single-strand Conformation Polymorphism) نام گرفته است.
با افزایش تقاضایی که در آنالیز با ظرفیت وروردی بالای جهشها ایجاد شد، PCR سریعا جزئی از این فرایند شد و به منظور تولید قطعات با اندازه مناسب برای آنالیز SSCP به کار گرفته شد. در قسمتهای بعدی به توصیف نحوه تسهیل فرایند آنالیز SSCP توسط PCR و فراهم شدن امکان تشخیص جهشهای ناشناخته، پلیمورفیسمها و واریانتهای توالی خواهیم پرداخت.
مبانی PCR-SSCP
واکنش زنجیرهای پلیمراز پلیمورفیسم کانفورماسیون تکرشتهای (PCR-SSCP)، تکنیکی ساده به منظور تعیین سریع وجود تفاوت توالی میان قطعاتی نسبتا کوتاه از DNA است. این تکنیک در ترکیب با آنالیز توالی، روشی قدرتمند را تشکیل میدهد که در تعیین پلیمورفیسمها و جهشهای ژنتیکی و تشخیص ماهیت آنها بسیار مفید میباشد.
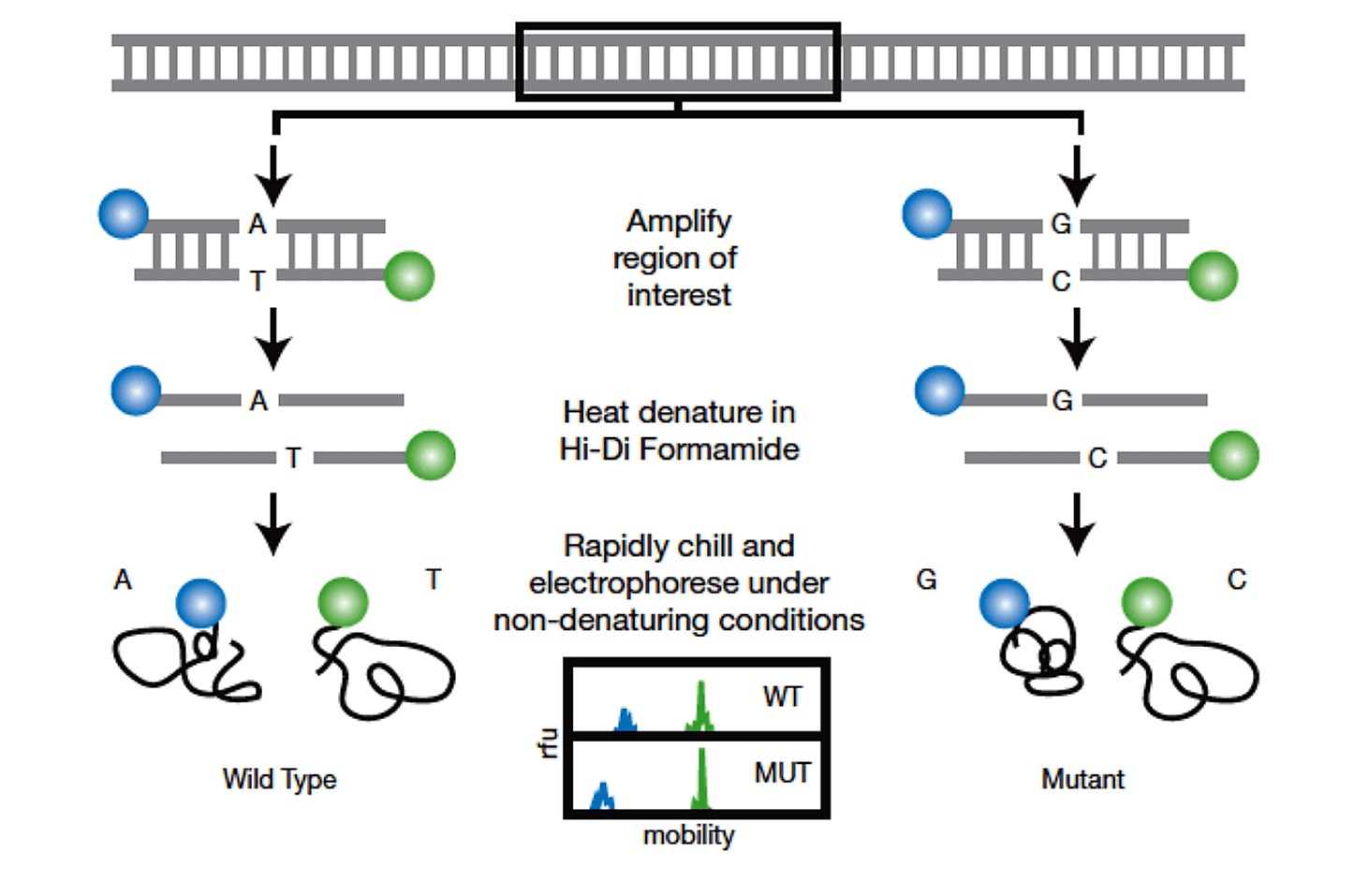
آنالیز PCR-SSCP دارای دو مرحله است. نخست، توالی DNA موردنظر توسط PCR و با استفاده از پرایمرهای مناسب تکثیر میگردد. از آنجایی که تفاوت در میزان تحرک در حالت استفاده از قطعات کوتاهتر DNA بهتر مشخص میشود، در نتیجه احتمال موفقیت در صورت استفاده از پرایمرهایی که قطعاتی در محدوده ۱۰۰ تا ۳۰۰ جفتباز را تکثیر میکنند، بیشتر است.
در مرحله دوم، DNA تکثیرشده که رقیقسازی شده است، تحت تاثیر حرارت دناتوره و به وسیله الکتروفورز در ژل پلی آکریلآمید غیردناتورهکننده (native) تفکیک میشود. پس از دناتوراسیون حرارتی، حرکت قطعات در ژل تابع دو فاکتور اندازه و توالی خواهد بود. در این حالت مولکولهای DNA تکرشتهای در اثر تشکیل جفتبازها به صورت داخل مولکولی، ساختارهای ثانویه را ایجاد میکنند. در نتیجه در مورد قطعه دورشتهای مورد نظر، به دنبال SSCP، دو نوار ایجاد خواهد شد که هر کدام منطبق بر دو رشته اولیه DNA می باشند.
در صورتی که اختلاف دو قطعه با یکدیگر حتی در حد یک جفتباز باشد، رشتههای دناتوره شده کانفورماسیونهای متفاوتی به خود خواهند گرفت و به دنبال native PAGE از یکدیگر تشخیص داده خواهند شد. تشخیص تفاوت بر اساس تغییر در حرکت یکی از نوارها یا هر دوی آنها در مقایسه با رشتههای کنترل وایلدتایپ صورت میگیرد.
به منظور تهیه مواد مورد نیاز برای توالی یابی، همان مخلوط تهیه شده برای SSCP تکثیر و از بافری بدون محتوای رادیواکتیو برای کلونینگ استفاده میشود. کیتهای تجاری بسیاری برای کلونینگ و توالییابی وجود دارند. به علاوه، میتوان نوارهای SSCP را از ژل برش داده و دوباره با همان مجموعه پرایمرها به وسیله PCR تکثیر نمود. این موضوع روشی آسانتر را به منظور توالییابی مستقیم سگمان تغییریافته فراهم میکند.
آنالیز SSCP میتواند با استفاده از هر دو تکنولوژی فلورسنت و رادیواکتیو انجام بگیرد. در تکنیکهای رادیواکتیو، نوکلئوتیدهای رادیواکتیو حین PCR به داخل رشته DNA الحاق میگردند. درنتیجه تشخیص DNA با استفاده از اتورادیوگرافی ممکن میگردد. غالبا نوکلئوتیدهای [α۳۲P]، به منظور لیبلگذاری DNA، در حین PCR به داخل محصول وارد میشوند. رنگهایی حساس مانند SYBR® Green II نیز میتوانند به منظور آنالیز PCR-SSCP سرد مورد استفاده قرار گیرند.
مزیت تکنولوژی فلورسنت بر رادیواکتیو، امکان استفاده از استاندارد داخلی وزن مولکولی است که در هر ستون الکتروفورز به منظور نظم دادن به دادهها به کار میرود. همچنین در این حالت، امپلیکونهای حاصل از PCR میتوانند با رنگهای مختلفی لیبل شوند. مزیت دیگر، توانایی ما در استفاده از محصولات چندین واکنش PCR در یک ستون است که ظرفیت نمونه ورودی را افزایش میدهد.
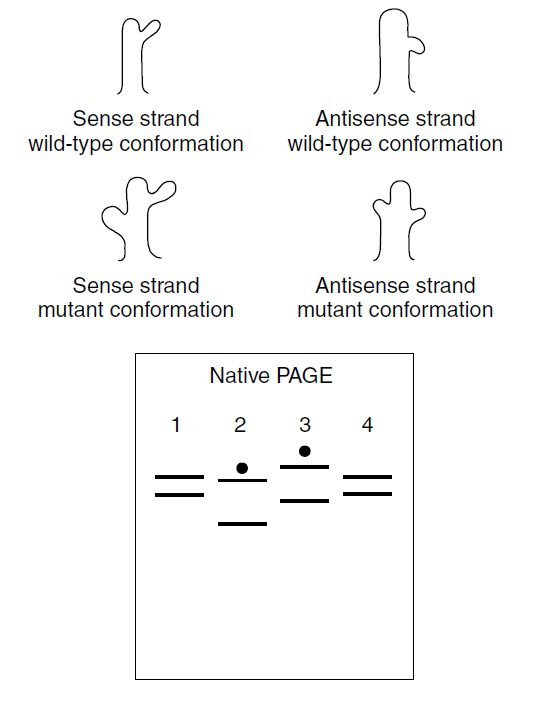
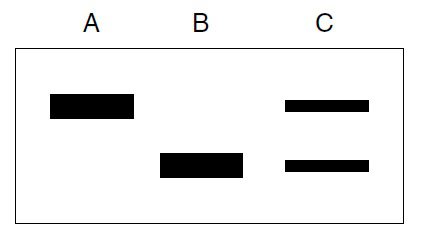
آنالیز دادههای حاصل به صورت بصری انجام میگیرد. هر توالی تکثیرشده در مرحله اول، منجر به تولید دو نوار خواهد شد که هر کدام منطبق بر یکی از رشتههای تفکیکشده مولکول دورشتهای خواهند بود. همچنین ممکن است یکی از قطعات DNA تکرشتهای، حین عبور از خلال ژل، دارای دو کانفورماسیون متفاوت شود. این امر منجر به تولید دو نوار برای آن رشته خواهد شد.

الگوهای SSCP این چنینی، در تصویر بالا نشان داده شده اند. برای ژن CD1a انسانی دو الل وجود دارد. نمونه DNA موجود در ستون A مشتق از فردی هوموزیگوت برای الل ۱ و نمونه ستون C، DNA فردی هوموزیگوت برای الل ۲ است. ستون B فردی هتروزیگوت را نشان میدهد. نوارهای منطبق بر اللهای ۱ و ۲ هر کدام با سرعتی متفاوت حرکت میکنند و یکی از رشتههای هر کدام در الکتروفورز دو کانفورماسیون متفاوت به خود میگیرد. الگوی فرد هتروزیگوت ترکیب دو الگوی هوموزیگوت است.
تکنیکهای موردنیاز در متد SSCP پیچیدگی چندانی ندارند و خود فرایند نیز به طور کلی، نسبت به سایر متدهای تشخیص جهشها و پلیمورفیسمهای DNA، باعث صرفهجویی در زمان میشود (تنها یک راند از PCR موردنیاز است). سادگی و قابل اتکا بودن این تکنیک، باعث استفاده گسترده از آن در شناسایی اللها و ژنوتیپها در بررسیهای بالینی و تحقیقاتی میشود.
SSCP به طور گستردهای در تعیین وجود جهش در ژنهایی مانند p53 و نیز در ویروسهایی مانند SIV در طول دوره عفونت، به کار میرود. SSCP همچنین در شناسایی وجود پلیمورفیسم در انواعی از ژنها استفاده میشود و در تعیین اللهای مربوط به ژنهای پیوسته که در اسپرمها وجود دارد، موثر است.
البته علیرغم کارایی بالای SSCP در تعیین تفاوتهای توالی میان دو قطعه DNA، مواردی نیز وجود دارند که در آنها تشخیص تفاوتها دشوار میباشد. در این حالت تغییر دادن پرایمرها ممکن است مفید واقع شود. همچنین ممکن است حتی در صورت وجود جایگزینی باز، تفاوتی در میزان حرکت در طول ژل مشاهده نشود. آنالیز قطعات overlapping ناحیه موردنظر، میتواند این مشکل را دوربزند.
فاکتورهای تاثیرگذار بر تحرک DNA تکرشتهای
تعدادی از پارامترها میتوانند کیفیت آنالیز PCR-SSCP آن را تحت تاثیر قرار دهند. میزان مهاجرت مولکولهای DNA تکرشتهای و تغییرات کانفورماسیون، میتوانند تحت تاثیر درصد آکریلآمید مورد استفاده، دمای الکتروفورز و قدرت یونی بافر قرار بگیرد. توصیه شده است که برای هر قطعه، شرایط مناسب قابل بازتولیدی ارائه شود.
دما، از عوامل موثر بر کانفورماسیون DNA تکرشتهای است؛ از این رو باید در حد پایداری حفظ شود. این آنالیز در اغلب اوقات با ران کردن ژل در دمای اتاق و توان پایین (~ ۱۰ W) انجام میگیرد. بهتر است که دمای اتاق تحت کنترل نگه داشته شود و در صورتی که این امکان فراهم نباشد، بهتر است که دمای الکتروفورز ثابتی تعیین گردد. در این حالت، الکتروفورز در ژل غیردناتورهکننده در اتاق سرد (۴°C) و با توان ۴۰–۵۰ W انجام میشود.
فاکتور تعیینکننده دوم، درصد آکریل آمید و میزان اتصالات متقاطع بین بیس-آریل آمیدها است. کاهش غلظت مولکولهای برقرارکننده اتصالات متقاطع، کیفیت تفکیک قطعات را افزایش خواهد داد. البته این موضوع همواره برقرار نیست و باید در مورد هر آزمایش، تست شود. افزودن سایر مواد به ماتریکس ژل میتواند تاثیری مثبت بر کیفیت تفکیک بگذارد. به عنوان مثال، افزودن گلیسرول ۲.۵–۱۰%، میزان تحرک قطعات غنی از پورین را در مقایسه با انواع غنی از پریمیدین افزایش میدهد. از علل این موضوع، فعل و انفعالات میان گروههای OH و یا تشکیل پیوندهای هیدروژنی بین مولکولی جدید میباشد. این پدیده علاوه بر گلیسرول در ساکارز، گلوکز، فرمآمید و دیمتیل سولفوکساید نیز دیده میشود. گفته میشود که گلیسرول از تاخوردگی ساختار DNA تکرشتهای میکاهد و به عناون دناتورهکنندهای ضعیف عمل میکند. تعیین غلظت بهینه گلیسرول به منظور دستیابی به بالاترین کیفیت جداسازی، باید به صورت تجربی تعیین گردد.
قدرت بافر میتواند روی کیفیت ژل تاثیر بگذارد. در برخی از موارد، کاهش قدرت یونی بافر الکتروفورز ممکن است سودمند واقع شود؛ علیرغم اینکه ظرفیت بافر را نیز کاهش میدهد. میتوان قدرت یونی ژل stacking را نیز پایین آورد که منجر به افزایش وضوح نوارها خواهد شد.
در برخی از موارد، مولکولهای تک رشتهای به یکدیگر نتصل شده و پیش از جداسازی توسط الکتروفورز و یا در حین آن، تشکیل مولکولهای دورشتهای را میدهند. این موضوع در شناسایی پلیمورفیسم تاثیرگذار است و بیشتر در مواقعی رخ میدهد که تعداد فراوانی قطعه در یک ستون الکتروفورز آنالیز شوند. برای رفع این مشکل احتمالی، نمونههای PCR باید رقیقسازی شوند و درجه رقیقسازی نیز بستگی به میزان محصولات PCR خواهد داشت.
سایز قطعات و تشخیص پلیمورفیسم
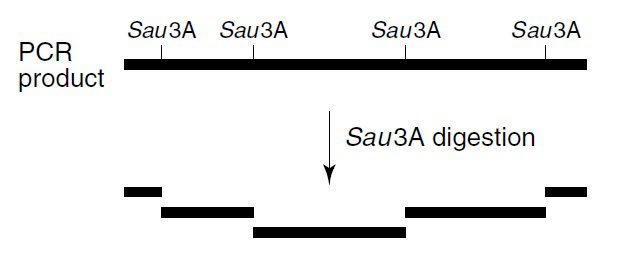
استفاده از PCR-SSCP در آنالیز جهشهای موجود در قطعات با اندازه بزرگ، دشوار است. بهترین نتایج زمانی حاصل میشوند که طول قطعات در حد ۱۵۰ جفتباز باشد و قطعات بلندتر از ۲۰۰ جفتباز نباید مورداستفاده قرار گیرند. در صورتیکه این امر غیرقابل اجتناب باشد، افزایش شانس شناسایی پلیمورفیسمها با تجزیه قطعات DNA در اثر آنزیم محدودکننده ممکن است. در این حالت، قطعات کوچکتر حاصل به صورت همزمان آنالیز میگردند.

سلام. جالب بود. من ایمیلی براتون فرستادم اگه ممکنه لطف کنید و جواب بدید.ممنون…