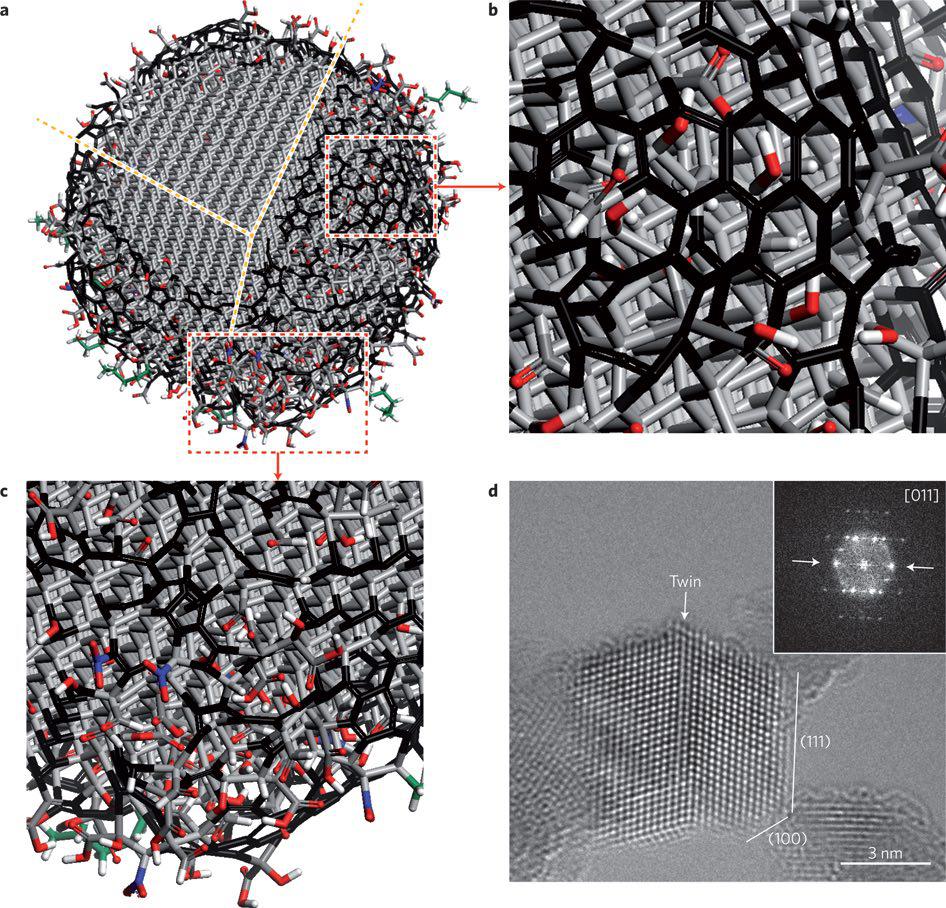
نانوالماسها (NDs) نانوذرات کربنداری هستند که استفاده از آنها در روشهای درمانی نوین در زمینههای انتقال دارو، مهندسی بافت و تصویربرداری زیستی (bioimaging)، درحال افزایش است. سطح وسیع و قابل تنظیم آنها امکان جذب سطحی فیزیکی (نیروی واندروالسی) یا اتصال کوالان ملکولهای درمانی مختلف، مانند داروها، پپتیدها و هورمونهای رشد را فراهم میکند. همچنین با تغییر سطح نانوالماسها میتوان از آنها در شیمیدرمانی و ژندرمانی استفاده کرد. علاوه بر نقش نانوالماسها به عنوان حامل ژن و دارو، نانوالماسها به طور گستردهای به عنوان ذرات نانوفیلر اسکافولدهای طبیعی و مصنوعی استفاده میشوند. نانوالماسها به عنوان ذرات تقویتکننده در بازسازی و مهندسی بافت استخوان بسیار موثر هستند.
تثبیت بیوملکولها از طریق افزودن گروههای عاملی به سطح نانوالماسها
ویژگیهای خاص سطح نانوالماسها امکان استفاده از آنها را در زمینههای مختلف از جمله انتقال داروها، مهندسی بافت و تصویربرداری زیستی، ممکن میکند. سطح نانوالماسها از نظر عملکردی تطبیقپذیر بوده و میتوانند حاوی هرنوع بیوملکولی باشد، این سطح قابل تنظیم امکان کنترل واکنشهای سطحی بین نانوذرات و بیوملکولها را فراهم میکند. این ویژگی موجب افزایش اثرگذاری و کاربردی بودن آنها به عنوان حامل در درمان استخوانها شده است. بسته به روشهای ساخت و خالصسازی نانوالماسها گروههای موجود در سطح آنها عملکردهای مختلفی خواهند داشت. برای مثال هیدروژندار کردن گروههای موجود در سطح نانوالماسها در شرایط اتمسفر بخار شیمیایی (chemical vapor deposition)، امکان تحمل سطوح هیدروژندار را به نانوالماسها میدهد. در مقابل استفاده از روشهای سنتز انفجاری (detonation synthesis)۱ موجب ایجاد یک سطح شیمیایی کاملا متغیر با گروههای عاملی هیدروکسیل، کربونیل، اتر و کربوکسیل میشود. برای اتصال پروتئینها به سطح نانوالماسها رایجترین متد تشکیل پیوند آمیدی است. گروه COOH- موجود در سطح نانوالماسها میتواند توسط تیونیل کلوراید، کربو دیایمیدها یا دیگر گروههای عاملی موجود در ساختار شیمیایی پپتید، فعال شود. گروه کربوکسیل فعال شده با گروه آمینی پپتید واکنش داده و موجب تشکیل پیوند آمیدی میشود. ترکیبات شیمیایی گوناگونی مانند فاکتورهای رشد و پپتیدها نیز میتوانند از طریق نانوالماسهای دارای گروه عاملی هیدروکسیل حمل شوند. برای ساخت پیوند اتری پایدار یکی از راهها واکنش جانشینی آلکیل کلراید در حضور سدیم هیدرید است. علاوه بر آن برای تشکیل یک گروه فعال و پایدار میتوان از مونو یا دی آلکوکسی سیلانها برای ساخت پیوند Si-OR به عنوان مرکز واکنشپذیر، استفاده کرد. این مرکز واکنشپذیر بعدا به عنوان یک جانشین نوکلئوفیل برای اتصال پروتئینها عمل خواهد کرد. یک روش جالب دیگر برای کنژوگه کردن پروتئینها استفاده از ترکیبات بنزوکینون است که به آسانی با گروههای هیدروکسیلی یا آمینی واکنش میدهند. علاوه بر سطوح دارای COOH- و OH-، نانوالماسهای دارای گروه آمینی نیز حاوی سطوح کنژوگه کننده پپتیدها و هورمونهای رشد هستند. گروه آمینی نوکلئوفیل است و میتواند با ملکولهای دارای گروه عاملی کربوکسیلی یا با آنیدریدها واکنش داده و آمیدها را بسازد.
نانوالماسهای دارای انتهای کربوکسیل و هیدروکسیل علاوه بر ارتباط کوالان با بیوملکولها، میتوانند با پلیمرها و پروتئینهای بزرگ پیوندهای فیزیکیِ هیدروژنی و یونی-دوقطبی ایجاد کنند. بدین ترتیب نانوالماسها میتوانند پپتیدها و فاکتورهای رشدی را حمل کنند که آنیوژنز یا تشکیل استخوان را القا میکنند. در واقع رایجترین روش برای تغییر سطح نانوالماسها جذب فیزیکی (نیروهای واندوالس) است؛ زیرا برخلاف پیوندهای کوالان این پیوندهای فیزیکی مستقیما و بدون تغییر شیمیایی انجام میشوند. علاوه بر آن پیوندهای کوالان میتوانند موجب کاهش فعالیت یا حتی غیرفعال شدن فاکتورهای رشد شوند. برای مثال در یک مطالعه BMP-2 آزاد شده از کمپلکس نانوالماسهای تشکیل یافته از پیوند کوالان و غیرکوالان بررسی شد، نتایج نشان داد که کمپلکسهای غیرکوالان موجب آزادسازی تدریجی و طولانی مدت BMP-2 ( بیش از ۷۰ روز) شدند درحالیکه کمپلکسهای تشکیل یافته از پیوندهای کوالان بازده کمتری داشته و موجب غیرفعال شدن BMP-2 شدند.
ساختار یک ذره واحد نانوالماس
نانوالماسها به عنوان نانوفیلر
نانوالماسها به دلیل داشتن نسبت سطح به حجم بالا و حضور گروههای عاملی فعال در سطحشان، میتوانند به عنوان نانوفیلر استفاده شوند. از این رو نانوالماسها میتوانند ویژگیهای مکانیکی پلیمرها را تقویت کرده و سبب ایجاد نانوکامپوزیتهای چندکاره برای بازسازی استخوان شوند. برای استفاده از نانوالماسها به عنوان نانوفیلر با بازده بالا، کیفیت و پراکندگی مواد ماتریکس باید به درستی انتخاب شود. در غلظتهای بالا و بدون اختصاصی کردن سطح، زمانیکه نانوالماسها با ماتریکس پلیمر ترکیب میشوند، جمع شده و تودههایی با سایز میکرو تشکیل میدهند. این توده وضعیت را بدتر کرده و نقطه ضعفی در خاصیت مکانیکی پلیمرها هستند. برای جلوگیری از این اتفاق و تقویت ویژگیهای مکانیکی پلیمرها، نانوالماسها به صورت کوالانسی اصلاح میشوند یا سطح آنها با سورفاکتانتهایی برای افزایش پراکندگی و مقاومت طولانی مدت در برابر تشکیل توده، پوشیده میشود. اگرچه پس از غلظت مشخصی از ذرات نانو، حتی با وجود نانوالماسهای اصلاح شده، خاصیت مکانیکی اسکافلدها غیر قابل افزایش است؛ زیرا گروههای عاملی سطح نانوالماسها به جای واکنش با شبکه پلیمری شروع به واکنش با همدگیر میکنند. جهت جلوگیری از این وضعیت نانوالماسهایی که به صورت شیمیایی اصلاح شدهاند باید طوری طراحی شوند که با ماتریکس پلیمر پیوندهای کوالانسی برقرار کنند. بدین ترتیب نانوکامپوزیتهای محکمی تشکیل میشوند که امکان تشکیل توده و جمع شدن را کاملا محدود میکنند.
یک استراتژی امیدوارکننده برای بازسازی استخوان بوسیلهی نانوالماسها استفاده همزمان از هر دو ویژگی آنها به عنوان نانوفیلر و یک سطح حامل است. با استفاده از نانوالماسهای حامل فاکتور رشد به همراه اسکافلدها، میتوان به پروسه درمان استخوان سرعت بخشید. مشاهده شده است اسکافلدهای کوپلیمری (پلیمر ناهمگن) که توسط کمپلکس نانوالماس/BMP-2 پوشیده شدهاند، فعالیت استئوژنیک اسکافلد را افزایش میدهند. در مطالعهای دیگر برای افزایش میزان بازسازی استخوان از نانوالماسهایی استفاده کردند که فاکتور رشد آنژیوژنیک را از اسکافلدهای بتا-تریکلسیوم فسفات آزاد میکردند.
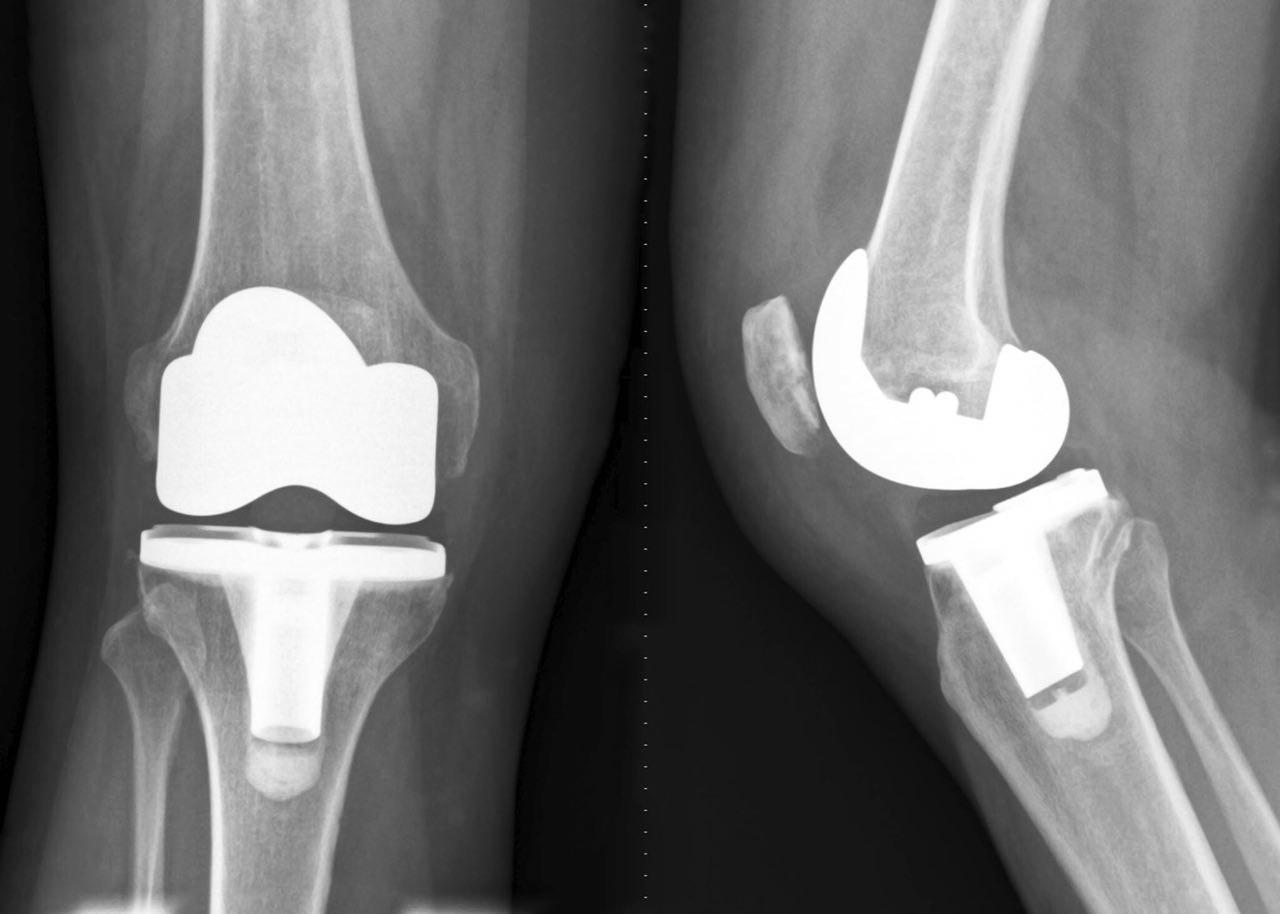
علاوه بر استفاده از نانوالماسها به عنوان حامل و یا نانوفیلر، میتوان از آنها بهعنوان پوشش بیواکتیو برای کاهش پوششهای مکانیکی و ارتقا ایمپلنتهای ارتوپدی، استفاده کرد. استفاده طولانی مدت از ایمپلنتهای جایگزین زانو و دیگر مفاصل سبب تشکیل قطعات کوچکی میشود که در مفصل تجمع مییابند و سبب ایجاد مفاصل دردناک، استئولیز و از بین رفتن ایمپلنت میشوند. پوشش نانوالماسی مقاومت ایمپلنت را افزایش میدهد و مانع از اشباع یون آهن در ایمپلنتهای کبالت-کروم-مولیبدن (CoCrMo) در زانو و هیپ و ایمپلنتهای تیتانیومی مفاصل تمپرومندیبولار، میشود.
دیگر کاربردهای بیومدیکال نانوالماسها
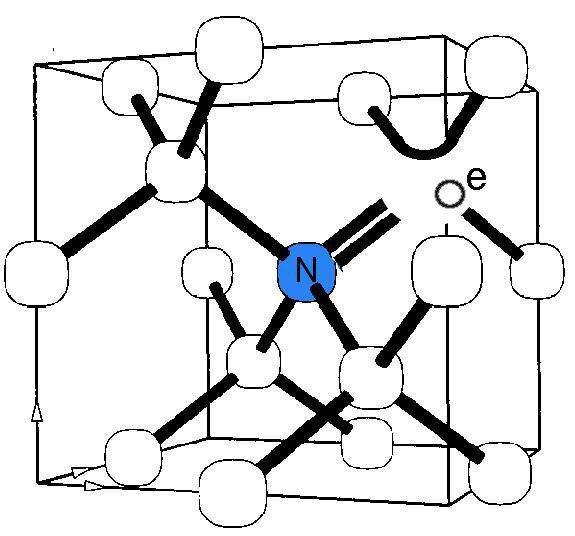
سازگاری زیستی ذاتی، وارد شدن سریع به داخل سلول و خاصیت فلورسانس نانوالماسها، آنها را گزینه مناسبی برای ردیابی سلولها ساخته است. نانوالماسها میتوانند به راحتی نیتروژندار شده و مراکز خلاء-نیتروژنی (NV) را در شبکه کریستالی خود بسازند، بنابراین به عنوان کاوشگرهای فوتولومینسنت، در آزمایشگاه و داخل بدن موجود زنده، کاربرد خواهند داشت. مراکز NV فضای خالی در شبکه کربنی نانوالماسها هستند. وجود یک اتم نیتروژن در کنار یک فضای خالی سبب ایجاد خاصیت فلورسانس بسیار کاربردی میشود. بدین ترتیب نانوالماسهای فلورسانت (FNDs) اخیرا به عنوان یک متد ۲theranostic جدید ظهور کردهاند که دارای مزایای بسیاری از جمله سازگاری زیستی، پایداری طولانی مدت و سیگنالهای فلورسنت قوی هستند. یکی از کاربردهای نانوالماسهای فلورسنت ردیابی سلولهای بنیادی است. نانوالماسهای فلورسنت به طور موفقیتآمیزی برای کنترل تمایز سلولهای بنیادی، بدون هیچگونه اثرات جانبی از جمله تغییرات مورفولوژیکی یا متابولیسمی سلول، مورد استفاده قرار گرفتهاند.
از دیگر ویژگیهای جالب نانوالماسها سطوح چندکاره و بنابراین کاربرد همزمان آنها برای اهداف درمانی و تشخیصی است. برای مثال میتوان همزمان با استفاده از خاصیت فلورسانت آنها، از ویژگی انتقال دارو نیز استفاده کرد. این استراتژی اخیرا برای کنترل آزادسازی DNA، پس از ورود به سلول، استفاده شده است. علاوه بر ویژگی فوقالعادهی تصویر برداری زیستی، نانوالماسها میتوانند به عنوان ایمپلنت در بیماریهای چشم نیز استفاده شوند. شبکیههای مصنوعی که به کمک ریزآرایههایDNA (microarrays) از الکترودهای نانوالماسها ساخته شدهاند، میتوانند تصاویری با وضوح بالا بسازند و بینایی را به بیمار برگردانند.
کامپوزیت نانوالماسهای فلورسانت در مهندسی بافت استخوان
چشمانداز آینده
علاوه بر سطوح حامل هدفمند، میتوان از دیگر ویژگیهای مفید نانوالماسها در مهندسی بافت استفاده کرد. برای پیشرفتهای بیشتر در استفاده از نانوالماسها، بویژه در بازسازی استخوان، باید در زمینه طراحی استراتژیهای جدید برای ترکیب ویژگی نانوفیلر با اصلاح سطح نانوالماسها، تمرکز کرد. نکته کلیدی در این پروسه خفیف بودن واکنشهای التهابی، عدم پس زدن بافت، آنژیوژنز کافی برای تشکیل رگهای خونی، استفاده از سلولهای بنیادی و القا آنها به تمایز استئوژنیک و ساخت ماتریکس استخوان است. اگرچه انتقال BMP-2 به تنهایی نیز استخوانسازی را افزایش میدهد اما ثابت شده است که برای تقلید پروسه طبیعی ترمیم استخوان انتقال فاکتورهای رشد یا پپتیدهای متعددی لازم است. پژوهشهای بیشتر در آینده احتمالا مطالعات گستردهای در زمینه ترتیب انتقال فاکتورهای رشد یا پپیتدها خواهد داشت تا پروسه طبیعی استخوانسازی را هرچه بهتر شبیه سازی کند.
۱. ultradispersed diamond
۲. تستهای تشخیصی که برای انتخاب موثرترین روش درمانی انجام میگیرد.
منبع: Adoption of nanodiamonds as biomedical materials for bone repair: Sayantani Basu, Settimio Pacelli, Jinxi Wang, Arghya Paul, 2017