امروزه PCR به ابزاری کارآمد و اساسی در تحقیقات زیستشناسی و تشخیص آزمایشگاهی تبدیل گشته است و به طور گستردهای در تکثیر قطعات DNAای که طولشان ترجیحا کمتر از ۱۰۰۰ جفتباز (حداکثر ۵kb) باشد، به کار میرود. تکثیر قطعات بلندتر که امروزه با Long PCR انجام میگیرد، با PCR عادی، بازده کمی دارد و معمولا برای انجام شدن آن، باید تلاش زیادی برای بهینهسازی (optimization) شرایط واکنش کرد.
مقاله مرتبط: PCR چیست؟
تا همین اواخر، روشی حساس و قابل اتکایی برای تکثیر قطعات بزرگ DNA وجود نداشت؛ تا اینکه در سال ۱۹۹۴، Barnes دستاورد مهمی را گزارش کرد. فرضیه وی این بود که میزان خطای Taq DNA پلیمراز یک مانع اساسی در انجام Long PCR است که با جفت شدن نادرست بازها، باعث کاهش دقت در فرایند تکثیر قطعات DNA میشود. توالیهایی که دارای خطا در انتهای ’۳ شان هستند، نمیتوانند به طور موثری نسخهبرداری شوند و تکثیر آنها ناتمام میماند.
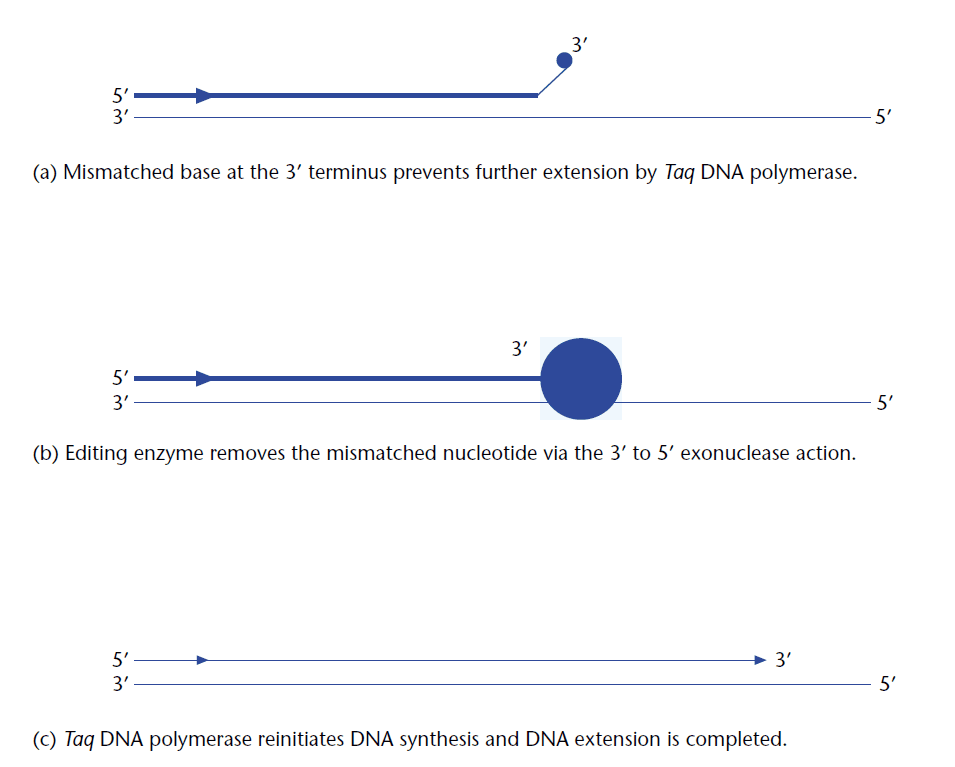
با این حال استفاده از این پلیمرازها به تنهایی برای انجام Long PCR کافی نیست. یکی از علل احتمالی این موضوع تجزیه بیش از حد پرایمرها توسط فعالیت اگزونوکلئازی است. از علل دیگر، میزان processivity آنزیمهاست. ذکر این نکته ضروری است که خاصیت تصحیح اگزونوکلئازی به تنهایی برای افزایش دقت این فرایند کافی نیست و به توانایی این آنزیم در تشخیص اتصالات نادرست بازها، طول این اتصالات و میزان شیفت بین حالات پلیمرازی و تصحیحی بستگی دارد.
روشی که Barnes برای نخستین بار آن را به کار گرفت، انجام PCR با مخلوطی از دو نوع DNA پلیمراز بود: ترکیب اصلی، یک DNA پلیمراز با کارایی بالا (highly processive) و ترکیب دوم یک DNA پلیمراز دارای خاصیت تصحیح اگزونوکلئازی در جهت ’۳ به ’۵ بود. این کار میتواند میزان جفت شدن نادرست بازها را طی سنتز DNA کاهش داده و بازده تکثیر قطعات DNA را در مرحله گسترش (extention) افزایش دهد. در نتیجه با این ترکیب آنزیمی، تکثیر DNAهای الگو با طول بیش از ۳۵kb به نحو موثری ممکن شد.
ایجاد تغییرات دیگری میتواند این فرایند را بهینه کند؛ مانند بهینهسازی بافر و نیز شرایط چرخه حرارتی. به عنوان مثال، برخلاف DNA پلیمرازهای فاقد خاصیت تصحیح اگزونوکئازی، انواع مورد استفاده در Long PCR، دقتشان در تکثیر با افزایش pH بیشتر میشود. Long PCR همچنین با افزایش سرعت چرخه حرارتی و تغییر دمای سریعتر بهتر انجام میگیرد.
همچنین باید به پلیمرازها زمان کافی برای پر کردن فاصله بین نقاط اتصال پرایمر داده شود. حداکثر فعالیت آنزیم در محدوده دمایی ۸۰-۷۵ درجه سانتیگراد میباشد. با افزایش دما، فعالیت پلیمراز به طور محسوسی کاهش مییابد. این کاهش به علت دناتوره شدن رشتههای الگوی DNA رخ میدهد. سرعت گسترش رشتهها به طور معمول ۶۰ باز در ثانیه و در دمای ۷۰°C میباشد. فعالیت آنزیم در در دماهای پایینتر نیز کاهش مییابد.
البته با اینکه باید زمان کافی برای مرحله اتصال و گسترش رشتههای DNA در نظر گرفته شود، زمان و دمای موردنیاز برای مرحله دناتوراسیون حرارتی باید در حداقل مقدار ممکن باشد. افزایش دمای این مرحله و یا مدت زمان آن اثرات سوئی بر پلیمرازها ندارد؛ بلکه به رشتههای DNA آسیب میزند. این آسیب احتمالا از طریق depurination بازهای آدنین و گوانین انجام میگیرد. طی depurination، پیوند بتا-N-گلیکوزیدی هیدرولیز و بازهای آدنین و گوانین رها میشوند. در نتیجه محلهای آپورینی (apurinic sites) ایجاد میشوند. این پدیده در مورد بازهای پورینی بیشتر از بازهای پریمیدینی رخ میدهد.
علاوه بر افزایش دما، کاهش pH نیز میتواند به depurination منجر شود. این موضوع از آن جهت در Long PCR مهم است که قطعات بزرگتر DNA بیشتر از قطعات کوچکتر در معرض دپوریناسیون قرار میگیرند. پس این فرایند به دپوریناسیون حساستر است و عوامل به وجود آورنده آن باید بیشتر مورد توجه قرار بگیرند.
پس Long PCR در واقع نسخهای از PCR استاندارد است؛ با این تفاوت که به جای اینکه تنها از Taq DNA پلیمراز استفاده کند، زنجیرهای از DNA پلیمرازهای مقاوم به حرارت را مورد استفاده قرار میدهد. این کار باعث افزایش بازده و دقت مرحله گسترش میگردد. بافرهای مختلفی در این فرایند مورد استفاده قرار میگیرند و خصوصیات چرخه حرارتی از جمله دما و زمان آن در حداقل ممکن نگه داشته شده و بیشترین توجه ممکن صرف مرحله اتصال و گسترش میگردد. این تکنیک برای تکثیر یک نوع توالی با طول ۵ تا ۴۰ کیلوباز به کار میرود.
مقاله مرتبط: تکنیک Multiplex PCR
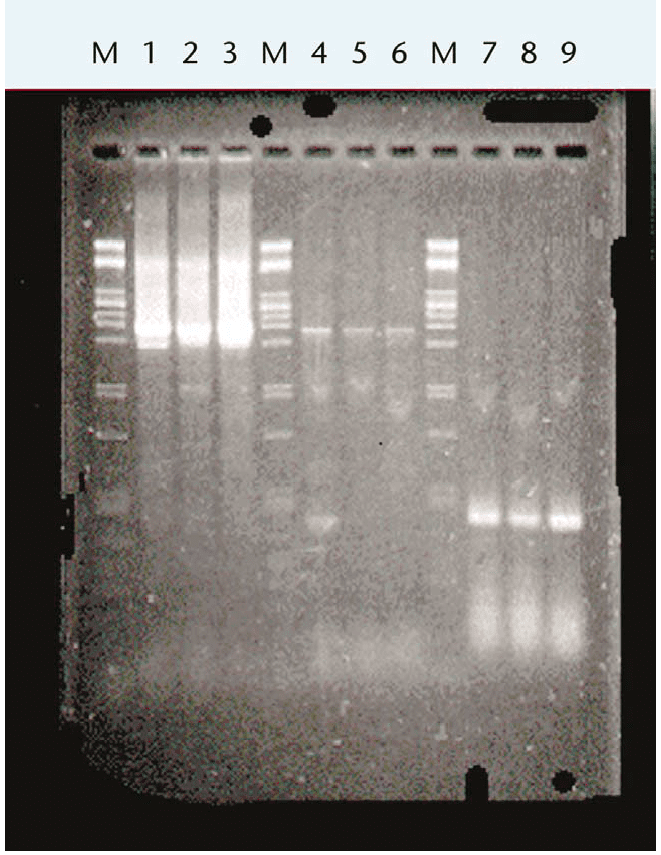
استفاده از Long PCR تنها محدود به سنتز قطعات بالای ۳kb (برخی منابع: ۵kb) نیست. ممکن است در برخی موارد سنتز قطعات کوتاهتر با PCR استاندارد ممکن نشود؛ مثلا در انجام RT-PCR روی قطعاتی به طول ۲kb روی ژن نوروفیبروماتوز (neurofibromatosis) که در تصویر زیر محصولات آن روی ژل آگارز توسط الکتروفورز جداسازی (fractionate) شدهاند. در این حالت استفاده از PCR استاندارد که تماما متکی بر Taq است، به تولید مقادیر کمی از محصول موردنظر منجر میشود. محققان مشاهده کردهاند که در شرایط یکسان و در صورت استفاده از Long PCR، مقدار محصول تولیدشده به طور قابل توجهی افزایش مییابد.
کیتهای آماده بسیاری برای سیستم Long PCR به منظور استفاده محققان وجود دارد که ارزش سرمایهگذاری دارند. البته محققان میتوانند سیستم Long PCR موردنیازشان را بسازند؛ اما استفاده از کیتها مزایایی نیز دارد. از جمله این مزایا میتوان افزایش کیفیت انجام فرایند و وجود کنترلهای مناسب برای بررسی بازده فرایند را نام برد.
کاربرد Long PCR
Long PCR برخی از نواقص standard PCR را برطرف میکند. این تکنیک نه تنها سرعت کلون شدن و توالییابی قطعات اسیدنوکلئیکی موردنظر را بیشتر میکند، بلکه میتواند باعث افزایش قدرت PCR در تکثیر توالیهای ناشناخته و یا متغیر با اندازه بزرگ بین دو پرایمر شود؛ به عنوان مثال، استفاده از Long PCR در تکثیر اینترونی با توالی ناشناخته، با استفاده از پرایمرهایی که اگزونهای مجاور را هدف قرار میدهند. از دیگر کاربردهای Long PCR، تکثیر ژنوم کامل میتوکندریایی و نیز قطعات بزرگ DNA به منظور تعیین جهشهای حذفی در بیماریهای ژنتیکی است. از جمله کاربردهای دیگر این تکینک تعیین نوع و سویه باکتری (bacterial typing) در میکروبیولوژی است.
Long PCR در ویروسشناسی بسیار پراستفاده است؛ به عنوان مثال با استفاده از این تکنیک، تکثیر کل (و یا تقریبا کل) ژنوم بسیاری از ویروسهای DNAدار مانند ویروس هپاتیت B، ویروس پاپیلومای انسانی، ویروس Varicella-zoster، human T-cell leukemia virus 1 (HTLV-1)، HIV-1، HIV-2 و … میسر شده است. استفاده از Long RT-PCR در مورد ویروسهای RNAدار نیز بسیار موفقیتآمیز بوده است.
