استفاده از مگانوکلئازها برای مهندسی ژنتیک
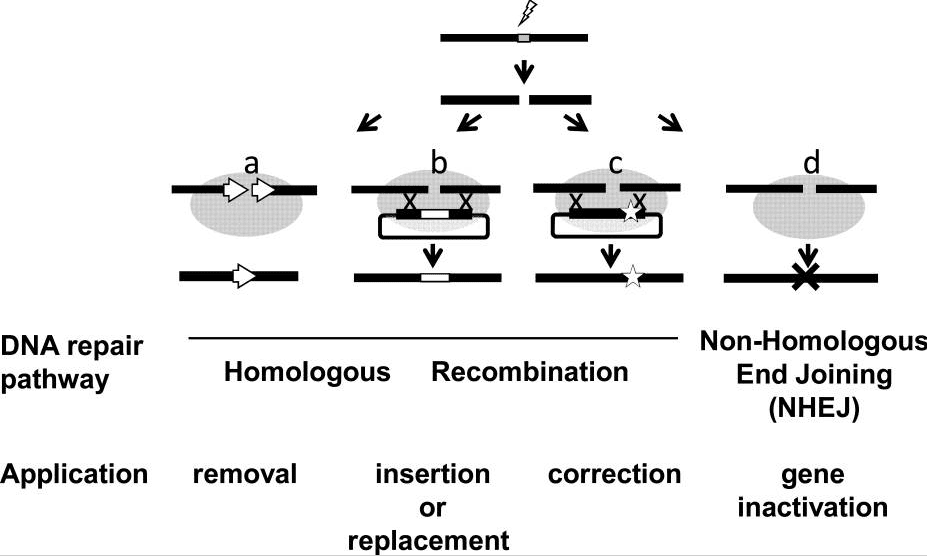
آسیب DNA یک پدیده طبیعی است که میتواند منجر به انحراف کروموزومی و یا مرگ سلولی شود. DSBها مخصوصا برای سلولها خطرناکند زیرا میتوانند باعث بازآرایی ژنوم شوند. عجیب نیست که استراتژیهای ترمیم متعددی برای تضمین یکپارچگی ژنوم بوجود آمدهاند. همانگونه که در قسمت اول ذکر شد، این فرایندها میتوانند بسته به مكانيسم درگير، مستعد خطا (NHEJ) و يا محافظه کار (HR) باشند. درک ماهیت هر مکانیسم میتواند در زمینه هدف گیری ژنها حیاتی باشد. بدیهی است از دیدگاه مهندسی ژنتیک، چالش استفاده از تشکیلات ترمیم DNA سلولی بسته به ایجاد یک DSB دقیق در ژنوم است.
I-Scel نمونه اولیه مورد استفاده در مهندسی ژنتیک است. در طبیعت، پروتئین با ایجاد یک DSB در محل خاص ژنوم HR را تحریک میکند، این فرایند هدفیابی نامیده میشود. کشف این عملکرد در مخمر Sacharomyces cerevisiae دوره جدید در هدف قرار دادن ژن را آغاز کرده است. محققین ترمیم DNA در سلولهای پستانداران، در همان ابتدا پتانسیل این ابزار را درک کردند. در دهه ۱۹۹۰ پیشگامان این کار ژن مقاوم به نئومایسن کروموزومی قطع شده بوسیله مکان شناسایی I-Scel را به عنوان گزارشگر برای نظارت بر اصلاح ژن در خطوط سلولی موش پس از معرفی یک وکتور بیان I-Scel و ماتریکس اصلاح DNA استفاده کردند.
اصلاح ژن میتواند در فرکانسهای ۳×۱۰-۵ در سلولهای ES و ۴×۱۰-۴ در سلولهای NIH3T3 شکل بگیرد. آزمایشهای بیشتر در خطوط سلولهای NIH3T3 و PCVC7 نشان دادند، با این فرایند قرار دادن ژن هدفمند نیز میتواند صورت بگیرد. درمقابل جمعیت سلولهایی که ماتریکس ترمیم DNA را در جایی که هیچ رویداد هدفمندی قابل تشخیص نبود به تنهایی دریافت کردند، فرکانسهای حوادث مورد نظر در هر سلول منتقل شده ۱.۸×۱۰-۴ تا ۴×۱۰-۴ بود. مطالعات بعدی قادر به درک فرکانس حتی بیشتر از هدف گیری ژن بود. برای مثال، Donoho وهمکارانش تقریبا ۱% نوتركیبیهای سلول های ES را بدست آوردند، درحالیکه Szczepek و همکارانش میتوانند با I-Scel (که به عنوان کنترل مثبت استفاده میشود) در ۲۹۳ سلول به ۱۰% برسند. این تجزیه و تحلیلها راه را برای تکنولوژی هدف گیری ژن ناشی از DBS که تحریک a> 1000برابر تحریک وقایع مربوط به فعالیت مگانوکلئاز را نشان میدهد را هموار میکند. از آن پس، این سیستم به طور گسترده توسط انجمن علمی پذیرفته شد و اجازه درک بهتر مکانیسمهای ترمیم DNA در انواع سلولها و شرایط آزمایشگاهی را داد.
مقالات مرتبط:
خانواده مگانوکلئاز از اندونوکلئازها ۱
با وجود این تصور که HR به طور دقیق الگو را ترمیم میکند، در موارد متعدد حوادث هدف گیری ناقص گزارش شده است، پیامدهای آن برای برنامههای درمانی قابل توجه است. این نتایج ضرورت درک پیچیدگیهای HR را برجسته کرده است. به عنوان مثال،مشخص شد که HR میتواند در انتهای تقاطع DNA اتفاق بیفتد در حالیکه از طرف دیگر نوترکیبی همولوگ اتفاق بیفتد. به طور مشابه، امکان اصلاح (یا معرفی) جهش نقطهای با فاصله از DSB مورد مطالعه قرار گرفت. مشخص شد که مسیر بازسازی شکست دو رشتهای (DSBR) میتواند منجر به تغییر توالی مجاور شکست DNA شود، درحالیکه با افزایش فاصله از DSB , بازده تبدیل کاهش میابد. Elliot و همكارانش کاهش شدید بهرهوری تبدیل را مشاهده کردند: یک پلی مورفیسم در فاصله نزدیک به ۱۰۰bp از DSB تنها در ۱۳-۱۶% حوادث ترمیمی اصلاح شد، و با ۴۰۰bp اصلاح به ۳% کاهش یافت. در همین حال، Donoho و همکارانش گزارش وسعت تبدیل درازتر با ۱۳% اصلاح با فاصله ۴۰۰۰bp از DSB را دادند. در نهایت آزمایشات در خطوط سلولی انسانی ۲۹۳Hنشان داد که جهشی با فاصله ۲۶۵bp از DSB میتواند به طور موثری اصلاح شود. علیرغم اختلافات ظاهری در این نتایج که احتمالا ناشی از اختلافات طراحی تجربی است، روند تبدیل بهینه در عملکرد نسبت به فاصله، به عنوان یک نکته مهم در هر روش هدف گیری ژن در نظر گرفته میشود.
در نهایت، مطالعات انجام شده با سیستم I-Scel برای رمزگشایی سازوکار سلولی DSBR، پایه و اساس تمام راهکارهای اصلی که امروز برای اهداف مهندسی ژنتیک طراحی شدهاند، شکل داده است. اصلاح ژن، وارد کردن ژن و غیرفعالسازی ژن توسط مکانیسم NHEJ و همچنین حذف توالی DNA با سنجش دوام تک رشتهی (SSA) بین تکرارهای درست، همه در طول مطالعات اخیر مورد توجه قرار گرفتهاند. این روش آخر به نظر بسیار کارآمد میآید زیرا I-Scel قادر به ایجاد نوترکیبی بین تکرارهای درست یا معکوس با فرکانس ۱-۱۰ مورد در سلولهای منتقل شده بین پستانداران است. فرکانس مشابهی در بدن پس از تزریق وریدی آدنوویروس بیان کننده I-Scel به موش ترانسژنیک دارای ژن گزارشگر بر استس LacZ مشاهده شد: تا ۱.۳% هپاتوسیتها، رویداد نوترکیبی را نشان دادند. گرچه رشد خطوط سلولی برای تولید پروتئین، تمرکز بر موضوع این بررسی را نشان نمیدهد، لازم به ذکر است که ژنهایی که توسط نوکلئوتید ناشی از مکانوکلئاز وارد شدهاند سطوح بیان قابل تجدید بین کلونهای هدفمند سلولی را نشان میدهد.