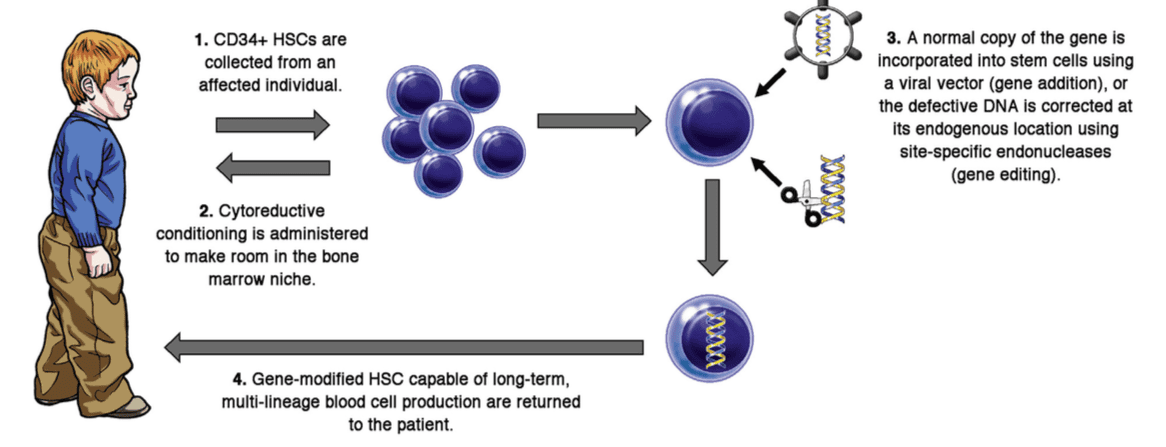
پیشرفت در ژن درمانی وابسته به پیشرفت سه مجموعه است: وکتورهای بهتر، متدهای بهتر برای عملآوری HSC و شرایط بهتر رژیمی. در اواسط دهه ۱۹۸۰ رتروویروس موشی تولید شد که میتوانست ژن بیگانه را به سلول پستاندار انتقال دهد. مطالعات بسیاری توانایی آنها برای ارائه ژنشان به HSCهای موش را نشان داد، که میتوانست پیوند زده شود و باعث رشد سلولهای خونی رده میلوئیدی و لنفوئیدی حامل ژنهای جدید و بیانشان شود. تلاشهای اولیه برای استفاده از این وکتورها در HSCهای انسانی تاثیر کمتری داشت، اما پیشرفتهایی که در زمینه متدهای تولید وکتور در تیترهای بالاتر بود، همچنین تغییراتی در پروتئین انولوپ ویروس که برای پوشش ویروس استفاده میشد و آن را هدف رسپتور سلوب قرار میداد، باعث ایجاد سطوح بالاتر انتقال ژن به HSC انسانی شد.
همزمان فاکتورهای رشد خونساز جدید شناسایی شدند که میتوانستند فعالیت را تحریک کنند و باعث تکثیر HSCهای انسانی شوند. درنتیجه توانایی آنها برای برداشت وکتورها افزایش یافت. علاوه براین، متوجه شدند داشتن پروتئین ماتریکس خارج سلولی، مانند فیبرونکتین و یا قطعات نوترکیب خاص، هم میتواند برداشت ویروس توسط سلول بنیادی را افزایش دهد و از فعالیت آنها طی دو الی چهار روزی که در محیط کشت خارجیاند محافظت کند. در نهایت استفاده از دوزهای نسبتا پایین دارو busulfan میلوتوکسیک با ایجاد فضا در مغز استخوان، باعث پیوند دوباره HSCهای اصلاح شدهی در خارج از بدن میشود.
با کنار هم قرار دادن این پیشرفتهادر اواخر دهه ۱۹۹۰، محققان بسیاری با استفاده از ژن درمانی HSC مغز استخوان اتولوگ بیمار، موفق به ارائه خدمات به بیماران دارای نقص ADA-SCID و X-SCID شدند.تحقیقات مشابهی برای WAS و X-CGD در ادامه انجام شده و منجر به بازسازی عملکرد سلولهای ایمنی معیوب شدهاست.
با این حال عوارض شدید و ایجاد لوسمی چند سال بعد از ژن درمانی، در این بیماران رخ داده است.
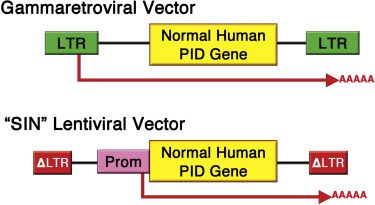
از وکتورهای رتروویرال برای وارد کردن تصادفی آنها به DNA کروموزومی سلول بنیادی هدف استفاده میشود. انتقال عناصر تقویت کننده قوی بیان ژنهای درمانی میتواند بیان پروتوانکوژنهای سلولی مجاور را فعال کند. (LMO2 و MECOM) این پدیده در نهایت منجر به رشد کلونال سلولهای تغییریافته میشود. اگرچه بیشتر بیماران از نظر لوسمی درمان موفقیت آمزی داشتند اما این میزان توکسیک بودن غیرقابل قبول بود.
خوشبختانه راه حل در دسترس بود. نسل جدیدی از وکتورهای انتقال ژن، از از کلاس لنتیویروس رتروویروسها استخراج شد که مشخصات ایمنی بهتری داشت. وکتورهای لنتیویرال (LVs) میتوانستند به روشی تولید شوند که عناصر تقویت کننده خودشان را غیرفعال کنند (اصطلاحا وکتورهای SIN) مطالعات پیش بالینی در سلولهای موش نشان دادند SIN LVs، فعالیت دگرگونی قابل تشخیصی نشان ندادند، درحالیکه وکتورهای گاما رتروویرال مشخص بودند. بیشتر آزمایشات امروزه از SIN LVs استفاده میکنند و آزمایشهای درحال انجام برای ADA-SCID ، X-SCID، WAS و X-CGD بازسازیهای ایمنی موثری را نشان میدهند. با اینکه از سال ۲۰۰۹بیش از ۱۰۰ بیمار درمان شدند، مشکلاتی مرتبط با وکتور در آنها دیده نشده است.