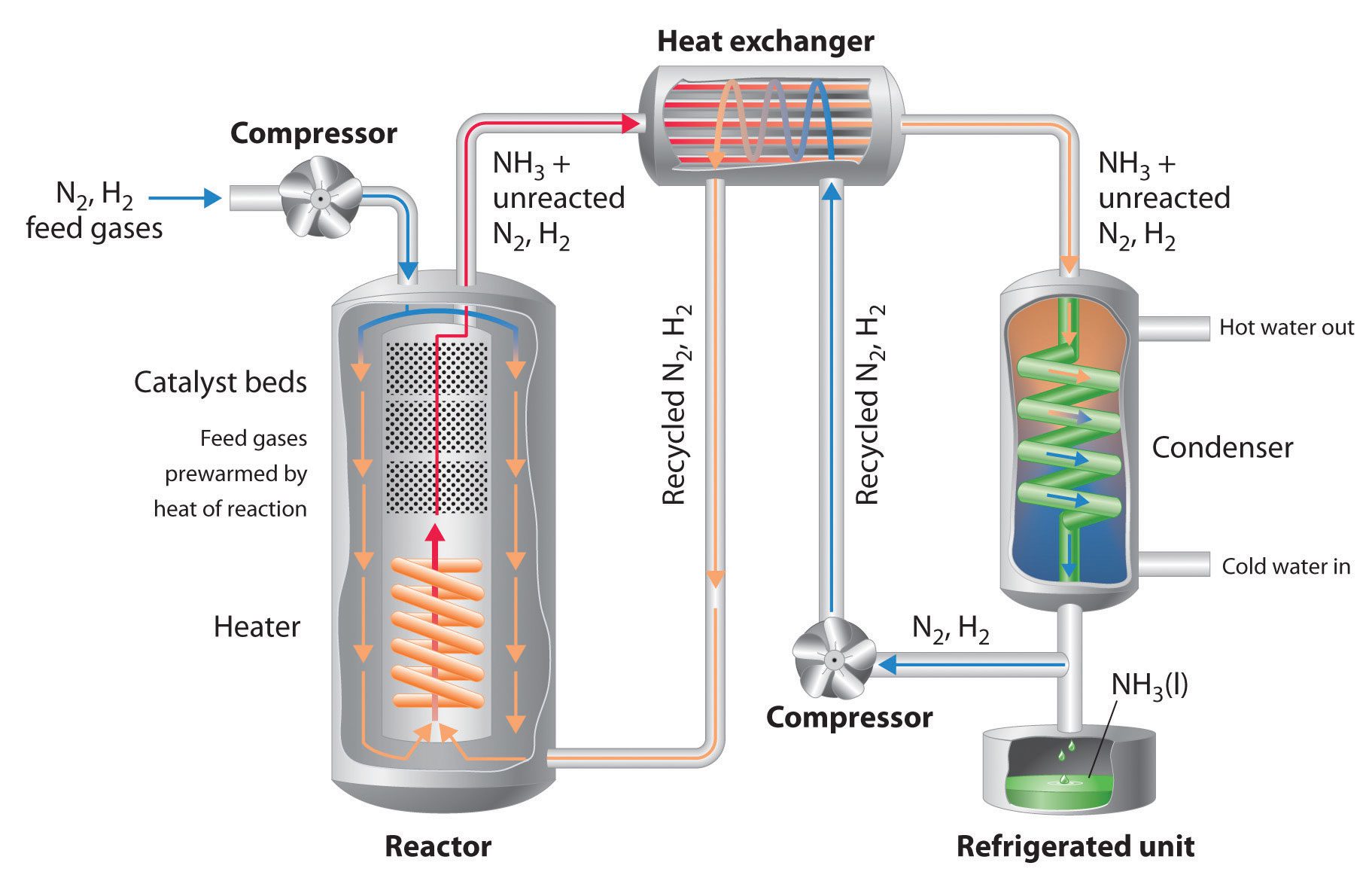
امروزه فرایند هابر که فرایند هابر_بوش نیز نامیده میشود، روش صنعتی اصلی برای تولید آمونیاک است. طی این فرآیند، با استفاده از یک کاتالیزور فلزی در دما و فشار بالا، نیتروژن اتمی (N2) طی واکنشی با هیدروژن به آمونیاک (NH3) تبدیل میشود.
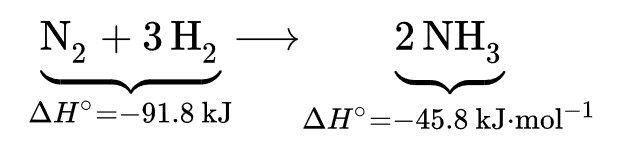
قبل از توسعهی فرایند هابر، تولید آمونیاک در مقیاس صنعتی بسیار دشوار بود و روشهای ابتدایی مانند فرایند Birkeland Eyde و Frank-Caro بسیار ناکارآمد بودند.
امروزه گرچه فرآیند هابر عمدتاً برای تولید کود استفاده میشود، اما طی جنگ جهانی اول از آن برای تولید مواد منفجره استفاده شد.
تاریخچه
در قرن نوزدهم تقاضا برای نیترات و آمونیاک برای استفاده به عنوان کود و مواد اولیهی صنعتی به طور پیوسته افزایش یافت. منبع اصلی این مواد، معادن سنگ نیتروژن بود. در ابتدای قرن بیستم پیشبینی میشد که این ذخایر پاسخگوی نیازهای آینده نخواهد بود بنابراین تحقیق در زمینهی یافتن منابع بالقوهی آمونیاک اهمیت زیادی پیدا کرد. منبع آشکار، نیتروژن اتمسفر (N2) است که تقریبا ۸۰ درصد از هوا را تشکیل میدهد، با این حال N2 فوق العاده پایدار است و به آسانی با سایر مواد شیمیایی واکنش نشان نمیدهد. تبدیل N2 به آمونیاک چالشی برای شیمیدانان در سراسر جهان است.
در سال ۱۹۱۳ آمونیاک برای اولین بار با استفاده از فرایند هابر در مقیاس صنعتی در آلمان تولید شد و در سال بعد به ۲۰ تن در روز رسید. در طول جنگ جهانی اول، تولید مهمات نیازمند مقدار زیادی نیترات بود. متفقین به مقادیر زیاد نیترات سدیم در شیلی که تحت کنترل شرکتهای بریتانیایی بود دسترسی داشتند. آلمان چنین منابعی نداشت، به همین دلیل فرایند هابر برای جنگ نظامی آلمان ضروری بود. آمونیاک مصنوعی تولید شده از فرآیند هابر برای تولید اسید نیتریک که پیشمادهی برای نیترات استفاده شده در مواد منفجره است استفاده شد.
