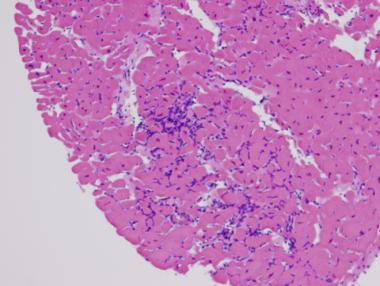
میوکاردیت بیماری عفونی میوکارد با گسترهی وسیعی از مشخصات بالینی است. این بیماری هم میتواند نامحسوس و هم ویرانگر باشد. تصویر زیر لنفوسیتهای متعدد را در ارتباط با آسیب میوسیت در این بیماری نشان میدهد.
رنگآمیزی هماتوکسیلین و ائوزین؛ تصویر نشان دهندهی لنفوسیتهای متعدد در ارتباط با آسیب میوسیت است. (امتیاز تصویر: دکتر Donald Weilbaecher)
علائم و نشانهها
میوکاردیت معمولاً در فرد سالم دیده شده و میتواند به آریتمی و نارسایی قلبی سریع پیشرونده (و اغلب کشنده) منتهی شود. در شرححال بیماران مبتلا به میوکاردیت، حملهی حاد نارسایی قلبی دیده میشود؛ اما در سابقهی این افراد هیچ اختلال عملکرد قلبی زمینهای وجود نداشته یا ریسک قلبی برایشان پایین است. بیماران مبتلا به میوکاردیت معمولاً با علائم و نشانههای زیر مراجعه میکنند:
- علائم خفیف درد سینه (در پریکاردیت همزمان)، تب، تعریق، لرز، دیسپنه
- در میوکاردیت ویروسی: سابقهی اخیر (کمتر از یک تا دو هفته) علائم شبهآنفولانزا شامل تب، آرترالژی، ضعف، فارنژیت، التهاب لوزه یا عفونت راههای تنفسی فوقانی.
- تپش قلب، سنکوپ یا مرگ ناگهانی قلبی در اثر آریتمی بطنی زمینهای یا بلوک دهلیزی-بطنی (خصوصاً در میوکاردیت ژانت سل)
- نارسایی قلبی
برای جزئیات بیشتر به بخش مشاهدات بالینی مراجعه کنید.
تشخیص
تشخیص میوکاردیت حاد معمولاً به صورت احتمالی و بر اساس دموگرافیکهای بیماران و آموزههای بالینی است. از آن جا که بسیاری از موارد میوکاردیت معمولاً از نظر بالینی بارز نیستند، شک و گمان زیادی برای تشخیص لازم است. بیماران مبتلا به میوکاردیت معمولاً با علائم و نشانههای حملهی حاد نارسایی قلبی (مانند تاکیکاردی، گالوپ، رگورژیتاسیون میترال، ادم) مراجعه میکنند. در بیمارانی که همزمان به پریکاردیت نیز مبتلا باشند، فریکشن راب پریکاردی نیز شنیده میشود. یافتههای اختصاصی در موارد خاص نیز شامل موارد زیر میباشند:
- میوکاردیت سارکوئید: لنفادنوپاتی همراه با آریتمی و درگیری سارکوئید در سایر ارگانها (تا ۷۰%)
- تب روماتیسمی حاد: معمولاً در ۹۰-۵۰% موارد، قلب را درگیر میکند. علائم مرتبط شامل اریتم مارژیناتوم، پلیآرترالژی، کره، ندول زیر جلدی است (کرایتریای جونز).
- میوکاردیت ازدیاد حساسیتی یا ائوزینوفیلیک: راش ماکولولوپاپولر خارشدار و سابقهی مصرف داروی غیرمجاز
- میوکاردیت ژانت سل: تاکیکاردی بطنی پایدار در نارسایی قلبی سریعپیشرونده
- کاردیومیوپاتی پری پارتوم- نارسایی قلبی که در ماه آخر بارداری یا تا ۵ ماه پس از زایمان تظاهر مییابد.
آزمایشها
مطالعات آزمایشگاهی که برای بررسی میوکاردیت مشکوک مورد استفاده قرار میگیرند، شامل موارد زیر هستند:
- شمارش کامل سلولهای خونی (CBC)
- سرعت رسوب اریتروسیت (و سایر واکنشدهندههای فاز حاد مانند پروتئین واکنشگر C)
- غربالگری روماتولوژیک
- سطح آنزیمهای قلبی (مانند کراتین کیناز یا تروپونینهای قلبی)
- تیتر آنتیبادیهای ویروسی سرم
- تست ژنوم ویروسی در بیوپسی اندومیوکاردی
- الکتروکاردیوگرافی
تصویربرداری
تصویربرداریهای زیر برای ارزیابی بیماران مشکوک به میوکاردیت معمولاً صورت میگیرد:
- اکوکاردیوگرافی: برای رد سایر علل نارسایی قلبی (مانند آملوئیدوز یا علل مادرزادی و دریچهای) و بررسی میزان اختلال عملکرد قلبی
- سینتی گرافی آنتیمیوزین: برای شناسایی التهاب میوکارد
- آنژیوگرافی قلبی: برای رد ایکسمی کرونری از میان علل نارسایی قلبی جدیدالوقوع
- تصویربرداری تشدید مغناطیسی پیشرفته با گادولینیوم: برای بررسی میزان التهاب و ادم سلولی؛ غیراختصاصی
پروسهها
بیوپسی اندومیوکارد، روش استاندارد تشخیص میوکاردیت است. اگرچه استفادهی روتین از این روش در تأیید تشخیص میوکاردیت به ندرت از نظر بالینی کمککننده است؛ چرا که تشخیص بافتشناسی مگر در موارد مشکوک به میوکاردیت ژانت سل، تأثیر کمی بر استراتژیهای درمانی دارد. گایدلاین نارسایی قلبی اتحادیهی نارسایی قلبی آمریکا در سال ۲۰۱۰، انجام بیوپسی اندومیوکارد را برای بیماران با زوال حاد عملکرد قلبی در شرایط عدم پاسخ به درمان و با علت ناشناخته توصیه میکند.
برای جزئیات بیشتر به بخش روند تشخیصی مراجعه کنید.
درمان
در حالت کلی، هدف از درمان میوکاردیت حاد یا مزمن، کاهش احتقان و بهبود همودینامیک قلبی در نارسایی قلبی است. در این ضمن، از درمانهای حمایتی نیز به امید افزایش مدت بقا کمک گرفته میشود. درمان نارسایی قلبی نیز صرف نظر از علت زمینهای، رژیم درمانی یکسانی است که شامل مهارکنندهها و بلوکرهای بتاآدرنژیک میباشد.
دارودرمانی
داروهای مورداستفاده در درمان میوکاردیت شامل موارد زیر هستند:
- وازودیلاتورها (مانند نیتروگلیسیرین و سدیم نیتروپروساید)
- مهارکنندههای آنزیم مبدل آنژیوتانسین (مانند انالاپریل)
- دیورتیکها (همچون فروزماید)
داروهای ضدانعقاد نیز ممکن است همچون موارد ناشی از سایر علل نارسایی قلبی، در جهت پیشگیری توصیه شوند؛ اگرچه شواهد قطعی در این زمینه در دسترس نیست.
آنتیآریتمیها میتوانند با احتیاط مصرف شوند؛ اگرچه بیشتر این داروها اثرات اینوتروپ منفی دارند که میتوانند نارسایی قلبی را تشدید کنند (آریتمیهای فوق بطنی باید از نظر الکتریکی معکوس شوند). اکوتپی بطنی درجه بالا و تاکیآریتمی بطنی باید محتاطانه با بتابلوکرها و داروهای آنتیآریتمی درمان شوند.
داروهای اینوتروپیک (مانند دوبوتامین و میلرینون) ممکن است در موارد حملهی شدید نیاز شوند؛ اگرچه این داروها بسیار آریتموژن هستند. درمان درازمدت نیز از همان رژیم دارویی پیروی میکند که شامل مهارکنندههای آنزیم مبدل آنژیوتانسین، بتابلوکرها و آنتاگونیستهای گیرندهی آلدوسترون است. اگرچه در برخی موارد به علت ناپایداری همودینامیکی نمیتوان از برخی از این داروها استفاده کرد.
درمان غیردارویی
درمانهای حمایتی در بیماران مبتلا به میوکاردیت شامل موارد زیر هستند:
- مانیتورینگ قلبی و همودینامیکی
- تجویز اکسیژن مکمل
- مایع درمانی
جراحی
مداخلات جراحی در میوکاردیت شامل موارد زیر هستند:
- پیسِ ترانس ونوس موقت برای بلوک کامل قلبی
- پیوند قلب
- در موارد شدید: دستگاه کمکی بطن یا دستگاه کمکی زیرجلدی؛ دستگاه کمکی بطن چپ (LVADs) و اکسیژناسیون غشایی برون پیکری۱
برای جزئیات بیشتر به بخش درمان و درمان دارویی مراجعه کنید.
۱-extracorporeal membrane oxygenation
توضیح بیماری
میوکاردیت بیماری عفونی میوکارد قلب با گسترهی وسیعی از مشخصات بالینی است. این بیماری هم میتواند نامحسوس و هم ویرانگر باشد. میوکاردیت به طور اختصاصی به صورت “ارتشاح التهابی میوکارد همراه با نکروز و دژنراسیون میوسیتهای مجاور” تعریف میشود. میوکاردیت معمولاً در فرد سالم دیده شده و میتواند به آریتمی و نارسایی قلبی سریع پیشرونده (و اغلب کشنده) منتهی شود. در اصطلاح بالینی، میوکاردیت معادل کاردیومیوپاتی التهابی است. این بیماری بر اساس کرایتریاهای بافتشناسی، ایمونولوژیک و ایمونوشیمیایی تشخیص داده میشود. طبقهبندی Lieberman برای این بیماری به شرح زیر است:
- میوکاردیت فولمینانت: با مرحلهی مقدماتی یا پرودروم ویروسی؛ شروع متمایز بیماری به صورت سازش شدید قلبی عروقی با اختلال عملکرد بطنی و میوکاردیت فعال چندکانونی که یا به صورت خودبخود برطرف شده یا به مرگ منجر میشود.
- میوکاردیت حاد: شروع نه چندان متمایز بیماری با اختلال عملکرد بطنی تأیید شده که ممکن است به سمت کاردیومیوپاتی دیلاته پیشرفت کند.
- میوکاردیت مزمن فعال: شروع نه چندان متمایز بیماری با عودهای بالینی و بافتشناسی؛ بروز اختلال عملکرد بطنی در ارتباط با تغییرات التهابی مزمن (شامل ژانت سل)
- میوکاردیت مزمن پایدار: شروع نه چندان متمایز بیماری؛ ارتشاح پایدار هیستولوژیک با نکروز کانونی میوسیت اما بدون اختلال عملکرد بطنی (علیرغم وجود علائمی چون درد سینه و تپش قلب)
این اصطلاحات همچنان برای توصیف مشاهدات بالینی و پیشرفت میوکاردیت خصوصاً در غیاب ارزیابی مداوم هیستولوژیک استفاده میشوند.
آموزش بیمار
بیماران باید از دانستههای فعلی موجود در مورد ماهیت بیماری و نقط ضعف و قوت تستهای متفاوت تشخیصی و گزینههای درمانی آگاهی یابند.
اتیولوژی
میوکاردیت احتمال میرود در اثر ارگانیسمهای عفونی متنوع، اختلالات خودایمنی و عوامل اگزوژن در همراهی با استعداد ژنتیکی و محیطی رخ میدهد. در بیشتر موارد بیماری، فرض بر علیت مسیری مشترک در این زمینه است؛ مسیری وابسته به میزبان و همچنین وابسته به آسیب خودایمنی. اگرچه اثرات سیتوتوکسیک مستقیم ناشی از عامل مسبب بیماری و آسیبهای ناشی از بیان سیتوکین در میوکارد نیز در اتیولوژی میوکاردیت احتمالاً نقش دارند. آسیب در این بیماری طی مکانیسمهای زیر رخ میدهد:
- اثر سیتوتوکسیک مستقیم عامل مسبب
- پاسخ ایمنی ثانویه که میتواند در اثر عامل مسبب بیماری باشد.
- بیان سیتوکین در میوکارد (همچون فاکتور نکروزدهندهی تومور یا TNF-alpha و نیتریک اکسید سنتاز)
- القای نابجای آپوپتوز
آسیب میوکارد شامل ۲ فاز اصلی زیر است:
- فاز حاد (۲ هفتهی اول)- تخریب میوکارد پیامد مستقیم عامل آسیبزاست که با سیتوتوکسیتهی وابسته به سلول و آزادسازی سیتوکین، موجب آسیب میوکارد و اختلال در عملکرد آن میشود. شناسایی عامل مسبب در این مرحله به ندرت صورت میگیرد.
- فاز مزمن (بیش از ۲ هفته)- تداوم تخریب میوسیتها در واقع ماهیتی خودایمن دارد که با بیان غیرطبیعی آنتیژن لکوسیت انسانی (HLA) در میوسیتها (و البته در میوکاردیت ویروسی، با ماندگاری ژنوم ویروسی در میوکارد) همراه است.
میوکاردیت ویروسی
در میوکاردیت ویروسی، ایزولههای ویروسی مختلف در ویرولانس و تروپیسم بافتی تفاوت دارند. به عنوان مثال، در مورد کوکساکی ویروس A9، میوکاردیت خودمحدودشونده است؛ حال آن که کوکساکی ویروس B3 باعث میوکاردیت شدید با میزان بالای مورتالیته میگردد. در این ارتباط، القای گیرندهی کوکساکی آدنوویروس (CAR) و پروتئین منحرف کنندهی مسیر کمپلمان به نام DAF۱ یا CD55، احتمالاً انتشار مؤثر ژنوم ویروسی را موجب میشود. تکثیر ویروسی نیز احتمالاً موجب اختلال بیشتر در متابولیسم و اختلال در التهاب و پاسخ به آن میگردد. وازواسپاسم ناشی از عفونت ویروسی سلول اندوتلیال همچنین ممکن است باعث آسیب بیشتر شود. شواهد جدید در رابطه با اختلال عملکرد دیستروفین در اثر بیان پروتئاز ۲A انتروویروسی، مکانیسم پاتوژنیک منحصر به فرد دیگری را مطرح میکنند.
در مقابل، برخی ویروسها مانند پاروویروس B19 احتمالاً بیشتر باعث ضایعات دورمویرگی گشته و بیش از تخریب مستقیم میوسیت، موجب اختلال عملکرد دیاستولی میگردند؛ صرف نظر از این که ماندگاری و تداوم ویروسی، محرک ضروری برای خودایمنی و سایر پاسخهای التهابی است.
۱- decay accelerating factor- فاکتور تسریعکنندهی تخریب
میوکاردیت ایدیوپاتیک
تقریباً در ۵۰% موارد، میوکاردیت ایدیوپاتیک شناخته میشود؛ چنان که طبق گزارش محقق Klugman و همکارانش از مطالعهشان، ۸۲% موارد میوکاردیت کودکان ایدیوپاتیک شناخته شده بود؛ ۳% موارد مورد مطالعه، اتیولوژی باکتریایی یا ویروسی شناخته شده داشتند و ۶% موارد نیز مرتبط با بیماریهای دیگری بودند.
در موارد ایدیوپاتیک، اغلب علیرغم مطالعات ژنومی و ایمونوهیستوشیمیایی پیچیده، اتیولوژی ویروسی مشکوک اما ثابت نشده وجود دارد. در مطالعه بر بیماران مبتلا به کاردیومیوپاتی دیلاته ایدیوپاتیک، شواهدی مبنی بر وجود ذرات ویروسی در نمونههای بیوپسی اندومیوکاردیِ قریب به دو سوم بیماران، وجود داشت.
علل بیماری
علل میوکاردیت شامل موارد زیر است:
- ویروسی- انتروویروس، کوکساکیB ، آدنوویروس، آنفلوانزا، سیتومگالوویروس، پولیومیلیت، اپشتین-بار ویروس، HIV-1، هپاتیت ویروسی، اوریون، روبلا، واریسلا، واریولا/واکسینیا، آربوویروس، ویروس سنسیشیال تنفسی، ویروس هرپس سیمپلکس، ویروس تب زرد، هاری و پاروویروس.
- ریکتزیایی- تیفوس اسکراب یا بوتهزار، تب منقوط کوههای راکی و تب .Q
- باکتریایی- دیفتری، سل، استرپتوکوک، مننگوکوک، بروسلوز، کلستریدیا، استافیلوکوک، میلوئیدوز، مایکوپلاسما پنومونیه و پسیتاکوز.
- اسپیروکتی- سیفلیس، لپتواسپیروز/ بیماری ویل، بورلیا/ تب راجعه و بیماری لایم.
- قارچی- کاندیدیازیس، آسپرژیلوزیس، کریپتوکوکوزیس، هیستوپلاسموزیس، بلاستومایکوزیس، کوکسیدیودومایکوزیس و موکورمایکوزیس.
- پروتوزوآیی- بیماری شاگاس، توکسوپلاسموزیس، تریپانوزومیازیس، مالاریا، لشمانیازیس، بالانتیدیازیس و سارکوسپوریدیوزیس.
- کرمی- تریشینوزیس، اکینوکوکوزیس، شیستوزومیازیس، هتروفیازیس، سیستی سرکوزیس، لارو مهاجر احشایی و فیلاریازیس.
- گزش/ نیش- سم غقرب، سم مار، سم بیوه سیاه، سم زنبور و فلج کنهای.
- مواد مخدر (معمولاً موجب میوکارد ازدیاد حساسیتی میشوند)
- داروهای شیمیدرمانی- دوکسوروبیسین و آنتراسیکلینها، استرپتومایسین، سیکلوفسفامید، اینترلوکین -۲، آنتیبادی گیرندهی anti-HER-2/ هرسپتین.
- آنتیبیوتیکها- پنیسیلین، کلرامفنیکل، سولفونامیدها.
- داروهای ضد افزایش فشار خون- متیل دوپا، اسپیرونولاکتون.
- داروهای ضدتشنج- فنیتوئین، کاربامازپین.
- آمفتامینها، کوکائین و کاتکولآمینها.
- مواد شیمیایی- هیدروکربنها، کربن مونوکسید، سرب، فسفر، جیوه و کبالت.
- عوامل فیزیکی (اشعه، گرمازدگی، هیپوترمی)
- تب روماتیسمی حاد
- بیماریهای التهابی سیستمیک- میوکاردیت سلول ژانت، سارکوئیدوزیس، بیماری کاوازاکی، بیماری کرون، سیستمیک لوپوس اریتماتو، کولیت التهابی، گرانولوماتوز وگنر، تیروتوکسیکوز، اسکلرودرمی و آرتریت روماتوئید.
- کاردیومیوپاتی پری پارتوم
- رد پیوند سلولی
اپیدمیولوژی
بروز بیماری در ایالات متحده
با توجه به واریاسیون گسترده در تظاهرات بالینی این بیماری، تعیین فراوانی میوکاردیت کار دشواری است. بروز میوکاردیت معمولاً بین ۱ تا ۱۰ مورد در هر ۱۰۰ هزار نفر تخمین زده میشود. میزان بیوپسی مثبتِ بطن راست در بیماران مشکوک به میوکاردیت، بسیار متغیر است (با محدودهی ۸۰-۰%). بر اساس تخمینها، در ۵-۱% بیماران مبتلا به عفونتهای حاد ویروسی، میوکارد درگیر میشود.
بروز بیماری در سطح جهانی
طبق مطالعهای مبتنی بر جمعیت در فنلاند، بررسی بیش از ۶۷۰ هزار مرد جوان سالم و نظامی نشان داد ۹۸ مورد مبتلا به میوکاردیتِ مقلد ایکسمی میوکارد بودند؛ یک مورد مرگ ناگهانی و ۹ مورد نیز به صورت کاردیومیوپاتی دیلاته با شروع اخیر بیماری گزارش شدند.
بررسی ۲۰ سالهی ۴۸۱,۳۷۷ اتوپسی در ژاپن، حاکی از وجود میوکاردیت ایدیوپاتیک، غیراختصاصی، بینابینی یا ویروسی در تنها ۰.۱۱% افراد بود.
دموگرافیکهای مرتبط با نژاد، جنس و سن
هیچ برتری نژادی برای میوکاردیت به استثنای کاردیومیوپاتی پری پارتوم ذکر نشده است. کاردیومیوپاتی پری پارتوم نوع خاصی از میوکاردیت است که میزان بروز آن در نژاد آفریقایی بالاتر است. بروز میوکاردیت بین مردان و زنان یکسان است؛ اگرچه مردان جوان تا حدودی مستعدتر هستند. بیماران میوکاردیت معمولاً به نسبت جوان هستند. سن متوسط بیماران مبتلا به میوکاردیت لنفوسیتیک، ۴۲ سال است. بیماران میوکاردیت سلول ژانت ممکن است سن بالاتری (متوسط سن ۵۸ سال) داشته باشند؛ اما این شرایط معمولاً نسبت به سن، جنس یا علائم بالینی تفاوتی ندارد. سایر گروههای مستعد شامل افراد دچار ضعف ایمنی، زنان باردار و کودکان (خصوصاً نوزادان) میباشند.
پیشآگهی
بیمارانی که از میوکاردیت برقآسا جان سالم به در میبرند، پیشآگهی خوبی دارند. در مطالعهی ۱۴۷ بیمار میوکاردیت که به مدت ۵.۶ سال پایش آنها صورت گرفت، ۹۳% از ۱۵ بیمارِ مبتلا به حالت برقآسای بیماری، ۱۱ سال پس از بیوپسی بدون انجام پیوند زنده بودند. این آمار در بیماران مبتلا به حالت نه چندان شدید بیماری، ۴۵% از ۱۳۲ بیمار بود. همچنین دیلاسیون بطن چپ در موارد برقآسا به شدت موارد دیگر نبود.
بیان Fas و Fas لیگاندهای محلول در تظاهر اولیهی بیماری، به نظر میرسد مارکر سرولوژیک خوبی برای پیشبینی پیشآگهی میوکاردیت حاد است؛ در حالی که اتوآنتیبادیهای آنتیمیوزین در میوکاردیت مزمن، مرتبط با تشدید اختلال عملکرد قلبی هستند.
پیشبینیکنندههای مرگ یا نیاز به پیوند قلب پس از میوکاردیت حاد، طی بررسیهای چند متغیره شامل سنکوپ، کسر تخلیهی کم و بلوک شاخهای چپ هستند. همگی این موارد نشانگر کاردیومیوپاتی پیشرفته میباشند.
موربیدیته و مورتالیته
اغلب بیماران دارای علائم خفیف، به طور کامل بدون هر گونه اختلال عملکرد قلبی بهبود مییابند؛ اگرچه یک سوم بیماران متعاقباً به کاردیومیوپاتی دیلاته مبتلا میشوند. امکان بروز شوک کاردیوژنیک در موارد برقآسای میوکاردیت وجود دارد.
در بررسی جمعیتی با تظاهر نارسایی قلبی علامتدار و کسر تخلیهی بطن چپ کمتر از ۴۵% خط پایه، میزان مورتالیتهی یک ساله در کارآزمایی درمان میوکاردیت، ۲۰% و میزان مورتالیتهی ۴ ساله ۵۶% بود. بلوک قلبی شدید نیازمند به تعبیهی دائمی پیسمیکر نیز در ۱% بیماران کارآزمایی رخ داده بود.
در مطالعهی بیماران مبتلا به میوکاردیت سلول ژانت، ۸۹% بیماران یا فوت کرده و یا تحت عمل پیوند قرار گرفتند؛ طوری که متوسط بقا از شروع علائم تا مرگ یا پیوند، تنها ۵.۵ ماه بود.
محقق Klugman و همکارانش طی مطالعهای، نرخ بقای ۹۲% برای ۲۱۶ بیمار اطفال مبتلا به میوکاردیت گزارش کردند. به گزارش محققان، بیمارانی که جان سالم به در نبردند، دارای مشخصهی افزایش شدت بیماری و نیاز مکرر به اکسیژناسیون غشایی برون پیکری و سایر درمانهای بخش مراقبتهای ویژه بودند. در مجموع با در نظر گرفتن کاردیومیوپاتی پس از زایمان، میزان مورتالیته در سال اول میتواند ۵۰% باشد.
شرححال
بیماران مبتلا به میوکاردیت، شرح بالینی حملهی حاد نارسایی قلبی دارند؛ اما هیچ اختلال عملکرد قلبی زمینهای یا خطر قلبی حتی به میزان کم در آنها وجود ندارد. تشخیص معمولاً احتمالی بوده و بر اساس دموگرافیکهای بیمار و آموزههای بالینی (به عنوان مثال، بهبودی خودبخود در پی درمان حمایتی) صورت میگیرد. بیماران ممکن است با علائم خفیف درد سینه (در پریکاردیت همزمان)، تب، تعریق، لرز و دیسپنه مراجعه کنند. در میوکاردیت ویروسی بیماران احتمال دارد سابقهی اخیر (یک تا دو هفته قبل) سندروم شبهآنفلوانزا شامل تب، آرترالژی و ضعف یا فارنژیت، التهاب لوزه یا عفونت مجاری تنفسی فوقانی داشته باشند.
مطالعات جمعیتی حاکی از آنند که بزرگسالان ممکن است در مقایسه با حالت حاد و سمی شوک کاردیوژنیک یا نارسایی قلبی واضح (میوکاردیت برقآسا) که اغلب مرتبط با میوکاردیت است، با علائم کمی مراجعه کنند. علائم تپش قلب یا سنکوپ یا حتی مرگ ناگهانی قلبی نیز ممکن است به علت آریتمی بطنی زمینهای یا بلوک دهلیزی-بطنی (خصوصاً در میوکاردیت سلول ژانت) بروز کنند. بالغین احتمال دارد سالها پس از رویداد شاخص ابتدائی میوکاردیت، با نارسایی قلبی مراجعه کنند (چنانچه در مطالعهای موردشاهدی، احتمال میدادند ۱۲.۸% بیماران مبتلا به کاردیومیوپاتی دیلاته ایدیوپاتیک، قبلا به میوکاردیت مبتلا شده باشند).
معاینهی فیزیکی
بیماران مبتلا به میوکاردیت معمولاً با علائم و نشانههای حملهی حاد نارسایی قلبی (مانند تاکیکاردی، گالوپ، رگورژیتاسیون میترال و ادم) و در موارد پریکاردیت همزمان، با فریکشن راب پریکاردی مراجعه میکنند. یافتههای اختصاصی در موارد به خصوص شامل موارد زیر است:
- میوکاردیت سارکوئید- لنفادنوپاتی همراه با آریتمی و درگیری سارکوئید در سایر ارگانها (تا ۷۰%)
- تب روماتیسمی حاد- معمولاً در ۹۰-۵۰% موارد، قلب را درگیر میکند؛ از علائم مرتبط میتوان به اریتم مارژیناتوم، پلیآرترالژی، کره و ندول زیرجلدی (کرایتریای جونز) اشاره کرد.
- میوکاردیت ازدیاد حساسیتی/ ائوزینوفیلیک- راش ماکولوپاپولر خارشدار و سابقهی مصرف داروهای غیرمجاز
- میوکاردیت سلول ژانت- تاکیکاردی بطنی پایدار در نارسایی قلبی سریع پیشرونده
- کاردیومیوپاتی پری پارتوم- نارسایی قلبی که در ماه آخر بارداری یا تا ۵ ماه پس از زایمان تظاهر مییابد.
ملاحظات تشخیصی
نوع جدیدی از اختلال عملکرد موقت قلبی تحت عنوان کاردیومیوپاتی تاکوتسوبو یا سندروم بالونی شدن آپیکال موقت شناخته شده است که با هیپوکینزی شدید نواحی انتروآپیکال و اینفروآپیکال قلب به دلایل نامشخص و اغلب با قابلیت تفکیکپذیری بالا تشخیص داده میشود. بسیاری از موارد این حالت مرتبط با وقایع روانی یا استرسزا دانسته شدهاند. برخی ماهیت میوکاردیتی برای آن قائلند؛ اما درک دقیقی از این سندروم حاصل نشده است.
شرایطی که بایستی در تشخیص افتراقی میوکاردیت مورد توجه قرار گیرند، شامل موارد زیر است:
- وازواسپاسم شریان کرونری
- آنومالیهای مجزای شریان کرونری
- انفارکتوس میوکارد
- ایسکمی میوکارد
- ادم ریوی کاردیوژنیک
- ادم ریوی در شرایط ارتفاعات بالا
- فیبروز ریوی بینابینی (غیرایدیوپاتیک)
- مرگ ناگهانی قلبی
- آنژین ناپایدار
- تاکیکاردی بطنی
تشخیص افتراقی
- کاردیومیوپاتی الکلی
- تامپوناد قلبی
- شوک کاردیوژنیک
- بیماری شاگاس (تریپانوزومیازیس آمریکایی)
- کاردیومیوپاتی مرتبط با کوکائین
- آترواسکلروز شریان کرونری
- کاردیومیوپاتی دیلاته
- کاردیومیوپاتی هیپرتروفیک
- کاردیومیوپاتی پری پارتوم
- کاردیومیوپاتی محدود کننده
روند تشخیصی
بررسیهای آزمایشگاهی
بررسیهای آزمایشگاهی شامل موارد زیر است:
- شمارش کامل سلولهای خونی (CBC)- لکوسیتوز (احتمالاً نشان دهندهی ائوزینوفیلی)
- افزایش سرعت رسوب اریتروسیت (و سایر واکنشگرهای فاز حاد مانند پروتئین واکنشگر C)
- غربالگری روماتولوژیک- جهت رد بیماریهای التهابی سیتمیک
- افزایش میزان آنزیمهای قلبی- کراتین کیناز یا تروپونینهای قلبی
- تیتر آنتیبادیهای ویروسی سرم- برای میوکاردیت ویروسی
آنزیمهای قلبی
افزایش میزان آنزیمهای قلبی نشاندهندهی میونکروز قلبی است. به خصوص تروپونین قلبی (تروپونین I یا T) در حداقل ۵۰% بیماران مبتلا به میوکاردیت تأیید شده با بیوپسی، افزایش مییابد. آنزیمهای قلبی همچنین ممکن است به شناسایی بیماران مبتلا به میوکاردیت ویروسی افتراقی کمک کنند.
اختصاصیت تست ۸۹% و حساسیت آن ۳۴% بوده و نسبت به زیرواحدهای MB کراتین کیناز که تنها در ۵.۷% بیماران مبتلا به میوکاردیت تأیید شده با بیوپسی افزایش مییابند، در موارد بیشتری میزان آن بالا میرود. هرچند این مطالعات با استفاده از تستهای بالینی استاندارد صورت گرفته و حساسیت نسل جدید تستهای فوق حساس تروپونین قلبی ممکن است در تشخیص میوکاردیت تفاوت داشته باشند.
تیتر آنتیبادی ویروسی
تیترهای رایج آنتیبادی ویروسی برای ارزیابی بالینی مواردی همچون کوکساکی ویروس گروه B، ویروس نقص ایمنی انسانی (HIV)، سیتومگالوویروس، اپشتینبار ویروسt خانوادهی ویروس هپاتیت و ویروسهای آنفلوانزا در دسترس هستند. تیترها به میزان ۴ برابر یا بیشتر افزایش داشته و در طول درمان به طور تدریجی کاهش مییابند (غیراختصاصی). از این رو، تستهای سریالی نیاز است.
تست تیتر آنتیبادی به دلیل اختصاصیت کم و افزایش تأخیری تیترهای ویروسی، به ندرت میتواند معیار تشخیصی میوکاردیت ویروسی یا هر کاردیومیوپاتی دیلاته باشد. از این رو، میتوان گفت تأثیری بر تصمیمات درمانی ندارد.
ژنوم ویروسی
حضور ژنوم ویروسی در نمونههای بیوپسی اندومیوکارد (EMB)، معیار استاندارد وجود و پایداری ویروس است. اگرچه این تست اختصاصیت کمی دارد؛ چرا که ژنوم ویروسی میتواند در گروههای کنترل سالم نیز وجود داشته باشد. شایعترین ژنومهای ویروسی یافت شده شامل پاروویروس و هرپس سیمپلکس است.
یافتههای بافتشناسی
نمونههای بیوپسی EMB باید همزمان حاکی از ارتشاح لنفوسیت و نکروز میوسیت باشند.
اکوکاردیوگرافی
اکوکاردیوگرافی به منظور رد سایر علل نارسایی (از جمله آملوئیدوز یا علل دریچهای یا نارسایی) و ارزیابی درجهی اختلال عملکرد قلبی (معمولاً هیپوکینزی منتشر و اختلال عملکرد دیاستولی) انجام میشود. همچنین امکان تعیین موضع ماکروسکوپی گسترهی التهاب (ناهنجاریهای حرکت دیواره، افزایش ضخامت دیواره، افیوژن پریکارد) را فراهم میکند. بهعلاوه، اکوکاردیوگرافی میتواند با تعیین ابعاد دیاستولی نزدیک به نرمال بطن چپ و تشخیص افزایش ضخامت سپتال در میوکاردیت برقآسا ضمن بهبودی قابل توجه در عملکرد سیستولی در واحد زمان، در مقابل افزایش ابعاد دیاستولی بطن چپ و ضخامت سپتال نرمال در میوکاردیت حاد، بین میوکاردیت برقآسا و حاد تمایز قائل شود.
سینتیگرافی
سینتیگرافی آنتیمیوزین (با استفاده از تزریق آنتیبادی آنتیمیوزین) میتواند التهاب میوکارد را با حساسیت بالا (۹۱-۱۰۰%) و ارزش اخباری منفی بالا (۹۳-۱۰۰%) اما اختصاصیت کم (۳۱-۴۴%) و ارزش اخباری مثبت کم (۲۸-۳۳%) تشخیص دهد. در مقایسه، اسکن گالیم برای نشان دادن ارتشاح سلولی شدید میوکارد استفاده میشود و ارزش اخباری منفی خوبی دارد؛ هرچند اختصاصیت کمی دارد. اسکن توموگرافی نشر پوزیترون (PET) در برخی موارد مانند سارکوئیدوز، برای بررسی درجه و موقعیت التهاب استفاده میشود.
سایر تکنیکهای تصویربرداری
آنژیوگرافی قلبی اغلب با کاربرد رد ایسکمی کرونری به عنوان یکی از عوامل نارسایی قلبی جدیدالوقوع شناخته میشود؛ خصوصاً زمانی که تظاهرات بالینی مقلد انفارکتوس حاد میوکارد باشند. این روش معمولاً فشارهای بالای پرشدگی و کاهش برونده قلبی را نشان میدهد.
تصویربرداری تشدید مغناطیسی (MRI) پیشرفته با گادولینیوم برای بررسی گسترهی التهاب و ادم سلولی استفاده میشود؛ هر چند همچنان غیراختصاصی است. MRI با جذب تأخیری نیز برای تعیین میزان اسکار رخ داده متعاقب میوکاردیت حاد، مورد استفاده قرار میگیرد.
به ادعای محقق Monney و همکارانش، اسکن تشدید مغناطیسی قلبی (CMR) میتواند در بیماران مشکوک به سندروم حاد کرونری که بیماری شریان کرونری در آنها تشخیص داده نشده است، مفید واقع شود. در نسبت قابل توجهی از این بیماران در مطالعهی فوق، علیرغم حفظ عملکرد سیستولیک، متعاقباً بر اساس یافتههای اسکن CMR، میوکاردیت حاد تشخیص داده شد.
محقق Radunski و همکارانش، دقت مقدارسنجی T2 ،T1 و حجم خارج سلولی (ECV) را به عنوان مارکر بافتی کمّی و جدید برای تشخیص میوکاردیت، در مقایسه با استاندارد “Lake-Louise” تشدید مغناطیسی قلبی (CMR) بررسی کردند. طی مطالعه، CMR با سیستم ۱.۵-T (تسلا) بر روی ۱۰۴ بیمار مبتلا به میوکاردیت و ۲۱ مورد کنترل صورت گرفت. بیماران مبتلا به میوکاردیت، دو هفته (دامنهی میان چارکی: ۱ تا ۷ هفته) پس از مراجعه با نارسایی قلبی جدیدالوقوع یا درد سینه حاد، تحت CMR قرار گرفتند. دقت تشخیصی CMR مرسوم برای T2w CMR هفتاد درصد، برای EGE پنجاه و نه درصد و برای LGE شصت و هفت درصد بود. دقت تشخیصی تکنیکهای مپینگ (mapping) برای T2 میوکاردی ۶۳%، برای T1 میوکاردی مختص محل ۶۹% و برای ECV میوکاردی سراسری ۷۶% بود. دقت تشخیصی CMR با یک اپروچ گام به گام با استفاده از حضور LGE و ECV میوکاردی بیشتر یا مساوی ۲۷% به عنوان کرایتریای تشخیصی، به طور قابل توجهی به ۹۰% افزایش یافت؛ این میزان برای کرایتریای Lake-Louise 79% بود. مقدارسنجی ECV با تصویربرداری LGE، در مقایسه با کرایتریای استاندارد Lake-Louise به طور شاخصی به دقت تشخیصی CMR بهبود بخشید.
محقق Bohnen و همکارانش، پرفورمنسِ تکنیکهای جدید مپینگ مقداری T1 و T2 در CMR را از نظر شناسایی میوکاردیت فعال در بیماران با نارسایی قلبی جدیدالوقوع، آزمایش کردند. جمعیت مورد مطالعه شامل ۳۱ بیمار پی در پی با نارسایی قلبی جدیدالوقوع، کاهش عملکرد بطن چپ و مشکوک به میوکاردیت بود که تحت عمل بیوپسی میوکارد و CMR با سیستم ۱.۵ تسلا قرار گرفته بودند. بیوپسی اندومیوکارد حاکی از میوکاردیت فعال در ۱۶ مورد از ۳۱ بیمار بود. بیماران مبتلا به میوکاردیت فعال هیچ تفاوت قابل توجهی از نظر شاخصهای بالینی، پارامترهای استاندارد Lake-Louise CMR، T1 میوکاردی سراسری یا نسبت حجم خارج سلولی، با بیماران بدون میوکاردیت فعال نداشتند. اگرچه متوسط T2 میوکاردی سراسری در بیماران مبتلا به میوکاردیت فعال در مقایسه با سایرین به طور شاخصی بالاتر بود. طی مطالعهی صورت گرفته، ارزش مقداری T2 میوکاردی سراسری بیشتر مساوی ۶۰ ms برای میوکاردیت فعال به صورت مقابل ثبت شد: حساسیت ۹۴% (۱۰۰%-۷۰%)، اختصاصیت ۶۰% (۸۴%-۳۲%)، دقت ۷۷% (۸۹%-۶۰%)، ارزش اخباری منفی ۹۰% (۱۰۰%-۵۶%) و ارزش اخباری مثبت ۷۱% (۸۹%-۴۸%). مپینگ T2 به نظر میرسد برای ارزیابی فعالیت میوکاردیت در بیماران با نارسایی قلبی جدیدالوقوع و کاهش عملکرد بطن چپ، برتر از پارامترهای استاندارد CMR، T1 میوکاردی سراسری و نسبت حجم خارج سلولی است.
درمان دارویی
در حالت کلی هدف از درمان میوکاردیت حاد یا مزمن، ضمن درمان حمایتی به امید افزایش بقا، کاهش احتقان و بهبود همودینامیک قلبی در نارسایی قلبی است. درمان نارسایی قلبی صرف نظر از علت زمینهای، درمان مشابهی است (مهارکنندههای ACE، بلوکرهای بتاآدرنژیک). در مطالعات بالینی با مقیاس کوچک دیده شده است که درمان شدید ایمونوساپرسیو (نظیر کورتیکواستروئیدها، آزاتیوپرین، سیکلوسپورین، موروموناب (CD3/OKT3 در درمان میوکاردیت سلول ژانت مؤثر است؛ هر چند در کارآزماییهای بالینی بزرگ ثابت نشده است. در حال حاضر تا زمانی که شواهد آشکار از نتایج کارآزماییهای چندمرکزی به دست نیامده است، درمان ایمونوساپرسیو برای میوکاردیت توصیه نمیشود.
وازودیلاتورها
وازودیلاتورها مقاومت عروقی سیستمیک را کاهش داده، جریان رو به جلو را افزایش داده و موجب بهبود برونده قلبی میشوند. این امر به نوبهی خود عرضهی اکسیژن به میوکارد را بهبود بخشیده و به دیلاتاسیون عروق کولترال و اپیکاردیال و بهبود میزان عرضهی خون به میوکارد ایسکمیک میانجامد.
نیتروگلیسیرین (مینیتران، نیتروبید، نیتروستات، نیترودور)
نیتروگلیسیرین داروی انتخابی برای بیمارانی است که هیپوتنسیو نیستند. این دارو باعث کاهش مناسب پیشبار میشود؛ حال آن که دوزهای بالای دارو موجب کاهش خفیف پسبار میگردند. نیتروگلیسیرین شروع اثر و خاتمهی اثر سریعی دارد (هر دو در حد دقیقه) که باعث اثرات بالینی سریع دارو و توقف سریع اثرات دارو در واکنشهای منفی میشود.
سدیم نیتروپروساید (نیتروپرس)
سدیم نیتروپروساید به عنوان کاهش دهندهی پسبار شناخته میشود. این دارو عامل بالقوه و مستقیم گشادکنندهی عروقی است که به صورت اولیه موجب کاهش پسبار میگردد؛ اما میتواند کاهش خفیف پیشبار را نیز در پی داشته باشد. این دارو باعث بهبودی شاخص در برونده قلبی میشود؛ اما همچنین میتواند باعث کاهش سریع در فشار خون گردد. از این رو، پایش دقیق فشار خون داخل شریانی توصیه میشود. سدیم نیتروپروساید به علت شروع و خاتمهی اثر سریع (در عرض ۲-۱ دقیقه)، دارویی بسیار مناسب برای بیماران با وضعیت شدیداً بدحال است. علاوه بر این، دارویی بسیار مناسب برای درمان ادم ریوی کاردیوژنیک مرتبط با هایپرتنشن در میوکاردیت میباشد.
مهارکنندههای ACE
در پی تثبیت علائم نارسایی قلبی، شروع درمان با مهارکنندههای ACE، مراقبت استاندارد جهت به تأخیر انداختن پیشرفت بیماری نارسایی قلبی است. آنتاگونیستهای بتاآدرنژیک بایستی تنها پس از رفع علائم احتقان و پس از تثبیت شرایط بالینی بیمار مورد استفاده قرار گیرند.
رامیپریل (آلتاس)
این دارو از تبدیل آنژیوتانسین I به آنژیوتانسین II -تنگگنندهی قوی عروقی که موجب افزایش سطح رنین پلاسما و کاهش ترشح آلدوسترون میشود- ممانعت میکند.
انالاپریل (وازوتک، اپاند)
انالاپریل مهارکنندهی رقابتی آنزیمهای مبدل آنژیوتانسین است. این دارو سطح آنژیوتانسین را کاهش داده و موجب کاهش ترشح آلدوسترون میشود.
کیناپریل (اکوپریل)
این دارو از تبدیل آنژیوتانسین I به آنژیوتانسین II -تنگگنندهی قوی عروقی که موجب افزایش سطح رنین پلاسما و کاهش ترشح آلدوسترون میشود- ممانعت میکند.
کاپتوپریل
از تبدیل آنژیوتانسین I به آنژیوتانسین II -تنگگنندهی قوی عروقی- ممانعت کرده و باعث کاهش ترشح آلدوسترون میشود. به سرعت جذب میشود؛ اما فراهمی زیستی دارو به طور قابل توجهی در صورت همراهی با غذا کاهش مییابد. در عرض یک ساعت به پیک غلظت خود رسیده و نیمه عمر کوتاهی دارد. کلیرانس دارو بر عهدهی کلیه است؛ در نتیجه در شرایط اختلال عملکرد کلیوی، باید دوز دارو کاهش داده شود. از راه خوراکی به خوبی جذب شده و حداقل باید یک ساعت قبل از غذا مصرف شود. در صورت مصرف با آب، ۱۵ دقیقه قبل مصرف گردد. دارو را میتوان با دوز کم شروع کرده و به قدر نیاز و تحمل بیمار، دوز را افزایش داد.
لیزینوپریل (پرینیویل، زستریل)
از تبدیل آنژیوتانسین I به آنژیوتانسین II -تنگگنندهی قوی عروقی- ممانعت کرده و باعث افزایش رنین پلاسما و کاهش ترشح آلدوسترون میشود.
دیورتیکها
دیورتیکها پیشبار را کاهش میدهند. در پی مصرف این داروها، افت ابتدایی ناشی از دیورز در برونده قلبی، موجب افزایش جبرانی مقاومت عروق محیطی میگردد. با تداوم درمان با دیورتیک، حجم مایع خارج سلولی و حجم پلاسما تقریباً به میزان قبل از درمان خود برمیگردند. مقاومت عروق محیطی نیز به خط پایهی قبل از درمان، افت میکند.
فورزماید (لازیکس)
فورزماید پراستفادهترین دیورتیک لوپ میباشد. این دارو در پی تداخل با سیستم همانتقالی وابسته به کلر، دفع آب را افزایش داده و باعث مهار بازجذب کلر و سدیم در بخش بالاروی لوپ هنله و توبول کلیوی دیستال میشود. فورزماید پیشبار را از طریق دیورز در ۶۰-۲۰ ثانیه کاهش میدهد. همچنین ممکن است از طریق مکانیسم مستقیم وازودیلاتوری، موجب کاهش سریعتر پیشبار شود؛ اما این موضوع بحثبرانگیز است. حدود نیمی از بیماران مبتلا به ادم ریوی کاردیوژنیک (CPE) از نظر مایعات کل بدن حالت نرمال دارند. فروزماید در حالت کلی به تمامی بیماران مبتلا به CPE تجویز میشود؛ اما احتمالاً در بیماران با افزایش بار مایعات کل بدن، سودمندتر واقع میشود. شروع عملکرد فرم خوراکی دارو آهسته است؛ از این رو، در حالت کلی برای درمان این بیماران مناسب تلقی نمیشود.
توراسماید (دمادکس)
این دارو اثر خود را در لومن بخش بالاروی لوپ هنله اعمال میکند؛ جایی که در آن سیستم حامل Na/K/2Cl را مهار میکند. توراسماید دفع ادراری سدیم، کلر و آب را افزایش میدهد؛ اما میزان فیلتراسیون گلومرولی، جریان کلیوی پلاسما یا تعادل اسید-باز را چندان تغییر نمیدهد.
بومتانید
بومتانید با تداخل در سیستم همانتقالی وابسته به کلر، دفع آب را افزایش میدهد. این امر به نوبهی خود، بازجذب سدیم، پتاسیم و کلر را در بخش بالاروی لوپ هنله افزایش میدهد. این اثرات دفع ادراری سدیم، کلر و آب را افزایش داده و موجب دیورز شدید میشوند. متعاقب تجویز دارو، وازودیلاسیون کلیوی رخ داده، مقاومت عروق کلیوی کاهش یافته و جریان خون کلیوی افزایش مییابد.
دوز دارو باید با توجه به بیمار تنظیم شود. با دوز ۲-۱ میلیگرم IV شروع کرده؛ تا دوز ۱۰ میلیگرم روزانه افزایش دهید. به ندرت دوزهایی به حد ۲۴ میلیگرم روزانه نیز برای ادم استفاده میشوند؛ اما در حالت کلی برای درمان هیپرکالمی نیاز نیست. یک میلیگرم بومتانید برابر با تقریباً ۴۰ میلیگرم فورزماید است.
بلوکرهای گیرندهی آنژیوتانسین II
بلوکرهای گیرندهی آنژیوتانسین در درمان نارسایی قلبی به اندازهی مهارکنندههای ACE مؤثر هستند. اثرات منفی این داروها مشابه مهارکنندههای ACE اعم از نارسایی کلیوی یا هایپرکالمی است؛ اما موجب افزایش قدرت برادیکینین نشده و از این رو، باعث سرفه نمیشوند.
کاندسارتان (آتاکاند)
کاندسارتان اثر وازوکانستریکتوری آنژیوتانسین II و اثر آن بر ترشح آلدوسترون را بلوکه میکند. این دارو در ارتباط با مهار سیستم رنین-آنژیوتانسین، نسبت به مهارکنندههای ACE عملکرد کاملتری دارد؛ بر پاسخ به برادیکینین تأثیری نداشته و کمتر موجب سرفه و آنژیوادم میشود. از این دارو در بیمارانی که قادر به تحمل مهارکنندههای ACE نیستند، استفاده کنید. بلوکرهای گیرندهی آنژیوتانسین II فشار خون و پروتئینوری را کاهش داده؛ از عملکرد کلیوی محافظت کرده و شروع مرحلهی آخر بیماری کلیوی (ESRD) را به تأخیر میاندازند.
لوزارتان (کوزار)
آنتاگونیست گیرندهی آنژیوتانسین II بوده که اثر وازوکانستریکتوری آنژیوتانسین II و اثر آن بر ترشح آلدوسترون را بلوکه میکند. این دارو در ارتباط با مهار سیستم رنین-آنژیوتانسین، نسبت به مهارکنندههای ACE عملکرد کاملتری دارد؛ بر پاسخ به برادیکینین تأثیری نداشته و کمتر موجب سرفه و آنژیوادم میشود. از این دارو در بیمارانی که قادر به تحمل مهارکنندههای ACE نیستند، استفاده کنید.
والزارتان (دیووان)
پیشدارویی است که اثر آنتاگونیستی مستقیم بر گیرندههای آنژیوتانسین II دارد. آنژیوتانسین II را از گیرندهی AT1 جابجا کرده و ممکن است با آنتاگونیزه کردن AT1، فشار خون را کاهش دهد؛ چرا که این گیرنده باعث تنگی عروق، ترشح آلدوسترون، آزاد شدن کاتکول آمین و آرژینین وازوپرسین، مصرف آب و پاسخهای هیپرتروفیک میشود. این دارو در ارتباط با مهار سیستم رنین-آنژیوتانسین، نسبت به مهارکنندههای ACE عملکرد کاملتری دارد؛ بر پاسخ به برادیکینین تأثیری نداشته و کمتر موجب سرفه و آنژیوادم میشود. از این دارو در بیمارانی که قادر به تحمل مهارکنندههای ACE نیستند، استفاده کنید.
بلوکرهای بتاآدرنژیک
از استفاده از بتابلوکرها در درمان اولیهی میوکاردیت برقآسا و فاز حاد نارسایی قلبی جبران نشده، اجتناب کنید. بتابلوکرها در کنار اثرات خود در ارتباط با کاهش ایسکمی، خاصیت ضدآریتمی و ضدهایپرتنشن دارند. این داروها با کاهش پسبار و استرس دیواره، عدم تعادل میان عرضه و تقاضا را در میوکارد به حداقل میرسانند. بتابلوکرها در بیماران مبتلا به انفارکت آپیکال و سگمانهای بازال هیپردینامیک، انسداد دینامیک راه خروجی بطن چپ را بهبود میبخشند. این عوامل از راههای متعدد در درمان نارسایی قلبی نقش دارند. در بیماران مبتلا به شوک کاردیوژنیک یا بیمارانی که با علائم نارسایی قلبی مراجعه کردهاند، بتابلوکرها نباید به سرعت و با دوز بالا مورد استفاده قرار گیرند.
متوپرولول (لوپرسور، توپرول XL)
بلوکر انتخابی گیرندهی بتا۱ آدرنژیک که اتوماتیسیتهی انقباضات را کاهش میدهد. طی تجویز IV، پایش دقیق فشار خون، ضربان قلب و ECG باید صوت گیرد.
کارودیلول (کورگ، کورگ CR)
بلوکر غیرانتخابی بتا و آلفا آدرنژیک که خواص آنتیاکسیدان نیز دارد. به نظر میرسد فعالیت سمپاتومیمتیک ذاتی ندارد. ممکن است برونده قلبی و مقاومت عروق محیطی را کاهش دهد.
بیزوپرولول (زبتا)
بلوکر انتخابی گیرندهی بتا۱ آدرنژیک که اتوماتیسیتهی انقباضات را کاهش میدهد.
داروهای اینوتروپ
داروهای اینوتروپ ممکن است علیرغم خاصیت آریتموژن بالای خود، در موارد حملهی شدید مورد استفاده قرار گیرند.
میلرینون
اینوتروپ مثبت بیپریدین و وازودیلاتور با فعالیت کم کرونوتروپیک؛ این دارو در مقایسه با گلیکوزیدهای دیجیتالیس و کاتکولآمینها، عملکرد متفاوتی دارد. فسفودیاستراز نوع III یا PDE III را به طور انتخابی در قلب و عضلهی صاف عروق مهار کرده و از این طریق، باعث کاهش پسبار و پیشبار و افزایش اینوتروپی میشود.
دوبوتامین
موجب وازودیلاسیون و تشدید حالت اینوتروپیک میشود. در دوزهای بالاتر ممکن است موجب افزایش ضربان قلب و تشدید ایسکمی میوکارد گردد.