تکنیک الکتروفورز در ژل به منظور جداسازی قطعات DNA بر اساس اندازه به کار میرود و به این منظور از تفاوتهای بار الکتریکی مولکولهای موجود در مخلوط استفاده مینماید. مولکولهای DNA دارای بار منفی هستند؛ در نتیجه با قرار گرفتن در میدان الکتریکی به سمت قطب مثبت حرکت می کنند. سرعت مهاجرت یک مولکول در چنین شرایطی، به دو فاکتور بستگی دارد: شکل مولکول و نسبت بار به جرم آن. متاسفانه بسیاری از مولکولهای DNA دارای شکل یکسان و نسبت بار به جرم مشابه هستند. در نتیجه جداسازی قطعات با اندازه متفاوت توسط الکتروفورز استاندارد ممکن نیست. در صورت انجام الکتروفورز در ژل، میتوان از اندازه DNA به عنوان یک فاکتور جداسازی استفاده کرد.
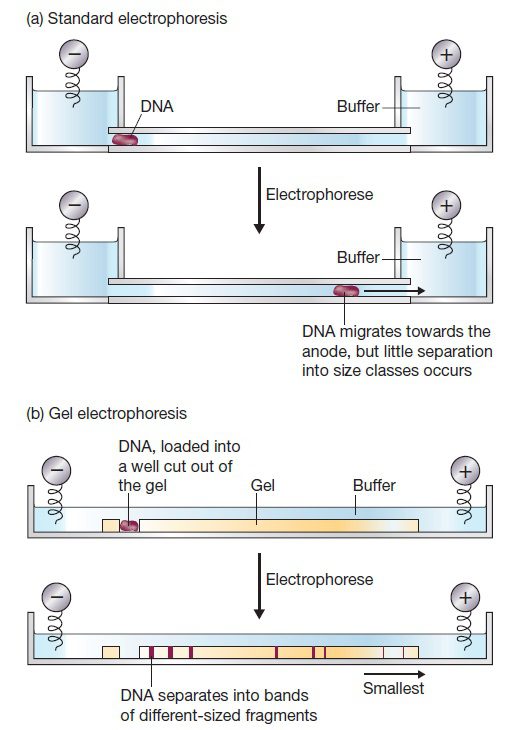
ژل معمولا از آگارز، پلی آکریل آمید و یا مخلوطی از این دو ساخته میشود و شبکهای پیچیده از حفرات را تشکیل میدهد. مهاجرت مولکولهای DNA از طریق این حفرات انجام خواهد گرفت و هر چه اندازه این حفرات کوچکتر باشد، حرکت مولکولهای DNA سریعتر انجام خواهد شد. پس الکتروفورز در ژل، قطعات DNA را بر اساس اندازه از هم جدا مینماید.
نوع ژل مورد استفاده بستگی به اندازه قطعات DNA مورد بررسی دارد. به عنوان مثال قطعه آگارز ۰.۵% با ضخامت ۰.۵ سانتیمتر که دارای حفرات نسبتا بزرگی است، میتواند برای جداسازی مولکولهایی در محدوده اندازه ۱ تا ۳۰ کیلوباز استفاده شود. در مقابل، ژل پلی آکریل آمید ۴۰% با ضخامت ۰.۳ میلی متر قطعاتی به طول ۱ تا ۳۰۰ جفتباز را از یکدیگر جدا مینماید؛ در نتیجه مولکولهایی با تفاوت طول حتی یک نوکلئوتید از همدگیر قابل تشخیص میباشند.
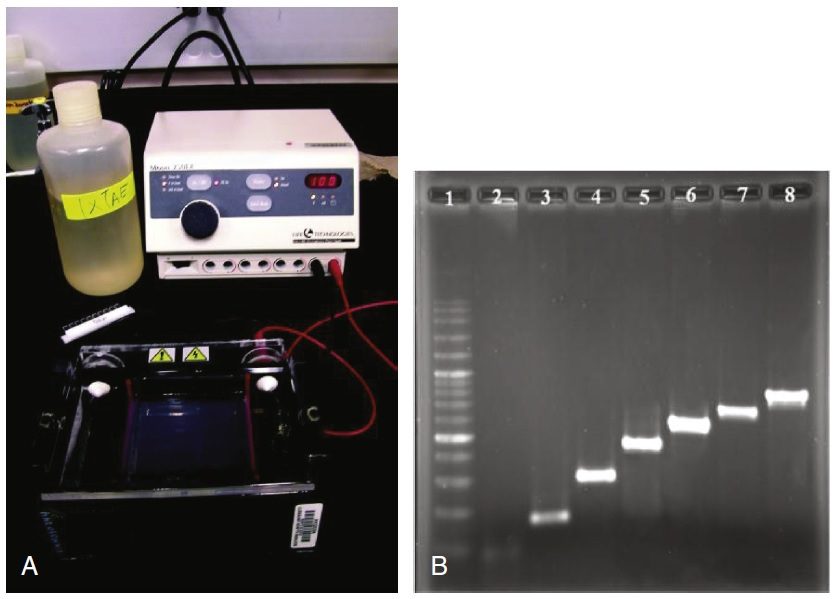
الکتروفورز در ژل آگارز
ژل آگارز حاوی آگارز استخراجشده از جلبکها است و پلیساکاریدی است که مانند ژلاتین رفتار میکند. آگارز به صورت پودر است و تنها در اثر حرارت دادن میتواند در آب حل شود. پس از سرد شدن محلول، آگارز سفت میگردد. به منظور استفاده در الکتروفورز، آگارز به صورت قطعات جامدی به ضخامت یک چهارم اینچ در میآید و این کار با ریختن مایع در قالبهای مخصوص انجام میگیرد. قرار دادن یک شانه در یک انتهای قالب پیش از سخت شدن، باعث تشکیل چاهکهایی در یک انتها پس از برداشته شدن شانه میگردد.
الکتروفورز در ژل با استفاده از جریان الکتریکی مولکولهای DNA را از یکدیگر جدا میکند. قطعه آگارز در تانکی پرشده از بافر که در یکی از انتهاها دارای الکترود مثبت و در دیگری الکترود منفی است، غوطهور میباشد. نمونههای DNA در چاهکها قرار میگیرند و با اعمال میدان الکتریکی، DNA در داخل ژل شروع به حرکت و مهاجرت میکند. ستون فسفاتی مولکولهای DNA دارای بار منفی است، در نتیجه از الکترود منفی جدا و به سمت الکترود مثبت حرکت می نماید. آگارز پلیمریزه شده دارای حفرات کوچکی میان زنجیرههای در هم پیچیده آگارز است و به عنوان یک صافی عمل مینماید. مهاجرت DNA باید از خلال این حفرات انجام بگیرد.
از آنجایی که میزان بار در واحد طول که در اثر گروه فسفات ایجاد میشود، در تمام قطعات DNA یکسان است، تمام نمونههای DNA باید با سرعت یکسانی در یک میدن الکتریکی ثابت به سمت آند حرکت نمایند. با این وجود، علت جدا شدن مولکولها در ژل آگارز مقاومتی است که در ماتریکس ژل نسبت به حرکت قطعات ایجاد میگردد. پس چون عبور مولکولهای بزرگتر از حفرات ژل، دشوارتر است، سرعت مولکولهای کوچک، بیشتر از مولکولهای بزرگ کاهش مییابد. درنتیجه میزان تحرک مولکولهای DNA در الکتروفورز به اندازه آنها بستگی خواهد داشت.
آسانترین راه مشاهده نتایج الکتروفورز، رنگ آمیزی ژل با ترکیبی است که DNA را قابل دیدن کند. به منظور این کار، ژل آگارز از درون تانک به محلولی از اتیدیوم برماید (Ethidium bromide – EtBr) انتقال داده میشود. اتیدیوم برماید به منظور رنگ امیزی DNA در ژلهای آگارز و پلی آکریل آمید استفاده میشود و در صورت استفاده از آن، رنگ بین بازهای DNA یا RNA جای میگیرد. لازم به ذکر است که به علت تکرشتهای بودن RNA، رنگ کمتری به آن متصل میگردد. با قرار گرفتن ژل در معرض اشعه فرابنفش، رنگ نارنجی روشن از آن ساطع شده و در نتیجه موقعیت نوارهای حاوی DNA در اندازههای متفاوت معین، در صورت حضور DNA به میزان کافی، میگردد.
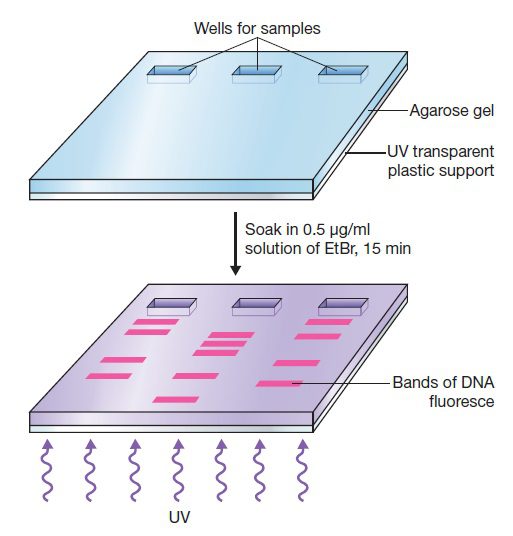
به علت قدرت جهشزایی و سرطانزایی بالا، استفاده از اتیدیوم برماید بسیار خطرناک است. همچنین این نوع از رنگآمیزی حساسیت پایینی دارد و چنانچه نواری حاوی کمتر از ۱۰ نانوگرم DNA باشد، ممکن است مشاهده نشود. به همین علت در بسیاری از آزمایشگاههای امروزی، رنگهای DNA ایمنتری مانند SYBR Safe® به کار میروند. این رنگ نیز در اثر تحریک با فرابنفش، نور نارنجی روشنی از خود نشر مینماید. رنگهای غیرجهشزای دیگری که مولکولهای DNA را به رنگهای سبز، قرمز یا آبی در می آورند، نیز موجود هستند.
میتوان رنگ را همانند تصویر ۳، پس از الکتروفورز و به صورت post-stain استفاده کرد و یا اینکه در صورت خطرناک نبودن، آن را به محلول بافری که در مرحله آمادهسازی، آگارز یا پلی آکریل آمید در آن حل میگردد، اضافه نمود. برخی از این رنگها به منظور آشکارسازی نوار، نیاز به پرتو فرابنفش دارند، اما برخی دیگر با استفاده از سایر طول موجها نیز مشاهده میشوند. به عنوان مثال میتوان از رنگ آبی استفاده کرد و از خطراتی که ممکن است استفاده از پرتو فرابنفش به همراه داشته باشد، مانند سوختگیهای شدید، خودداری نمود. همچنین با استفاده از رنگهای حساس میتوان نوارهای حاوی کمتر از یک نانوگرم DNA را شناسایی نمود. در تصویر ۲، قطعات DNA توسط رنگی با بار مثبت از خانواده تیازین (thiazin) مشاهده میشوند. این رنگ توکسیک نیست و بدون نیاز به منبع نور فرابنفش، در اثر فعل و انفعال با ستون DNA که دارای بار منفی است، وظیفهاش را انجام میدهد.
همچنین میتوان مولکولهای DNA را با استفاده از رادیوایزوتوپ ۳۲P لیبل کرد و وجود آنها را پس از الکتروفورز، با قرار دادن در مقابل یک فیلم عکاسی تشخیص داد. اتمهای ۳۲P از خود ذرات β را آزاد میکنند که به فیلم برخورد کرده و موقعیت هر نوار در ژل را ثبت مینمایند. دستگاهی که بتواند به طور مستقیم پرتوهای β را تشخیص دهد نیز میتواند به منظور اسکن ژل استفاده شود.
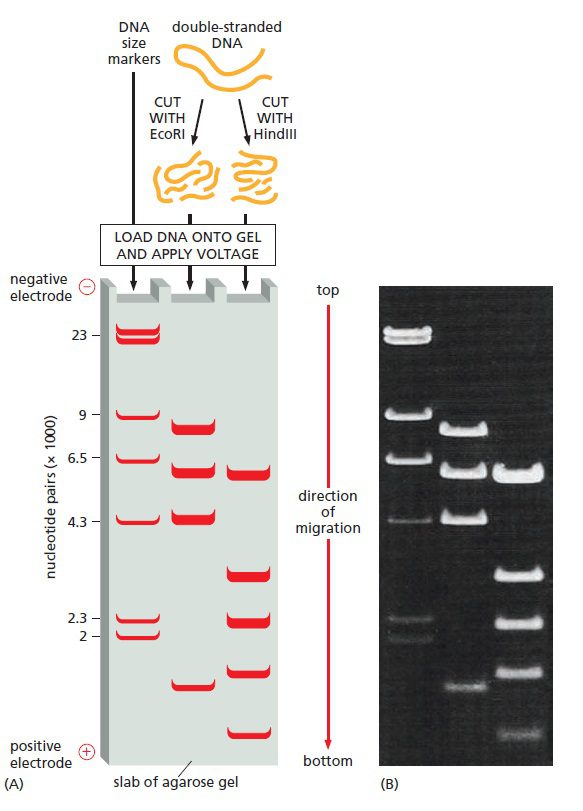
تعیین اندازه مولکولهای DNA
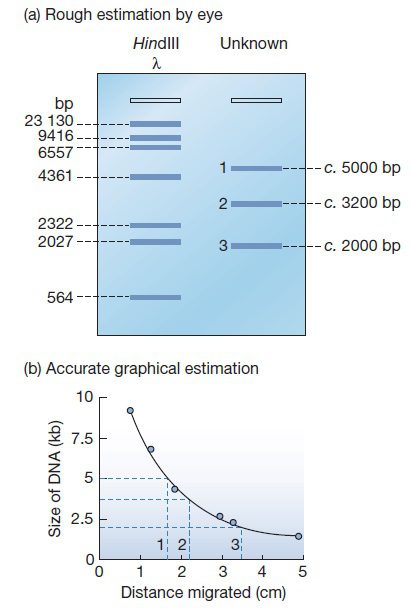
الکتروفورز در ژل، مولکولهای DNA با اندازههای متفاوت را از یکدیگر جدا میکند، به طوریکه مولکولهای کوچکتر بیشترین فاصله را از الکترود مثبت بگیرند. مولکولهای هماندازه معمولا با هم تشکیل یک نوار را میدهند و اندازه آنها در اثر مقایسه با مجموعهای استاندارد که در چاهک جداگانهای حرکت میکنند، انجام میشود. مولکولهای این مجموعه در اثر هضم DNA توسط آنزیمهای محدودکننده حاصل شدهاند و چون دارای اندازه مشخصی هستند، DNA های مورد بررسی نیز میتوانند به طور مستقیم مقایسه شوند. به عنوان مثال HindIII مولکول DNA را به ۸ قطعه که طولی از ۱۲۵ جفتباز تا ۲۳ کیلوباز دارند، تقسیم میکند.
همچنین مخلوطهای ویژهای از قطعات DNA که نردبان DNA نامیده میشوند و اندازه آنها مضرب ۱۰۰ جفتباز تا یک کیلوباز است، میتوانند به عنوان مارکرهای اندازه مورد استفاده قرار گیرند. درصد خطا در این روشها حدود ۵ درصد است، که در بسیاری از موارد قابل قبول میباشد. در الکتروفورز با ژل آگارز، میتوان قطعات DNA با طول ۲۰۰ جفتباز تا ۱۰۰۰۰ جفتباز را از هم جدا نمود.
روش دقیقتری که به این منظور استفاده میشود، استفاده از رابطهای ریاضی است که سرعت مهاجرت را به جرم مولکولی مرتبط مینماید. فرمول مرتبط این گونه است:
D= a -b(log M)
در این حالت، D مسافت پیموده شده، M جرم مولکولی و a و b ثابتهایی هستند که به شرایط الکتروفورز بستگی دارند. البته همواره نیاز به تعیین دقیق اندازه قطعات DNA نیست و معمولا متدهای سادهتر و کمدقتتری که پیشتر ذکر شد، استفاده میشوند.
الکتروفورز در ژل پلی آکریل آمید (PAGE)
در صورتیکه اندازه قطعات بین ۵۰ تا ۱۰۰۰ جفت باز باشد، ژل پلی آکریل آمید مورد استفاده قرار میگیرد که دارای حفرات کوچکتری است. مونومر آکریل آمید ابتدا به صورت پودر است و پس از افزودن آب به صورت پلی آکریل آمید در میآید. این نوع از ژلها میتوانند حتی قطعاتی را که تفاوت طولی در حد یک جفتباز با همدیگر دارند را نیز جدا کنند و برای استفاده در تکنیک توالی یابی سانگر بسیار مفید میباشند. پلی آکریل آمید مادهای سمی است و هنگام کار با آن باید نکات ایمنی را رعایت نمود.
مقالات مرتبط:
تکنیک PFGE
نوعی از الکتروفورز در ژل به نام Pulse field gel electrophoresis (PFGE) امکان جداسازی قطعات بسیار بزرگ مولکولهای DNA را فراهم میآورد (۱۰ کیلوباز تا ۱۰ مگاباز)؛ حتی آنهایی که به صورت یک کروموزوم کامل هستند. الکتروفورز در ژل عادی، در جدا کردن چنین مولکولهایی ناتوان است. علت این موضوع آن است که میدان الکتریکی پایدار باعث کشیدگی مولکولهای بلند از ابتدا تا انتهای ژل به صورت مارمانند و با سرعتی مستقل از طول قطعه میشود.
در این تکنیک نیز از آگارز استفاده میکنیم، اما جریان در دو زاویه متفاوت و یه صورت متناوب، تعویض میگردد؛ درنتیجه مولکولها پیش از آنکه حرکت مارمانند خود را درون ژل ادامه دهند، بازآرایی میشوند (reorientation). PFGE امکان مهاجرت بیشتر قطعات بسیار بزرگ DNA را نسبت به حالتی که جریان تنها در یک سمت برقرار میگردد، فراهم میکند. بازآرایی در مولکولهای بلندتر بیشتر طول میکشد، پس این مولکولها آهستهتر از مولکولهای کوتاهتر حرکت میکند. هر تغییر در جهت جریان، موقعیت قطعات بسیار بزرگ DNA را که در داخل ژل گیر افتادهاند، سستتر میکند و امکان حرکت بیشتر را فراهم میآورد. در نتیجه تمام موارد گفته شده، مولکولهایی که میتوانند حتی به بلندی کرموزومهای مخمرها و باکتریها باشند، به وسیله PFGE در نوارهایی جداگانه بر اساس اندازهشان تفکیک میگردند.
با این حال کرموزومهایی مانند کروموزومهای انسانی که طولی در حدود ۱۰۸ جفتباز دارند نیز بلندتر از آن هستند که توسط این روش تفکیک شوند. به منظور این کار، قطعات بلندی از این کرموزومها توسط آنزیم محدودکننده شکسته میشوند و سپس قطعات بلند تولید شده با PFGE آنالیز میگردند. جایگاههای تشخیص آنزیم مورداستفاده باید به ندرت در ژنوم تکرار شوند.
در صورتیکه قطعات DNA موجود در نمونه از لحاظ اندازه بسیار به یکدیگر نزدیک باشند، میتوان ازgradient gel electrophoresis استفاده نمود. وجود شیب غلظتی در آکریل آمید، بافر و یا الکترولیت، میتواند فشردگی (تجمع قطعات با اندازه یکسان) که ناشی از ساختارهای ثانویه است را کاهش دهد و نیز سرعت حرکت قطعات کوچکتر را در انتهای ژل کمتر کنند.
