تشخیص وجود مقادیر اندک جهشها در جستوجوی بیوماکرها و هدف های درمانی ضروری است؛ اما چالش اصلی، کشف تکنیکهایی است که بتوانند این تشخیص را به صورت قابل اتکایی انجام دهند. تکنیک COLD-PCR یا co-amplification at lower denaturation temperature-PCR نوعی از PCR است که قادر به حل این مشکل میباشد. این تکنیک، به صورت ترجیحی واریانتهای اللی مینور را در مخلوطی حاوی DNA وایلدتایپ در مقادیر بالا و DNA جهشیافته در مقادیر اندک، غنیسازی میکند؛ بدون اینکه نوع جهش و یا جایگاه آن در توالی هدف تاثیرگذار باشد.
مقالات مرتبط:
در عصر پزشکی شخصیشده، توانایی تشخیص واریانتهای کمیاب DNA در نمونههای بیولوژیکی بسیار ضروری است و تصمیمات حیاتی مختلفی را در فیلدهای سرطان، تشخیص پیش از تولد و بیماریهای عفونی، تحت تاثیر قرار میدهد. به عنوان مثال، آنالیز جهشها در شناسایی زودرس سرطان در بیوپسیهای بافتی و مایعات بدن مانند پلاسمای خون و سرم، ارزیابی بقایای بیماری بعد از جراحی یا شیمیدرمانی، تعیین stage بیماریها و تهیه پروفایل مولکولی به منظور تعیین پیشآگهی و یا تعیین برنامه درمان برای هر بیمار، مانیتورینگ نتایج درمان و عود سرطان میتواند مفید واقع شود.
جهشها ممکن است از نوع driver و یا passenger بوده و بسیاری از آن ها میتوانند در مراحل پایانی بیماری به عنوان جهشی کلونال تشخیص داده شوند (فراوانی ۱۰۰-۱ در DNA وایلدتایپ). با این حال، تشخیص این واریانتها در مراحل اولیه بیماری و هنگامی که به صورت سابکلونال (۱۰۰-۱ تا ۱۰۰-۳ نسبت به وایلدتایپ)، رندوم (۱۰۰-۳ تا ۱۰۰-۶) و خودبهخودی (۱۰۰-۶ تا ۱۰۰-۹) حضور دارند، و خصوصا در مواقعی که نوع جهش و جایگاه آن ناشناخته است، بسیار دشوار میباشد.
وجود هتروژنیتی و موزائیسم جهشهای موجود در تومورها و سندرومهای خاص ثابت شده میباشد. توانایی بررسی دقیق این هتروژنیتی دشوار است. به علاوه، دشواری دیگری نیز در تعیین جهشهای کمیاب ناشناخته که در نمونههای هتروژن حاصل از بیوپسیهای بافتی سرطانی یا پیشسرطانی، ادرار، خلط، مدفوع و DNA در گردش خارج سلولی که به داخل جریان خون رها شده است، وجود دارد. به طرز مشابهی، از آنجایی که سلولهای سرطانی در سرطانهای نفوذکننده و چندکانونی، معمولا هتروژن هستند، در میان تعداد فراوانی از سلولهای نرمال خواهند بود. تومورهای با آلودگی استرومایی بالا مانند سرطانهای پانکراس، ریه و پروستات، غالبا دارای جهشهایی هستند که توسط فراوانی بالایی از اللهای وایلدتایپ پوشش داده میشوند.
در چنین شرایطی، میتوان پیش از انجام آنالیزهای مولکولی میکرودیسکشن انجام داد و سلولهای توموری را از سایر سلولها جدا کرد. مشکلی که وجود دارد، هزینه بالای میکرودیسکشن، زمانبر بودن آن و کم بودن میزان محصول تولیدشده برای ارزیابیهای بعدی است. به خاطر چنین مسائلی، شناسایی اللهای جهشیافته که در مقادیر اندکی در نمونههای هتروژن وجود دارند، همچنان به عنوان چالش مطرح میباشد.
PCR غالبا به عنوان پایه بسیاری از تکنیکهای مولکولی بررسی واریانتهای توالی مورد استفاده است. PCR در شکل عادی خود، توانایی تکثیر انتخابی اللهای موتانت را نداشته و اللهای وایلدتایپ و واریانت، بسته به غلظت اولیهشان، با کارایی تقریبا یکسانی تکثیر میشوند. درنتیجه، تشخیص حضور مقادیر اندک جهشها به این نحو ممکن نخواهد بود.
در نتیجه، در آنالیز نمونههایی که فراوانی واریانتها در مقایسه با اللهای وایلدتایپ بسیار اندک است، توانایی ما در تعیین وجود جهش، بستگی به تستهایی خواهد داشت که پس از PCR عادی انجام میشوند و وظیفه آنالیز چنین جهشهایی را بر عهده دارند. برخی از این تکنیکها عبارتند از: استفاده از DNA تکثیرشده به منظور آنالیز RFLP، تعیین ژنوتیپ MALDI-TOF، توالییابی مستقیم به منظور تعیین جهشها توسط تکنیک سانگر یا پایروسکوئنسینگ و dHPLC. متدهای گفتهشده نیز در صورت استفاده به تنهایی، در بررسی جهشهای مهم از جنبه بالینی و اللهای مینور دارای فراوانی اندکی نسبت به اللهای وایلدتایپ موجود در نمونه بالینی، دارای دقت و حسایت کافی نخواهند بود. بررسی وجود بیومارکرهای خاص DNA میتواند تعدادی از کاستیهای پیشآمده در مورد حساسیت و اختصاصیت را برطرف کند؛ با این حال، انجام این بررسی نیز در طیفی از توالی که ممکن است دارای تعداد فراوانی جهش جدید و یا ناشناخته باشد، بسیار دشوار است.
جایگزین کردن COLD-PCR با PCR عادی، دقت تشخیص جهشهای موجود در نمونههایی هتروژن مانند تومورها و مایعات بدن را افزایش میدهد. استفاده از COLD-PCR به جای PCR برای تکثیر DNA ژنومی، باعث غنیسازی اللهای واریانت موجود در نمونه میشود. درنتیجه، حساسیت تشخیصی روشهای مورداستفاده در شناسایی اللهای مینور، که متاخر بر خود PCR انجام میگیرند و توالییابی سانگر از جمله آنها است، افزایش مییابد. COLD-PCR در سادهترین فرم خود نیازی به مواد اولیه اضافی و دستگاههای مخصوص ندارد و در نتیجه میتواند به سادگی جایگزین PCR عادی شود.
COLD-PCR فرایندی ساده است که طی آن دمای مرحله دناتوراسیون در چرخه PCR پایین آورده میشود و به این نحو به طور انتخابی، جهشهای دارای مقادیر اندک موجود در DNA را غنیسازی میکند. این کار منحصر به این تکنیک است و از طریق ایجاد تغییری اندک ولی حیاتی در نقطه ذوب (Tm) امپلیکونها تاثیر خود را اعمال میکند.
امروزه تکنیکهای فراوانی به منظور غنیسازی جهشها حین فرایند PCR موجود هستند؛ از جمله تستهای بر پایه PNA که از تکثیر DNA وایلدتایپ را مهار میکنند و یا تست FLAG که باعث هضم پیوسته قطعات وایلدتایپ و درنتیجه تنها تکثیر اللهای واریانت حین PCR میگردد. هر دو مثال ذکرشده و بسیاری از تکنیکهای مشابه دیگر، تنها جهشهای شناختهشده تکثیر میگردند و درنتیجه جهشهای ناشناخته تشخیص داده نخواهند شد. COLD-PCR جزو معدود تکنیکهایی است که امکان تکثیر جهشهای ناشناخته و شناختهشده را به صورت همزمان فراهم میکند و این کار را صرف نظر از جایگاه آنها در قطعه و نوع آنها انجام میدهد.
اصول اساسی فرایند COLD-PCR در تصویر ۱ توضیح داده شده است. تغییر تنها یک باز آلی، در هر موقعیتی از مولکول DNA که رخ داده باشد، منجر به تغییری اندک در دمای ذوب (Tm) امپلیکون میشود. این تغییر در حدود ۰.۲ تا ۱.۵ درجه سانتیگراد، در امپلیکونی به طول ۲۰۰ جفت باز میباشد و به ترکیب بازهای توالی آن بستگی دارد. درست در زیر Tm، دمای حیاتی دناتوراسیون (critical denaturation temperature) یا Tc قرار دارد که در آن کارایی PCR، به علت وجود تعداد محدودی از امپلیکونهای دناتورهشده، به طور ناگهانی دچار افت میشود. به عبارت دیگر، امپلیکونهایی که حتی تنها در یک نوکلئوتید با یکدیگر تفاوت دارند، طی PCR و در صورت اعمال دمای Tc، کارایی تکثیر متفاوتی خواهند داشت. این تفاوت در کارایی PCR، میتواند به منظور تکثیر انتخابی اللهای کمیابی که تنها در حد یک یا چند نوکلئوتید با توالی داده شده تفاوت دارند، مورد استفاده قرار گیرند.
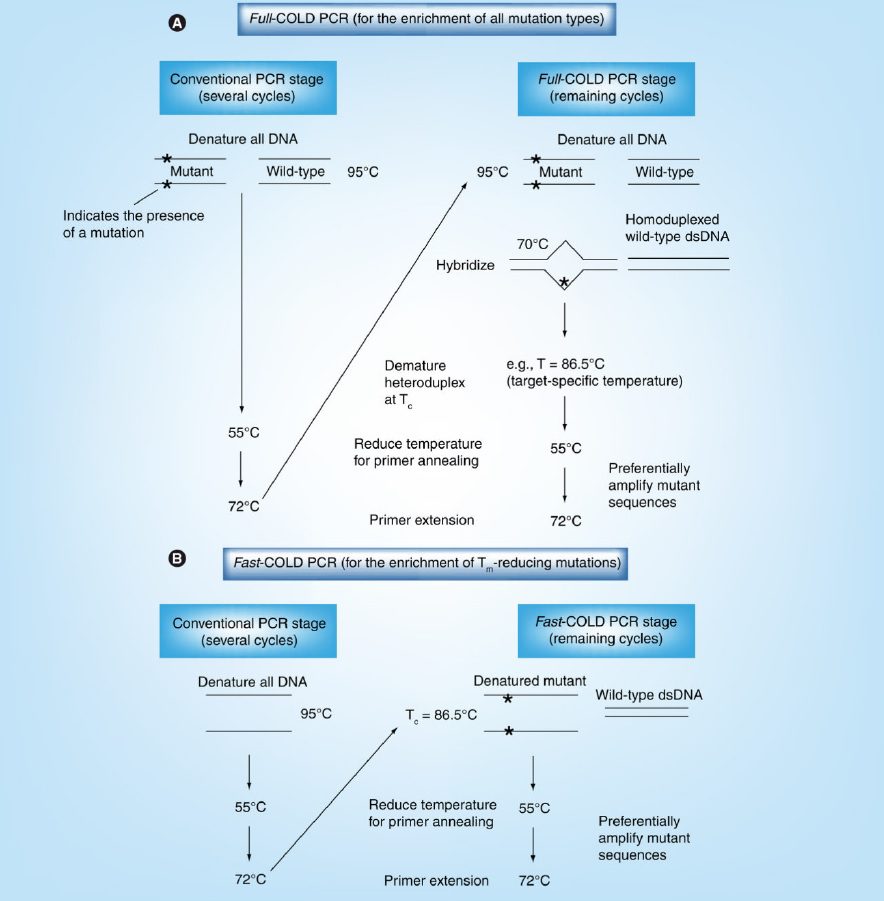
COLD-PCR، بسته به اینکه تمام جهشهای ممکن تکثیر شوند، و یا اینکه بالاترین درجه غنیسازی جهش صورت بگیرد، در دو فرم اصلی اعمال میشود: full-COLD-PCR و fast- COLD-PCR. تصمیمگیری در مورد نوع تکنیک، بستگی به نوع جهش موردمطالعه و هدف از پروژه دارد.
full-COLD-PCR، دارای پروتکلی ۵ مرحلهای است و شامل این مراحل میباشد: مرحله دناتوراسیون استاندارد، مرحله هیبریداسیون، مرحله دناتوراسیون حیاتی در Tc تعریفشده، مرحله اتصال پرایمر و مرحله گسترش. مرحله هیبریداسیون حد واسط در دمای ۷۰.۰–۷۲.۰ °C و در طی چرخه PCR، به منظور هیبریداسیون متقاطع میان اللهای موتانت و وایلدتایپ صورت میگیرد و طی آن هترودوپلکس تشکیل میشود.
هترودوپلکسها نسبت به هومودوپلکسها پایداری کمتری دارند؛ درنتیجه دمای دناتوراسیون ساختار کاهش مییابد. این ویژگی میتواند به منظور دناتوراسیون انتخابی این ساختارها طی PCR به کار گرفته شود؛ به این صورت که با تنظیم دمای دناتوراسیون روی Tc، اکثریت مولکولهای هترودوپلکس دناتوره شده و طی چرخههای بعدی تکثیر میگردند. این در حالی است که مولکولهای هومودوپلکس دورشتهای باقی میمانند و کارایی تکثیر آنها که حاوی فراوانترین اللها (اللهای وایلدتایپ) نیز هستند، به شدت کاهش پیدا میکند. البته، با استفاده از Tc به جای دمای عادی دناتوراسیون(۹۵.۰–۹۸.۰ °C)، تمام واریانتهای موجود در هر موقعیتی از امپلیکون موردنظر حین COLD-PCR تکثیر میگردند.
در fast-COLD-PCR، نیازی به مرحله تشکیل هترودوپلکس نیست و از چرخه حرارتی سهمرحلهای استفاده میکنیم. در این حالت، تنظیم دمای دناتوراسیون روی Tc، امپلیکونهایی را تکثیر خواهد کرد که دارای واریانتهای کاهنده Tm هستند (G:C > A:T یا G:C > T:A). به عبارت دیگر، Tm هومودوپلکسهای حاوی جهش، پایینتر از توالی وایلدتایپ میباشد. در هر دو نوع پلتفرم full- و fast-COLD-PCR، از شرایط و غلظتهای مواد اولیه مشابهی با PCR عادی استفاده میشود.
full-COLD-PCR این مزیت را دارد که میتواند تمام جهشهای موجود را غنیسازی کند. با این حال، full-COLD-PCR دارای پروسهای طولانیتر از PCR عادی است و علت آن نیاز به مرحله حدواسط cross-hybridization و تولید هترودوپلکسها است. این تکنیک همچنین میزان غنیسازی متوسطی دارد که علت آن، در تشکیل هترودوپلکسها است و در full-COLD-PCR تنها در ۱۰-۱۵ چرخه آخر (پیش از رسیدن واکنش به درجه اشباع) کارا میباشد. در مقابل، fast-COLD-PCR دارای سرعت بیشتر و میزان غنیسازی بالاتری است؛ با این حال، این پلتفرم تنها جهشهایی را غنیسازی میکند که Tm را کاهش میدهند.
به منظور رفع این مشکلات و ترکیب خصوصیات دو پلتفرم اصلی با یکدیگر، ice-COLD-PCR (improved and complete enrichment) به کار میرود که میتواند تمام انواع جهش را به طرز موثر و کاملی غنیسازی نماید. در این تکنیک زمان هیبریداسیون کوتاهتر و پتانسیل غنیسازی بیشتر شده است.
ice-COLD-PCR از الیگونوکلئوتید سنتتیک و تکرشتهای که اختصاصی الل وایلدتایپی به نام توالی مرجع است، بهره میگیرد. این توالی در مقادیر بالا به واکنش افزوده میشود و با اتصال به توالی الگوی وایلدتایپ، تکثیر آن را مهار میکند. توالی مرجع مورد استفاده حاوی گروه فسفات در سمت ۳’ است که مانع از وقوع مرحله گسترش در حین PCR میگردد. این الیگونوکلئوتید تنها کمی کوتاهتر از امپلیکون است؛ در نتیجه محل اتصال پرایمر مسدود شده و از تکثیر الل وایلدتایپ پیشگیری به عمل میآید. بهتر است پلیمراز مورداستفاده فاقد فعالیت اگزونوکلئازی ۵’ به ۳’ باشد تا هم از خطاهای PCR و هم از مشکلات احتمالی ناشی از توالی مرجع پیشگیری به عمل آید.
در این تکنیک، برنامه چرخه حرارتی مشابه full-COLD-PCR و پنج مرحلهای است. در این حالت، مقادیر بالای الیگونوکلئوتیدهای افزودهشده، به سایر اللهای وایلدتایپ موجود در نمونه متصل میشوند و به این نحو تکثیر این اللها مهار میگردد؛ این در حالی است که اعمال دمای Tc، به صورت ترجیحی هترودوپلکس متشکل از الل جهشیافته را دناتوره کرده و با تکثیر آن حین PCR، باعث غنیسازی اللهای موتانت و کمیاب موردنظر میشود.
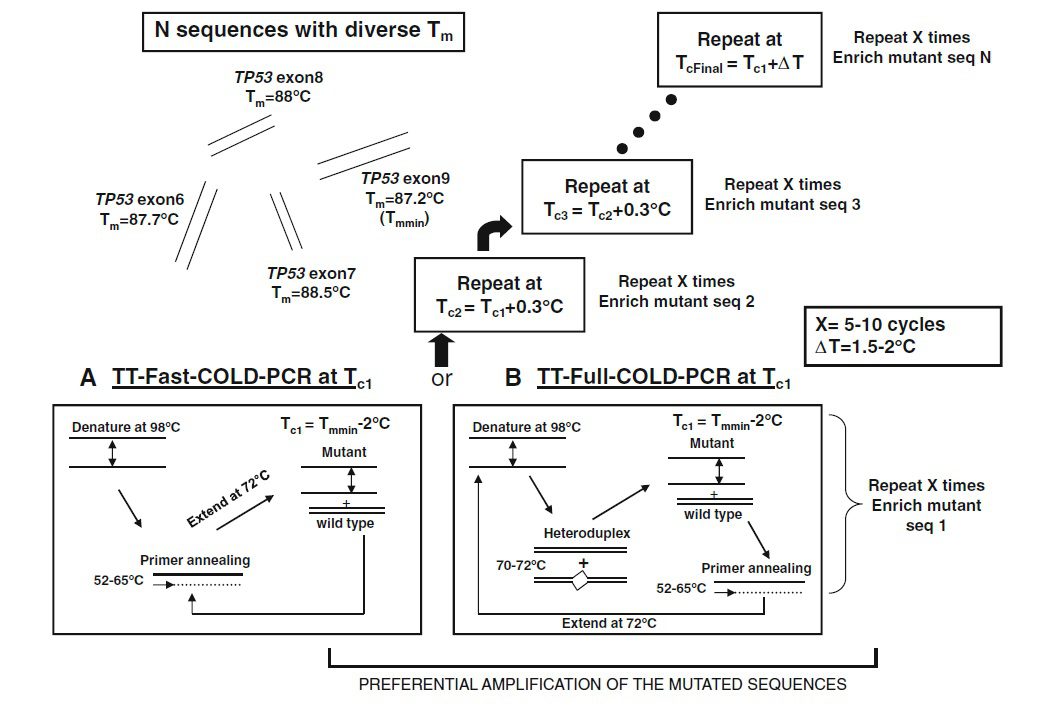
نسخه دیگر COLD-PCR، COLD-PCR مقاوم به حرارت یا TT COLD-PCR است که نیازی به تعیین دقیق Tc ندارد و در نتیجه میتواند اهداف متنوعی را با استفاده از تنها یک برنامه برای چرخهها غنیسازی کند. طی این تکنیک، Tc به تدریج افزایش پیدا میکند و پروتکل این افزایش، اعمال بازه کوچک تغییر دما در حد ۱.۵–۳.۰ °C و در فواصل کوچکی مانند ۰.۳ °C است. این شیوه تغییر دما، غنیسازی جهشهایی که دمای دناتوراسیون آنها طی واکنش و به تدریج فرا میرسد را باعث می شود. میزان دقیق این بازه به محدودیت تجهیزات مورداستفاده، سیستم پلیمراز و تشکیل دایمرهای پرایمر بستگی دارد. این پروتکل چرخه حرارتی، برای تمام انواع COLD-PCR مطرح شده، قابل استفاده است و امکان غنیسازی تمام انواع جهشها را فراهم میسازد.
این تکنیک نیز مانند تمام تکنیکهای بررسی جهشها نیازمند DNA باکیفیت است. لازم به ذکر است که برای تمام انواع COLD-PCR باید کنترل دقیقی روی Tc به منظور به حداکثر رساندن غنیسازی انجام گیرد. از آنجایی که COLD-PCR به منظور غنیسازی واریانتهای اللی مینور در فرایند PCR طراحی شده است، هر گونه آلودگی نمونه میتواند با واکنش تداخل کرده و یا غنیسازی شود. به عنوان مثال، نگهداری نمونههای تومور در پارافین، ممکن است منجر به آسیب DNA و نتیجه مثبت کاذب شود.
تستهای متاخر بر COLD-PCR
پس از غنیسازی توسط COLD-PCR، میتوان از متدهای فراوانی میتوانند به منظور شناسایی اللهای مینور غنیشده استفاده نمود. این تکنیکها ممکن است در ترکیب با COLD-PCR (به عنوان مثال، real-time COLD-PCR) و یا به دنبال انجام شوند. نوع تست انتخاب شده بستگی به حساسیت تشخیصی موردنیاز و میزان در دسترس بودن تجهیزات دارد. برخی از این تستها عبارتند از:
- توالی یابی سانگر: این تکنیک برای آنالیز هر دو نوع جهشهای شناخته شده و ناشناخته به کار میرود و میتواند درجه تقریبی غنیسازی را نشان دهد. توالییابی سانگر در بررسی جهشهای لایه زایا و یا جهشهای سوماتیک معمول دارای کاربرد بوده و به طور گسترده ای در دسترس است. اما در صورتی که به تنهایی به کار رود، تنها میتواند وجود حدود ۱۰ تا ۲۰ درصد اللهای جهشیافته در زمینهای از اللهای وایلدتایپ را شناسایی نماید. حساسیت این تشخیص در صورت استفاده پس از یک یا دو دور متوالی COLD-PCR به جای PCR عادی، میتواند ۵ تا ۱۰۰ برابر شود.
- Pyrosequencing: این روش به منظور اسکن هر دو نوع جهشهای شناختهشده و ناشناخته استفاده میشود. حساسیت تشخیصی آن در حدود شناسایی وجود ۵ تا ۱۰ درصد اللهای موتانت در زمینه ای از اللهای وایلدتایپ است. اعمال COLD-PCR پیش از این نوع توالییابی میتواند حساسیت آن را ۵ تا ۳۵ برابر نماید.
- تعیین ژنوتیپ MALDI-TOF: این تکنیک، در موارد تشخیص جهشهای شناخته شده با ظرفیت ورودی بالا مورد استفاده قرار میگیرد. حساسیت تشخیصی در حدود وجود ۵-۱۰ درصد اللهای جهشیافته در زمینهای از DNA وایلدتایپ است. ترکیب fast- COLD-PCR با MALDI-TOF، این توانایی را ۱۰ تا ۱۰۰ برابر میکند.
- تعیین ژنوتیپ TaqMan: این تکنیک به منظور تعیین ژنوتیپ و بررسی کمی جهشهای شناخته شده مورد استفاده قرار میگیرد. حساسیت تشخیصی این تکنیک در حدود وجود ۱۰ درصد اللهای جهشیافته در زمینهای از اللهای وایلدتایپ است. ترکیب این مت با COLD-PCR قدرت تشخیصی این تکنیک را تا حدود ۰.۸ درصد DNA موتانت در زمینهای از DNA وایلدتایپ و شرایط fast-COLD-PCR و تا حدود ۰.۱ درصد پس از دو راند COLD-PCR-TaqMan افزایش میدهد.
- High resolution melting (HRM): این تکنیک به منظور آنالیز سریع جهشها با مقادیر ورودی بالا به کار میرود و نشاندهنده پروفایلهای ذوب تغییریافته نسبت به حالت توالی وایلدتایپ میباشد. محدوده تشخیصی بستگی فراوانی به امپلیکون دارد. با این حال، COLD-PCR محدوده تشخیصی را بهبود میبخشد و مهمتر آنکه امکان تعیین توالی واریانت DNA موردنظر را فراهم میکند. بهکارگیری COLD-PCR پیش از آنالیز HRM به جای چرخه استاندارد PCR میتواند حتی تا حدود ۰.۱ درصد اللهای موتانت موجود در زمینهای از DNA وایلدتایپ را شناسایی کند.
- توالی یابی نسل جدید (NGS): حساسیت گزارششده در مورد این تکنیک، در حدود ۲ درصد است. غنیسازی مقادیر اندک جهشها توسط COLD-PCR و پیش از NGS، حساسیت را تا حد شناسایی ۰.۰۲ درصد اللهای جهشیافته بالا میبرد.