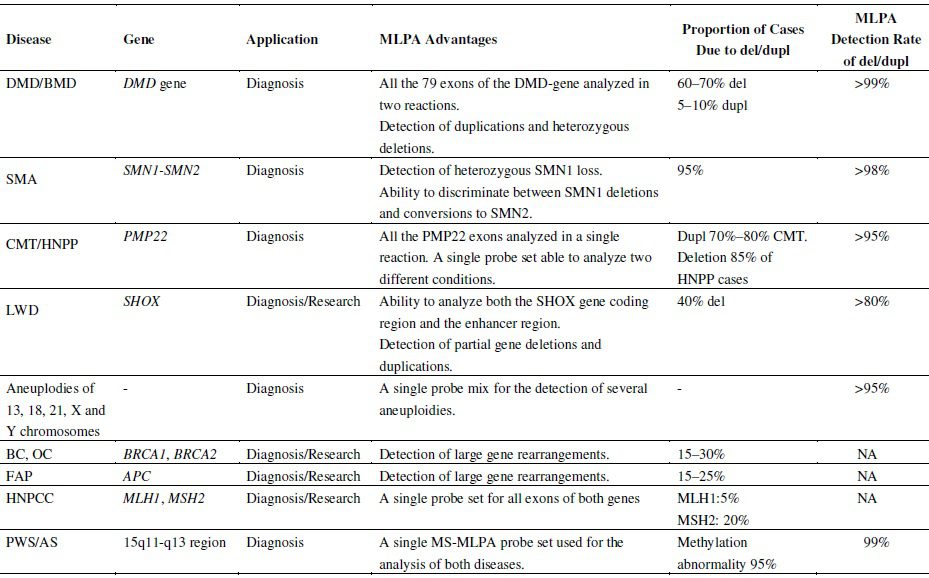
MLPA (Multiplex Ligation-dependent Probe Amplification) ، نوعی متد مولکولی است که در سال ۲۰۰۲ توسط MRC-Holland ایجاد شد. MLPA تکنیکی ساده و قدرتمند بوده و از انواع متدهای multiplex PCR است که امکان سنجش کمی توالیهای نوکلئیکاسیدی را با سرعت و کارایی بالایی فراهم میکند. این تکنیک حتی قادر به افتراق میان توالیهایی است که در تنها یک نوکلئوتید با یکدیگر تفاوت دارند. MLPA به منظور تشخیص تعداد کپیهای غیرعادی ژنها (copy number) مانند جهشهای حذف و مضاعفشدن، تعیین وضعیت متیلاسیون DNA، تعیین SNPها و جهشهای نقطهای و بررسی کمی mRNA به کار میرود؛ به طوریکه میتواند بیش از ۵۰ نوع توالی DNA یا RNA ژنومی را به صورت همزمان آنالیز کند.
مقالات مرتبط:
- معرفی تکنیک Ligation-mediated PCR
- معرفی تکنیک Methylation-specific PCR
- هر آنچه باید در مورد PCR بدانید!
- پرایمرها در PCR
در طی سالهای اخیر تکنیک MLPA به یکی از پرکاربردترین تکنیکهای مولکولی در زمینه بررسی بیماریهای ژنتیکی شده است. علت کاربرد وسیع این تکنیک، مزایای فراوانی است که در مقایسه با سایر تکنیکها به دست میدهد. انجام این تکنیک هزینه پایینی نسبت به تکنیکهایی مانند array CGH داشته و پیچیدگی کمتری را داراست. تاکنون بیش از ۳۰۰ مجموعه پروب به صورت تجاری در دسترس بوده و در مطالعه بیماریهای انسانی بسیاری به کار میروند. به علت گستردگی بیماریهایی که در تشخیص آنها میتوان از MLPA استفاده کرد، پیشبینی میشود که این تکنیک، در آیندهای نزدیک به تکنیکی اساسی در آنالیز مولکولی اختلالات ژنتیکی و تایید و تشخیص آزمایشگاهی آنها تبدیل شود.
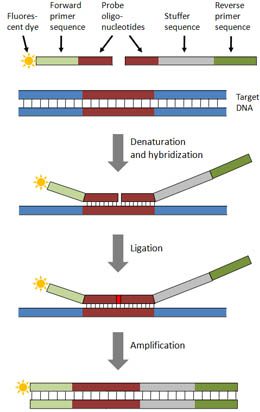
واکنش MLPA
در واکنش MLPA، این توالیهای هدف نیستند که تکثیر میشوند، بلکه پروبهایی که به آن هیبرید میشوند، مورد تکثیر قرار میگیرند تا تعداد نسبی کپیهای موجود از ژنهای موردبررسی مشخص شود. همانطور که از نام این تکنیک بر میآید، وقوع واکنش تکثیر پروب بستگی به مرحله ligation دارد. محصولات واکنش تکثیر توسط الکتروفورز مویرگی آنالیز میشوند. مقایسه الگوی پیکهای تهیه شده از نمونه تستشده با نمونه مرجع، نوع توالی دارای نقص در تعداد کپی را معلوم خواهد کرد. به منظور رسیدن به این اهداف، پنج مرحله زیر انجام خواهند شد:
- دناتوراسیون DNA و هیبریداسیون پروبهای MLPA
- واکنش ligation
- واکنش PCR
- تفکیک محصولات تکثیر از یکدیگر به کمک الکتروفورز
- آنالیز دادهها
مرحله اول: دناتوراسیون DNA و هیبریداسیون
طی این مرحله، DNA دناتوره شده و به صورت overnight با مخلوطی از پروبهای MLPA انکوبه میشود. هر پروب MLPA متشکل از دو الیگونوکلئوتید جدا از هم است که half-probe (5′ and 3′ half-probes) نام دارند. هر کدام از پروبها، حاوی یکی از توالیهای متصلشونده به پرایمر و توالی اختصاصی هدف میباشند. توالیهای هدف معمولا اگزونی خاص در ژن موردنظر هستند. تمام پروبهای مختلف مورداستفاده در یک واکنش MLPA، دارای توالی یکسانی به منظور اتصال پرایمر میباشند که امکان مالتیپلکس کردن واکنش و تکثیر همزمان کل پروبها را فراهم میکند.
طی هیبریداسیون، DNA الگو با این پروبها هیبرید شده و دو الیگونوکلئوتید مربوط به پروب، دقیقا در مجاورت همدیگر و روی یک رشته، به توالی هدف متصل میگردند. یکی از دو نیمپروب مورداستفاده و یا هر دوی آنها، دارای توالی stuffer است که در نواحی هدف مختلف، طول متفاوتی دارد. همین موضوع است که امکان multiplexing را فراهم میکند و باعث میشود که محصولات تولیدشده حین الکتروفورز از همدیگر متمایز شوند. از آنجایی که MLPA تکنیکی مالتیپلکس است، میتوان آنالیز هر نمونه را به صورت همزمان با بیش از ۶۰ پروب انجام داد و چندین ناحیه را هدفگیری کرد. لازم به ذکر است که
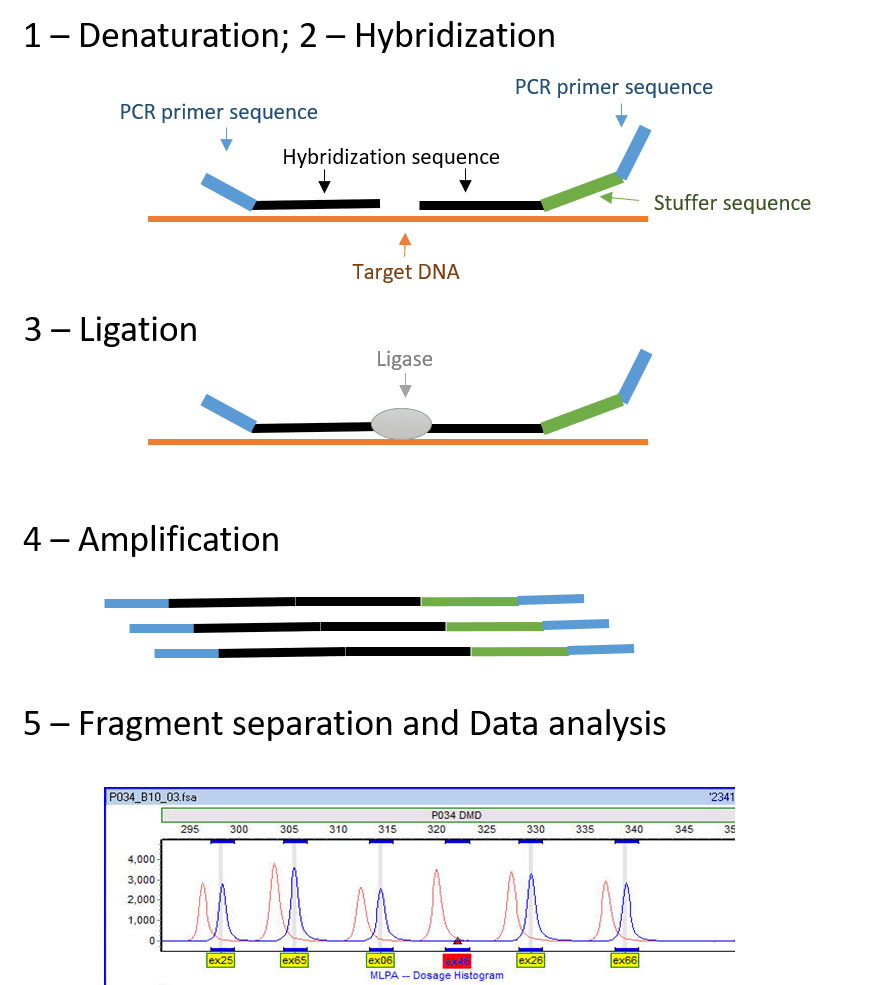
مرحله دوم: واکنش ligation
این مرحله باعث اتصال (ligation) دو پرایمر به یکدیگر میشود. واکنش ligation تنها زمانی تحت تاثیر آنزیم DNA لیگاز میتواند رخ دهد که هر دو پروب الیگونوکلئوتیدی به توالیهایی مجاور هم هیبرید شده باشند. لیگاز مورداستفاده، ligase-65 نام دارد که آنزیمی وابسته به NAD است. حال سوال این جاست که اگر هدف اتصال پروبها به همدیگر است، چرا از ابتدا از دو پروب جداگانه استفاده میکنیم؟
همان طور که گفته شد، هر دو پروب دارای جایگاههایی برای اتصال به پرایمر هستند. پس اگر این پروبها از ابتدا مولکولهایی واحد بودند، حتی در صورت نبود DNA هدف نیز تکثیر میشدند و تکثیر غیراختصاصی انجام میگرفت. آنزیم لیگاز شدیدا اختصاصی عمل میکند. در صورت وجود کوچکترین mismatch بین پروب و توالی هدف، لیگاز قادر به اتصال پروبها نبوده و تکثیر انجام نخواهد شد. درنتیجه، MLPA قدرت تشخیص جهشهای نقطهای را داشته و حتی ژنهای هدف واقعی و سودوژنها را از یکدیگر افتراق میدهد.
مرحله سوم: واکنش PCR
این مرحله نیازمند آنزیم پلیمراز، dNTPها و پرایمرهای forward و reverse است. تکثیر نمایی تنها در مورد پروبهایی اتفاق میافتد که توسط پیوند کووالانسی به یکدیگر متصل شده باشند (واکنش ligation). همانطور که گفته شد، از آنجایی که تمام پروبها دارای توالی مشترکی برای اتصال پرایمر هستند، بر خلاف multiplex PCR استاندارد، در MLPA تنها یک جفت پرایمر به کار میرود. درنتیجه افزودن تنها یک مجموعه پرایمری برای مطالعه تمامی توالیهای هدف کافی است و MLPA فاقد محدودیتهای متداول ناشی از این موضوع که در multiplex PCR استاندرد وجود دارد، میباشد.
چون مقدار محصول تولیشده در اثر PCR، نسبت مستقیم با مقدار DNA هدف اولیه موجود در نمونه دارد، تعداد محصولاتی که از پروبهای متصلشده ایجاد میشوند، معیاری برای سنجش تعداد توالیهای هدف موجود در نمونه است. محصولات واکنش تکثیر در کیتهای SALSA MLPA بین ۱۳۰ تا ۴۸۰ نوکلئوتید طول دارند. پرایمر forward با مواد فلورسنت لیبل میشود تا امکان بررسیهای کمی و مشاهده نتایج حین آنالیز فراهم شود.

مرحله چهارم: الکتروفورز مویرگی
محصولات تکثیر توسط الکتروفورز مویرگی در ژل دناتورهکننده بر اساس اندازه از یکدیگر تفکیک شده و تفاوت طولها به صورت الگویی از پیکها که الکتروفروگرام نام دارد، نمایش داده میشود. امپلیکونها دارای طولهایی معین و متفاوت هستند که به علت توالی stuffer موجود در هر پروب خاص ایجاد میگردد و امکان آنالیز کمی را فراهم میکند.
مرحله پنجم: تحلیل دادهها
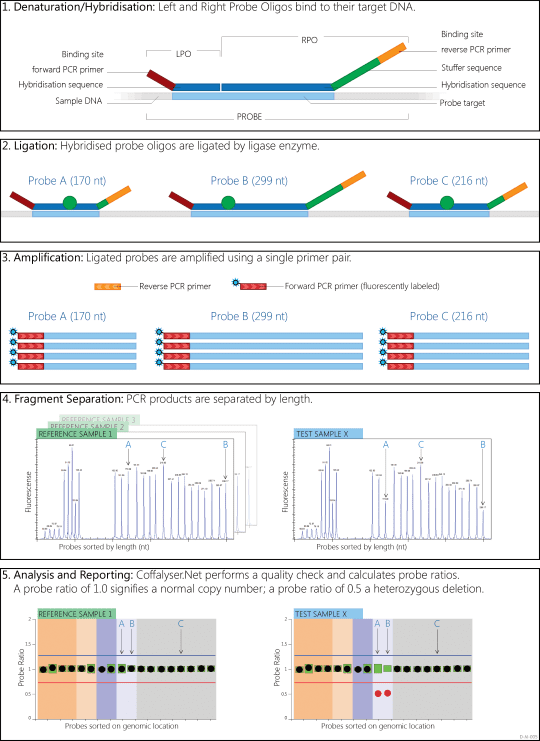
پروبهای الیگونوکلئوتیدی که به یکدیگر متصل نشده باشند، تنها حاوی یکی از پرایمرها هستند. درنتیجه به جای تکثیر نمایی، این پروبها به صورت خطی تکثیر شده و سیگنالی ایجاد نخواهند کرد. از این رو، جداسازی و از بین بردن پروبهای متصل نشده در MLPA لازم نیست و همین امر است که باعث سهولت استفاده از آن میگردد. با نرمالیزاسیون مقایسه هر نمونه با مجموعهای از نمونههای مرجع، میتوان probe ratio را به دست آورد که مقدار DNA هدف موجود در نمونه را به طور نسبی مشخص میکند. این نسبت، تعداد کپیهای موجود از هر ژن را به دست میدهد. کیفیت واکنش با تعیین پیکهای کنترل ارزیابی میشود و اطلاعاتی را در مورد کارایی واکنش فراهم میکند.
از آنجایی که ژنهای انسانی دیپلوئید هستند، در صورتیکه دو نسخه در نمونه موجود باشد، نسبت ۱.۰ خواهد بود. معنی این نسبت آن است که پروبهای موجود در نمونه باعث ایجاد تعداد ژنهای یکسانی با نمونه مرجع شدهاند. اگر نسبت، ۰.۵ باشد، تنها یک نسخه از ژن در فرد وجود دارد که احتمالا به معنی حذف هتروزیگوتی ژن هدف است. برعکس، اگر نسبت ۱.۵ باشد، ممکن است مضاعفشدگی هتروزیگوتی رخ داده باشد.
تفسیر نتایج MLPA یکی از حیاتیترین فرایندها در استفاده از آن به عنوان یک تست ژنتیکی میباشد. حذفهای هوموزیگوس یا همیزیگوس به سادگی با تشخیص حضور یا نبود پیکهایی خاص در ژن هدف، در صورت تکثیر نرمال پروبهای کنترل تشخیص داده میشوند. از سویی دیگر حذفهای هتروزیگوتی و مضاعفشدگیها پیکهایی با ارتفاع یا مکان قرارگیری متفاوت ایجاد میکنند. تفسیر نتایج در این موارد در صورت حضور واکنشهای PCR با کارایی متفاوت در پروبها و نمونههای مختلف، چالشبرانگیز خواهد بود. درنتیجه استراتژیهای مختلفی به منظور آنالیز دادههای MLPA توسعه پیدا کردهاند تا از دادههای خام واکنش تفسیر درستتری برداشت شود. پرکاربردترین این نرمافزارها، Coffalyser است که برنامهای بر پایه excel بوده و تمام مراحل نرمالیزاسیون دادهها و اصلاح دادههای sloping را انجام میدهد.
واریانتهای MLPA
MLPA دارای تعداد اندکی از واریانتها است. RT-MLPA میتواند به منظور تهیه پروفایل mRNAها استفاده شود. آنزیم لیگاز قادر به اتصال پروبهایی نیست که به مولکول RNA متصل شدهاند. از این رو، واکنش RT-MLPA با رونوشتبرداری معکوس mRNA و تبدیل آن به cDNA انجام میگیرد. پس از این مرحله، بقیه واکنش همانند واکنش MLPA عادی انجام میشود. واریانت دیگر، MS-MLPA (Methylation-Specific MLPA) است که به منظور تعیین کمی تعداد کپیها و نیز تهیه پروفایل متیلاسیون انجام میگیرد. این متد در تشخیص بیماریهای مربوط به حکگذاری و نیز آنالیز نقایص مربوط به متیلاسیون در نمونههای توموری بسیار مفید میباشد.
تکنیک MS-MLPA
Methylation-specific MLPA (MS-MLPA) متدی نیمه-کمی برای تهیه پروفایل متیلاسیون است. در این تکنیک، تعیین تعداد کپی در ترکیب با استفاده از آنزیم محدودکننده حساس به متیلاسیون انجام میشود. امروزه از MS-MLPA در تعیین تغییرات اپیژنتیکی استفاده میشود. یکی از مهمترین کاربردهای این تکنیک تشخیص بیماریهای مربوط به حکگذاری ژنومی مانند بیماری پرادرویلی/آنجلمن و سندروم بکویت-ویدمان/RSS میباشد. MS-MLPA به طور گستردهای در آنالیز تومورها و بررسی غیرفعال شدن ژنهای سرکوبکننده تومور حین رونویسی، که میتواند منجر به پیشرفت تومور و مقاومت به داروهای شیمیدرمانی میشود، به کار میرود. تشخیص نقصهای موجود در الگوی متیلاسیون میتواند به منظور بررسی دقیقتر نوع تومور استفاده شود.
پروتکل MS-MLPA بسیار شبیه متد استاندارد MLPA است. تفاوت در آن است که هر واکنش MS-MLPA دو نمونه را ایجاد میکند: نمونه تجزیه نشده برای تعیین تعداد کپی و نمونه تجزیه شده به منظور تشخیص متیلاسیون. فرایند MS-MLPA دارای پنج مرحله است:
- دناتوراسیون DNA و هیبریداسیون پروبهای MLPA
- واکنش ligation و تجزیه توسط آنزیم محدودکننده
- واکنش PCR
- تفکیک محصولات تکثیری توسط الکتروفورز مویرگی
- آنالیز دادهها
پروبهای MS-MLPA مورداستفاده برای واکنشهای تشخیص متیلاسیون، مشابه سایر پروبهای MLPA هستند، اما توالی هدف آنها حاوی جایگاه تشخیص اندونوکلئاز حساس به متیلاسیون HhaI میباشد. پس از هیبریداسیون، واکنش به دو لوله جداگانه تقسیم میشود. در یکی از لولهها، واکنش MLPA استاندارد انجام گرفته و اطلاعاتی را در مورد تغییرات در تعداد کپیها فراهم میکند. در لوله دیگر، انکوباسیون با اندونوکلئاز HhaI همزمان با ligation پروبهای هیبریدشده انجام میشود. هیبرید تشکیلشده میان پروبها و نمونه DNA غیرمتیله توسط آنزیم محدودکننده HhaI تجزیه میگردد. پروبهای تجزیه شده نمیتوانند توسط PCR به صورت نمایی تکثیر شوند و درنتیجه حین الکتروفورز مویرگی سیگنالی از آنها حاصل نخواهد شد. در مقابل، اگر نمونه DNA متیله باشد، هیبریدهای پروب-DNA در برابر تجزیه توسط HhaI مقاوم بوده و پروبهای ligate شده، پس از الکتروفورز ایجاد پیک خواهند کرد.
مزایا و معایب MLPA
MLPA تکنیکی با حساسیت و ظرفیت ورودی بالا است. این تکنیک میتواند جهشهای نقطهای، حذفی و مضاعفشدگی را از یکدیگر به خوبی افتراق دهد. در نتیجه استفاده از MLPA در تشخیص تعداد کپیها نسبت به استفاده از تکنیکهای دیگر، مزایای فراوانی دارد. نخست، متدهایی که برای اولین بار به منظور تشخیص جهشهای نقطهای به کار گرفته شدند، مانند توالییابی و DHPLC، معمولا در تعیین تعداد کپیها ناتوان هستند. از سوی دیگر، آنالیز ساترن بلاتینگ بسیاری از نقصها را آشکار میکند، اما همیشه نمیتواند جهشهای کوچک را تشخیص دهد و برای استفاده به عنوان یک تکنیک روتین ناکارآمد است. با اینکه PCR میتواند جهشهای شناختهشده را به خوبی تشخیص دهد، محل دقیق جهش در بسیاری از موارد مشخص نخواهد شد.
اگر MLPA را با FISH مقایسه کنیم، MLPA علاوه بر مزیت مالتیپلکس بودن، توالیهای هدف بسیار کوچکتری هم دارد (۵۰-۷۰ نوکلئوتید). این امر MPLA را قادر میسازد که نقصهای تکژنی مکرر در ژنوم را که کوچکتر از آنند که توسط FISH تشخیص داده شوند، شناسایی کند. به علاوه، MLPA قابل استفاده در مورد DNA خالصشده نیز میباشد. در نهایت، MLPA در مقایسه با array CGH، هزینه کمتری داشته و از لحاظ تکنیکی پیچیدگی کمتری دارد.
تکنیک MLPA به سادگی انجام شده و از آنجایی که تنها تجهیزات موردنیاز آن، ترموسایکلر و الکتروفورز مویرگی است، میتواند در بسیاری از کارهای پژوهشی و فیلدهای تشخیصی مانند سیتوژنتیک، تحقیقات سرطان و ژنتیک انسانی استفاده شود. طی این تکنیک بیش از ۹۶ نمونه میتوانند به صورت همزمان آنالیز شده و نتایج، تا ۲۴ ساعت حاضر گردند. در بسیاری از بیماریهای ارثی، جهشهای حذفی و مضاعف شدنها تنها ۱۰ درصد از کل جهشها را تشکیل میدهند. این میزان در بسیاری از اختلالات ژنتیکی دیگر، ۱۰ تا ۳۰ درصد و یا حتی بیشتر است. درنتیجه، استفاده از MLPA در مجموعههای تشخیصی بالینی میتواند به طرز چشمگیری میزان تشخیص بیماریهای ژنتیکی را بالا برد. همچنین این تکنیک میتواند روی DNA استخراجشده از سواپ بزاقی نیز انجام بگیرد که نسبت به نمونهبرداری و بررسی خون محیطی بسیار آسانتر است.
ایجاد تغییراتی کوچک در پروتکل MLPA میتواند امکان استفاده از آن را در انواع مختلفی از شرایط فراهم کند. به عنوان مثال، با افزودن مرحله هضم آنزیمی توسط آنزیم محدودکننده، MLPA میتواند در شناسایی الگوی متیلاسیون DNA به کار رود. با اینکه MLPA در غربالگریهایی که روی کل ژنوم انجام میگیرد، کاربرد ندارد، جایگزین مناسبی برای تکنیکهای array-based در بسیاری از کاربردهای روتین آن است. امروزه بیش از ۳۰۰ مجموعه پروب به صورت تجاری در دسترس بوده و از موارد نسبتا شایع (Duchenne, DiGeorge syndrome, SMA) تا نقایص بسیار نادر (hereditary pancreatitis, Antithrombin deficiency, Birt-Hogg-Dube syndrome) به کار میرود.
MLPA نسبت به ناخالصیها بسیار حساس است و به همین علت آمادهسازی نمونه و انجام تکنیک باید با احتیاط کامل انجام گیرد. به عنوان مثال، نحوه تهیه نمونه DNA برای استخراج (خون، دهان، …) بسیار مهم میباشد. از این رو توصیه میشود که آنالیزهای MLPA مختلف تنها بین آنهایی مقایسه شود که از بافتی یکسان و با متدی یکسان تهیه شدهاند. این تکنیک به مواد آلودهکننده واکنش مانند مهارکنندههای PCR و تجزیه DNA نیز دارای میزان بالایی از حساسیت میباشد. همچنین ممکن است در سیگنال تولیدشده توسط پروب کاهشی وجود داشته باشد که احتمالا به علت پلیمورفیسمهای نادر و یا جهشها ایجاد میشود. به همین علت، ممکن است نیاز به تست نمونه با تکنیکهای دیگری نیز باشد.