در این پست، به معرفی رویکردهای متنوع برای بازیابی حس بینایی در افراد مبتلا به تحلیل شبکیه و اختلالات عملکردی آن خواهیم پرداخت. بطور کلی، فقدان حس بینایی به ۳ دسته تقسیم میشود که هر دسته به رویکردهای متنوعی برای بازیابی نیازمند است:
دسته اول: تمامی نورونها حاضر هستند، ولی از عملکرد مناسب بعنوان یکی از اجزای حس بینایی، مانند فرآیند انتقال سیگنال نوری، برخوردار نیستند. برای بازیابی عملکرد بینایی، تنها این نقص به خصوص نیاز به اصلاح دارد.
دسته دوم: فرآیند دژنراتیو، از ابتدا بصورت تهاجمی بوده و در اغلب موارد در طی دههها، ساختار و عملکرد فوتورسپتورها را تغییر میدهد. سلامت کلی گروههای سلولی تحت تاثیر دژنراسیون باید برای آهستهتر ساختن یا توقف این روند، مورد توجه قرار گیرد.
دسته سوم: سلولهای فوتورسپتور بصورت کامل از بین بروند. در این موارد، جایگزینی سلولها و/ یا عملکرد آنها تنها درمان ممکن است.
شرایط مختلف نقص حس بینایی
نوع اول: بیماریهای شبکیهای وراثتی که فوتورسپتورها بصورت “آهسته” از بین میروند (به بیان دیگر، از نظر ساختاری و عملکردی دچار تغییر میشوند)، ولی عملکرد خود را بمدت ۳ تا ۵ دهه در طول زندگی، حفظ میکنند (مانند رتینیت پیگمنتوزا؛ RP). گزینههای درمانی: ژن درمانی، عوامل نوروپروتکتیو.
نوع دوم: اختلال عملکرد شبکیهای مادرزادی بدلیل نقص منفرد در آبشار انتقال سیگنال نوری یا چرخهی بینایی مانند حالتی که در آکروماتوپسی، بیماریهای مرتبط با کانالهای یونی، یا جهشهای RetGC1 رخ میدهد. در این شرایط، سلولهای مخروطی و استوانهای در ابتدای زندگی سالم هستند. با اینکه سلولهای مخروطی یا استوانهای فعالیت نمیکنند، شبکیه ممکن است در دهههای متعدد زندگی، سالم بنظر برسد. هیچ شبکهی نورونی در این حالات ابتدایی بصورت قشری تشکیل نشده و بهمین دلیل، پیامد درمانی محدود است. گزینههای درمانی: فعلاسازی “سوئیچ نوری” توسط ژن درمانی.
نوع سوم: نقص ژنتیکی باعث دژنراسیون فوتورسپتورهایی میشود که دچار تغییر ساختاری و عملکرد شدهاند، و نهایتا از بین میروند. با این حال، این سلولها ممکن است عملکرد مفید خود را در طول دهههای متعدد زندگی حفظ کنند. این دسته از دیستروفیهای استوانهای-مخروطی تحت عنوان رتینیت پیگمنتوزا (RP) نیز شناخته میشوند. گزینههای درمانی: ژن درمانی، عوامل نوروپروتکتیو، اپتوژنتیک.
نوع چهارم: سلولهای استوانهای و مخروطی تقریبا بطور کامل در ابتدای زندگی از بین میروند و نابینایی را سبب میشوند، مانند شرایطی که در آماروز مادرزادی لبر (LCA) و دیستروفیهای شبکیهای حاد با شروع زود هنگام (EOSRD) پدید میآید. گزینههای درمانی: اپتوژنتیک سلولهای شبکیهای درونی، سلولهای بنیادی: در مواردی که بینایی نسبی در سالهای ابتدایی زندگی وجود دارد، کاشتهای الکترونیکی (اپیرتینال یا ساب رتینال) ممکن است کارگشا باشد.
نوع پنجم: انواع اکتسابی نابینایی شبکیهای با شبکیهی داخلی دست نخورده. گزینههای درمانی: کاشتهای الکترونیکی شبکیهای، سلولهای بنیادی.
نوع ششم: تخریب شبکیه و/ یا فیبرهای عصب بینایی (مانند گلوکوم، رتینوپاتی دیابتیک، جدا شدن شبکیه). گزینههای درمانی: کاشتهای قشری.
نوع هفتم: تخریب قشری (مانند سکته مغزی، تروما). گزینههای درمانی: آرایههای چند الکترودی مرتبط با سنسورهای زبانی.
گزینههای درمانی عمومی: ابزارهای تمرینی بمنظور ارتقای بهره گیری از ورودیهای حسی متنوع، مانند تمرینهای بازتوانی چندگانه.
روشهای مختلف بازیابی بینایی
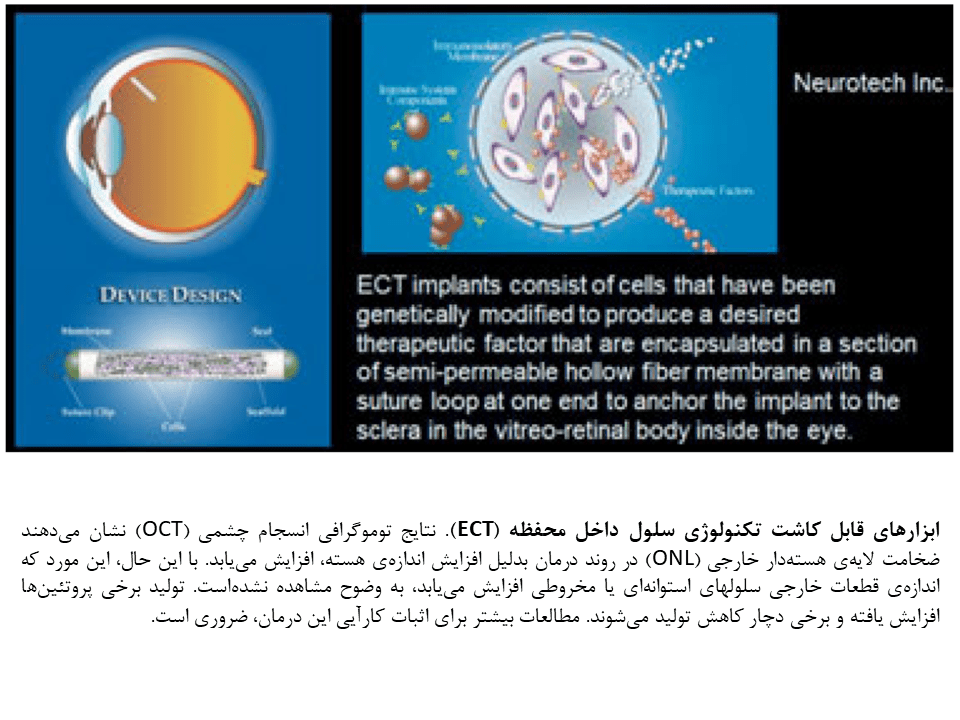
تکنولوژی سلول داخل محفظه (ECT)
مطالعات مختلف نشان دادهاند فاکتورهای رشد متعددی (CNTF، فاکتور رشد عصب مژگانی، BNDF، فاکتور نوروتروفیک مشتق از مغز) میتواند باعث آهستهتر ساختن یا احیای عملکرد فوتورسپتوری شوند.
دانشمندان یک کپسول طراحی کردهاند که حاوی سلولهایی است که CNTF تولید میکنند. این کپسول در درون زجاجیه قرار داده شده و CNTF را در طول ماهها بدون اثر بر مکانیسمهای ایمنی، آزاد میکند. این رویکرد در فاز II و III مطالعات رتینیت پیگمنتوزا و دژنراسیون ماکولار مرتبط با سن قرار دارد.
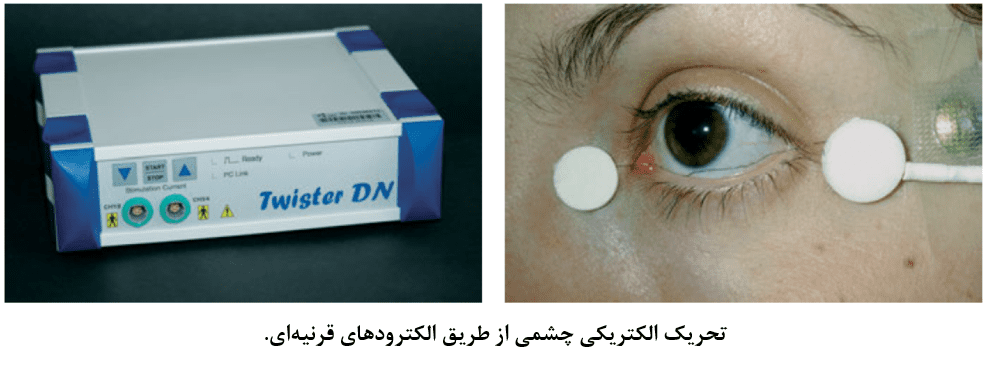
تحریک الکتریکی
مطالعات پیش بالینی و بالینی نشان دادهاند تحریک الکتریکی چشم از طرق الکترودهای قرنیهای میتواند باعث ارتقای دژنراسیون وراثتی شبکیهای شود. دادههایی وجود دارد که نشان میدهد تحریک الکتریکی با فرکانس ۲۰ هرتز بصورت پالسهای دو فازی در بیماران مبتلا به رتینیت پیگمنتوزا میتواند باعث آهستهتر شدن از بین رفتن میدان بینایی گردد. همچنین مطالعات پیش بالینی در بسیاری از گونهها نشان میدهد این نوع تحریک الکتریکی باعث ازادسازی فاکتورهای رشد اندوژن (BNDF، CNTF، و FGF) میگردد که میتوانند بقای نورونها را طولانیتر سازند. اکنون، تجهیزاتی از جمله CE mark برای تحریک هر دو چشم بیماران توسط جریانهای الکتریکی ضعیف وجود دارد. با این حال، دادههای طولانی مدت در حال حاضر در دسترس نیست.
تنظیمکنندههای چرخهی بینایی
رتینوئیدهای صناعی خوراکی برای جایگزین ساختن ۱۱-cis رتینال، یک جزء شیمیایی کلیدی در چرخه رتینوئید بینایی، در موارد کمبود ۱۱-cis رتینال (کمبود RPE65 و کمبود LRAT، که هر دو با دژنراسیون شبکیهای حاد با شروع زود هنگام مرتبط هستند) مورد استفاده قرار میگیرد.
مطالعات بر روی سگ نشان میدهد نقص بیوشیمیایی چرخه رتینوئید (نقص RPE65 یا LRAT) میتواند با مصرف رتینوئیدهای صناعی اصلاح شود. همچنین مطالعات بالینی نتایج امیدوار کنندهای در این زمینه نشان میدهد.
درمان توسط جایگزینی ژن
مطالعات حیوانی و انسانی بسیاری انجام شدهاست که در آنها از وکتورهای ویروسی یا غیر ویروسی برای بازیابی فقدان عملکرد ژن در نتیجهی جهشهای پاتوژنیک استفاده شدهاست. دژنراسیونهای شبکیهای وراثتی مغلوب هدف مناسبی برای درمان توسط این روش میباشند. هدف این رویکرد، جلوگیری از وقوع یا متوقف ساختن فرآیندهای دژنراتیو توسط بازیابی عملکرد فیزیولوژیک طبیعی بافت مورد نظر با بکارگیری ژن نرمال به مقدار کافی و در محل مناسب پس از تولد است. چشم بعنوان محل مناسبی برای ژن درمانی محسوب میشود، زیرا اندازه کوچکی داشته و از ساختار خود مختار برخوردار است.
در دسترس بودن ابزارهای پیشرفته برای انجام بررسیهای غیر تهاجمی باعث ارتقای سطح حساسیت و ویژگی روشهای ارزیابی اثرات درمانی میگردد.
از ژنها و بیماریهایی که در این روش مورد هدف قرار گرفتهاند، میتوان به ژن RPE65، ژن REP-1 (یا ژن CHM در کوروئیدرمی/ choroideremia)، ژن ABCA4 (بیماری استارگارت/ Stargardt) و ژن MYO7A (سندرم Usher 1b) اشاره کرد.
در ضمن وکتورهای ویروسی مرتبط با آدنو ویروس (AAV) بیشترین وکتورهای مورد استفاده در این فرآیند را تشکیل میدهند و در مطالعات بالینی تاکنون عارضه جانبی حادی گزارش نشدهاست.
با این حال، نتایج مطالعات انسانی ژن RPE65 در زمینههای اثرات مثبت بر روی حساسیت به نور و برخی اثرات آن در رفتار بینایی، نسبت به مطالعات روی سگ، کمتر امیدوارکننده ظاهر شدهاند. دلیل تفاوت میان نتایج مطالعات پیش بالینی و مطالعات بالینی احتمالا درجهی آتروفی شبکیهای در زمان آغاز روند درمانی و جهشهای بدمعنی و بیمعنی در ژن مورد نظر میباشند.
رویکردهای مبتنی بر سلولهای بنیادی
در سالیان اخیر، جمعیتهای سلولی متنوعی، از جمله سلولهای بنیادی شبکیهای، سلولهای مشتق از سلولهای گلیای مولر یا سلولهای بنیادی مزانشیمی در شبکیه، برای مطالعات پیوند شبکیه مورد استفاده قرار گرفتهاند. مطالعات نشان دادهاند سلولهای پیوند شده تمایز یافته و برای مدت زمان طولانی در شبکیهی میزبان قادر به حیات بودهاند. همچنین برخی از سلولهای دهنده در درون لایههای سلول گانلگیونی، مشبک و هستهدار قرار گرفتهاند.
با وجود کسب نتایج امیدوار کننده، جایگزینی عملکردی فوتورسپتورها نمیتواند در مقیاس گستردهتر در این مطالعات، صورت گیرد. شواهد تمایز سلولهای پیوندی به فوتورسپتورهای “واقعی” و قرارگیری عملکردی آنها در شبکیهی میزبان تنها در تعداد بسیار اندکی از مطالعات گزارش شدهاست.
سلولهای بنیادی پرتوان القا شده (سلولهای iPS یا iPSCs) بصورت مصنوعی از سلولهای پیکری افراد بالغ با کمک القای بیان “اجباری” ژنهای مخصوصی، مشتق میشوند. سلولهای پرتوان القا شده از سلولهای خون، معده، کبد و پوست افراد بالغ ایجاد میشوند. سلولهای بنیادی پرتوان القا شده از نظر توانایی تکثیر و تمایز پذیری به سلولهای بنیادی پرتوان طبیعی (مانند سلولهای بنیادی رویانی) شباهت دارند.
iPSCs پیشرفت مهمی در زمینه مطالعات سلول بنیادی به حساب میآید، زیرا محققان را قادر میسازند تا بجای استفاده بحث برانگیز از سلولهای رویانی، از این سلولها در مطالعات درمانی استفاده کنند.
مطابق روش اتخاذ شده، برنامه ریزی دوبارهی سلولهای افراد بالغ برای بدست آوردن iPSCs ممکن است خطرات قابل توجهی را بوجود آورد که استفاده از آنها را در مطالعات انسانی، محدود میسازد. هر چند روشهایی برای غلبه بر این محدودیتها از طریق غنی سازی فوتورسپتورهای مشتق از سلولهای بنیادی با مارکرهای سطح سلولی و دستکاری شبکیهی میزبان برای ادغام بیشتر این فوتورسپتورها، ابداع شدهاند. در حال حاضر، مطالعات سلولهای بنیادی هنوز در مراحل اولیه خود قرار داشته و با کاربردهای بالینی فاصله دارد.
رویکردهای مبتنی بر اپتوژنتیک
رویکردهای اپتوژنتیکی برای بازگرداندن حساسیت به نور در نورونهای باقیماندهی شبکیهی داخلی تلاش میکنند. بازگشت حساسیت به نور با اتخاذ رویکردهای اپتوژنتیکی، در مطالعات حیوانی اثبات شدهاست ولی این حساسیت به مراتب کمتر ازحساسیت طبیعی سلولهای مخروطی میباشد. بهمین دلیل، اکنون هیچ چارهای بجز افزایش قدرت نور وجود ندارد. این راهکار، با یک دوربین و عینکی که تاباندن تصویر بسیار درخشانی را بر شبکیه انجام میدهد، یا توسط دیود تابش نوری (LED) تحت شبکیهای که در کنار سلولهای دوقطبی بیان کننده اپسین قرار میگیرد، امکان پذیر است. علاوه بر این موارد، سمیت و پایداری طولانی مدت این روش به طور کافی بمنظور استفاده بالینی از آن، بررسی نشدهاست. با تمام این اوصاف، تلاشها و بررسیهای بیشتری برای هرگونه کاربرد بالینی مبتنی بر اپتوژنتیک مورد نیاز است.
مطالعه بیشتر: رویکردهای اپتوژنتیکی برای بازیابی حس شنوایی (اپتوژنتیک حلزونی)
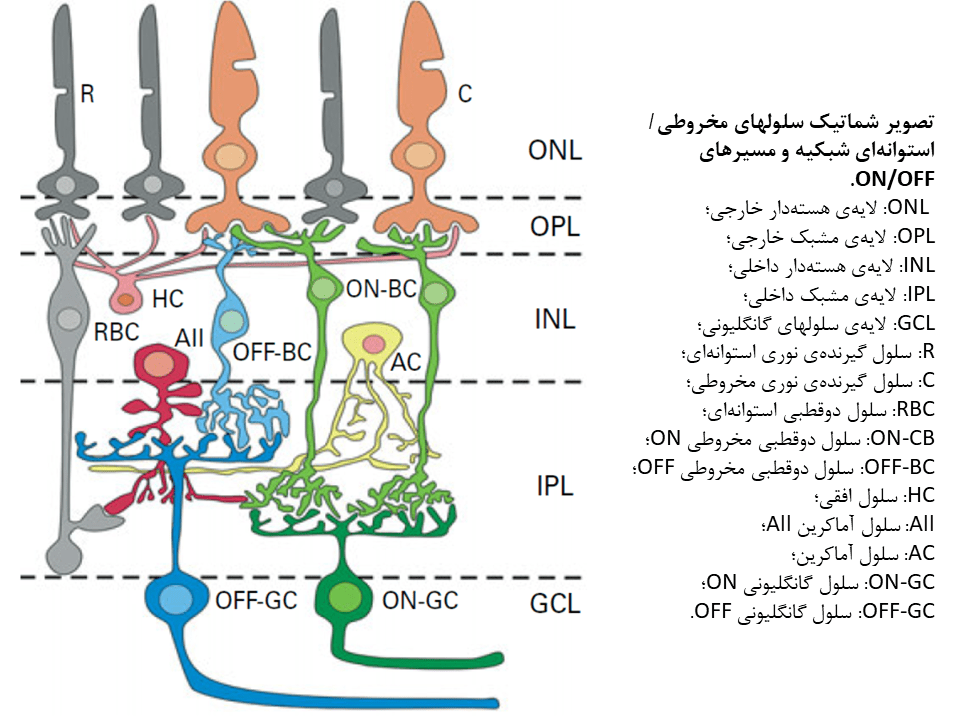
بینایی از شبکیه و زمانیکه سلولهای گیرنده نوری استوانهای و مخروطی به نور پاسخ داده و سیگنالهای نوری را به سیگنالهای الکتریکی تبدیل میکنند، آغاز میشود. این سیگنال الکتریکی با واسطهی نورونهای رده دوم و رده سوم شبکیهای که تحت عنوان نورونها شبکیهای داخلی نامیده میشوند، به سمت مغز ارسال میشود. از دست رفتن شدید سلولهای گیرنده نوری در بسیاری از بیماریهای دژنراتیو وراثتی و اکتسابی شبکیه، مانند رتینیت پیگمنتوزا (RP) و دژنراسیون ماکولار مرتبط با سن (AMD)، میتواند به از دست رفتن نسبی یا کامل بینایی بیانجامد.
RP، شامل گروهی از بیماریهای وراثتی است که سلولهای گیرنده نوری را درگیر کرده و نزدیک به ۱.۵ میلیون نفر در سراسر جهان از این بیماریها، رنج میبرند.
AMD، شایعترین دلیل نابینایی در افراد بالای ۶۰ سال است که در نتیجهی از دست رفتن پیشروندهی سلولهای گیرنده نوری در ماکولا، که در مرکز یا نزدیک به مرکز شبکیه واقع شدهاست، ایجاد میشود.
زمانیکه سلولهای گیرنده نوری از بین بروند، تنها رویکردهای مبتنی بر شبکیه میتوانند بینایی را از طریق وارد کردن سلولهای گیرنده نوری به شکبیه یا بازیابی پاسخهای نوری شبکیه، به فرد بازگردانند.
تکنیکهای بالقوه شامل پیوند سلولهای گیرنده نوری طبیعی یا سلولهای بنیادی به محل شبکیه، بهره گیری از دستگاههای کاشت شبکیه که تحریک الکتریکی مستقیم را برای نورونهای سالم شبکیه فراهم میآورد، و تکنیک نوظهور اپتوژنتیک میباشد.
مطالعاتی برای اطمینان از صحت ایدهها
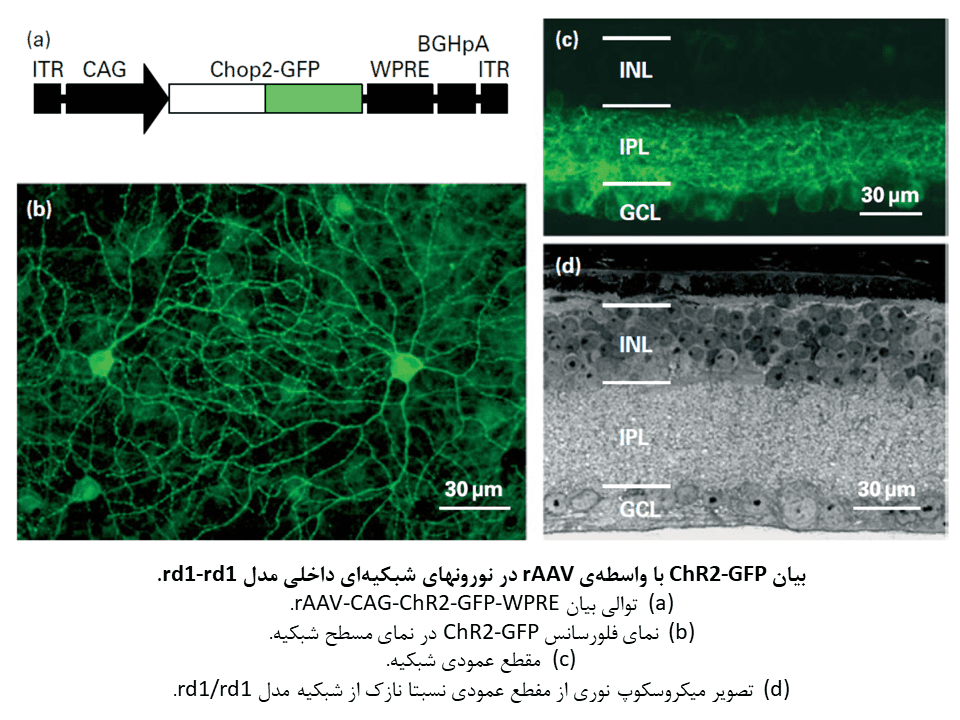
استراتژی اپتوژنتیکی بر پایهی این حقیقت که تعداد قابل توجهی از نورونهای شبکیهای داخلی پس از مرگ سلولهای گیرنده نوری، زنده باقی میمانند، استوار است. بهمین دلیل، یک استراتژی جالب برای بازیابی بینایی، تبدیل مستقیم ژنتیکی نورونهای شبکیهای داخلی به سلولهای حساس به نور خواهد بود. با این حال، پیاده سازی این استراتژی به یک گیرنده نوری که بصورت ژنتیکی کدگذاری میشود، نیاز دارد. کشف چنلرودوپسینهای حساس به نور، خصوصا چنلرودوپسین-۲ یا ChR2، به سرعت به یکی از گزینههای مطلوب برای استفاده در این استراتژی، تبدیل گردید.
اولین مطالعه برای بررسی بیان ChR2 در شبکیه با هدف بازیابی حساسیت به نور، در موش rd1/rd1 و تزریق درون زجاجیهای وکتور نوترکیب ویروسی مرتبط با آدنو ویروس (rAAV) انجام شد. موش rd1/rd1 یک مدل برای RP میباشد. این مطالعه نشان داد در نورونهای شبکیهای رده سوم میتواند به بیان قوی و پایدار ChR2 دست یافت. همچنین این مورد که بیان ChR2 باعث بازگشت حساسیت به نور شده و ایجاد پتانسیلهای عمل بینایی در قشر بینایی را بدون بهره گیری از یک منبع خارجی کروموفور رتینال تمام ترانس باعث میشود، آشکار گردید.
همچنین محققان با استفاده از وکتورهای rAAV مشابه بمنظور حمل ChR2، بازیابی سیگنالهای الکتریکی بینایی و رفتارهایی که توسط بینایی هدایت میشوند را در موشهای Royal College of Surgeons (مدل موشی برای دژنراسیون شبکیهای وراثتی) گزارش کردند. علاوه بر این، استفاده از هالورودوپسین برای بازیابی پاسخهای شبکیهای به هنگام تاریکی موفقیت آمیز بودهاست.
مطالعات فوق بدلیل نبود پروموتورهای اختصاصی سلولهای شبکیه، تنها به بررسی بیان غیر انتخابی ChR2 در سلولها، غالبا در نورونهای شبکیهای رده سوم، محدود بوده است. اخیرا، بیان هدف گذاری شده ChR2 در سلولهای دوقطبی شبکیهای از نوع ON با بهره گیری از پروموتر mGluR6، باعث بازیابی عملکرد بینایی در موشهای rd1/rd1 و دیگر مدلهای موشی دژنراسیون فوتورسپتور شدهاست. همچنین بیان هالورودوپسین با واسطهی وکتور ویروسی در سلولهای مخروطی زنده، باعث بازیابی ویژگیهای اضافی پردازشی در رابطه با سیگنالهای شبکیهای، مانند پاسخهای نوری OFF، ON، ON-OFF، مهار جانبی و انتخابی بودن جهت دار شده است.
محققان همچنین با بهره گیری از ملانوپسین، یک رنگدانه نوری اندوژن که در جمعیت کوچکی از سلولهای گانگلیونی شبکیه یافت میشود، و سوئیچهای نوری متصل به کانالهای پتاسیمی اندوژن یا گیرندههای مهندسی شدهی گلوتامات، بازگشت عملکرد بینایی را گزارش کردهاند.
مطالعات نشان دادهاست بیان پایدار ChR2 عملکردی در نورونهای شبکیهی جوندگان با انتقال یک مرتبهای وکتورهای ویروسی، میتواند در طول عمر حیوان ادامه یابد. همچنین بنظر میرسد بیان نوع دست نخوردهی ChR2 بصورت in vivo باعث ایجاد نوروتوکسیسیتی یا پاسخهای ایمنی آسیب رسان نمیشود.
با این اوصاف، صحت سنجی ایدهها برای بهره گیری از رویکردهای اپتوژنتیکی در بازیابی بینایی در حیوانات، به طرز قانع کنندهای موفقیت آمیز بودهاست. هر چند مطالعات بیشتری برای هدایت این استراتژیهای درمانی به سمت کاربردهای بالینی مورد نیاز است. این مطالعات، ارتقای ابزارهای اپتوژنتیکی، افزایش کارآیی انتقال ژن با واسطهی وکتور، و ایجاد امکان هدف گیری ردههای مختلف سلولی در شبکیه را شامل میشود.
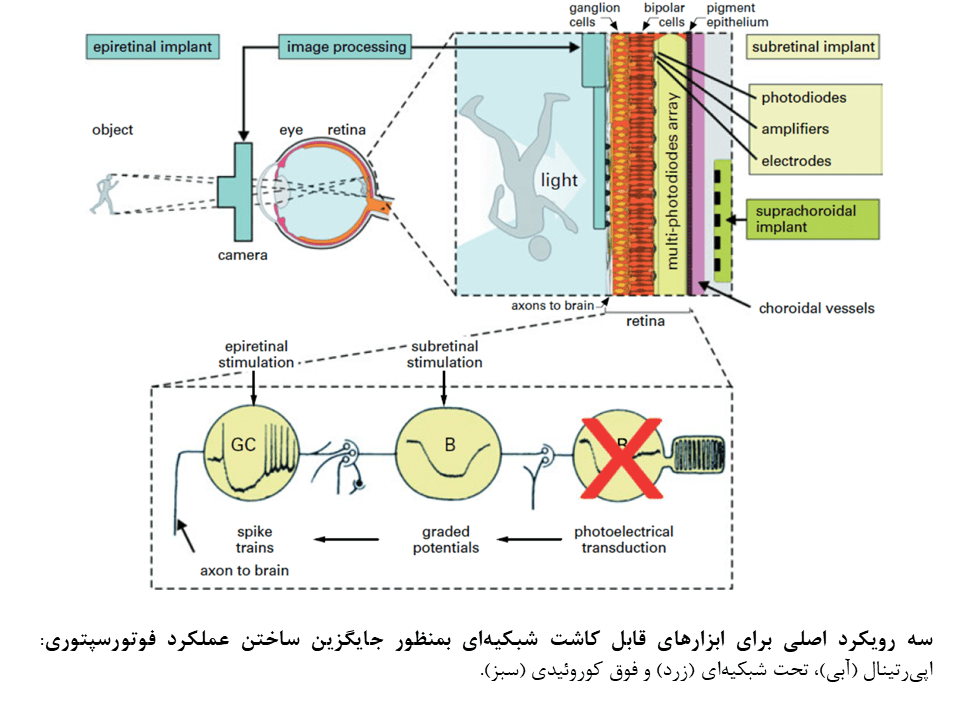
پروتزهای شبکیهای الکترونیکی
طی چند دههی اخیر، گروههای بسیاری، ایدههایی مبتنی بر جایگزین ساختن فوتورسپتورهای تحلیل یافته با ابزارهای الکترونیکی ارائه کردند. اکنون، انحصارا سه ایده مورد بررسی قرار میگیرد:
- آرایههای الکترودی اپیرتینال: این آرایهها توسط یک دوربین در خارج بدن و یک کامپیوتر کنترل میشوند که تصویر ویدئویی را به امواجی که مستقیما به سلولهای خروجی شبکیه (مانند سلولهای گانگلیونی و فیبرهای عصبی آنها) ارسال میکنند، تبدیل میکند.
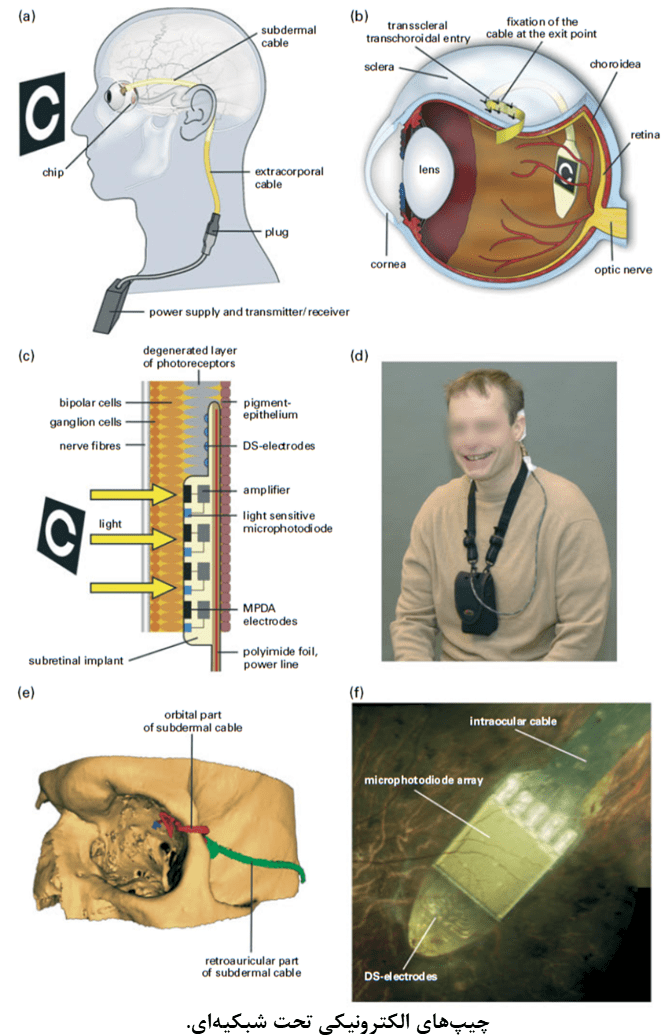
- رویکرد تحت شبکیهای (subretinal): این رویکرد با هدف جایگزین ساختن فوتورسپتورها با دیودهای نوری در سمت داخلی شبکیهی تحلیل یافته و تحریک سلولهای دوقطبی (که در حالت طبیعی توسط فوتورسپتورها تحریک میشوند) ابداع شدهاست. دانشمندان در این رویکرد، از شبکهی پردازشی طبیعی در شبکیهی داخلی بهره برده و الکترودهای تحریکی را در محل فوتورسپتورهای تحلیل یافته قرار میدهند.
- رویکرد فوق مشیمیهای (suprachoroidal): این رویکرد مشابه رویکرد تحت شبکیهای است ولی اعمال جراحی آن آسانتر بوده و آرایههای الکترودی در سمت صلبیهای قرار میگیرند. در این رویکرد، بدلیل اینکه محل الکترودها در زیر مشیمیه واقع شده و فاصلهی بیشتری اگز شبکیهی عصبی دارند، دقت و رزولشن فضایی بسیار پایین است.
در هر سه رویکرد مطرح شده، از سیم پیچهای القایی ترانس درمال و کابلهای داخل چشمی برای تامین انرژی، کنترل سیگنالها و تحریک الکترودهای اپی رتینال یا تحت شبکیهای استفاده میشود که تعداد الکترودهای مورد استفاده و نحوه قرارگیری آنها را (بصورت متوالی یا موازی) محدود میسازد. این مورد، خود باعث محدود شدن دقت فضایی بینایی مصنوعی میگردد. بعلاوه، عملیات جراحی پیچیدهای برای قرار دادن کابلها و سیم پیچهای القای برای تامین انرژی الکترودها مورد نیاز است. همچنین تهیهی کسپول ضد اب برای مدارهای الکترونیکی داخل و اطراف چشمی بدلیل فضای محدود، ضروری است و تولید گرما توسط مدارهای الکترونیکی مسئلهای است که باید مورد توجه قرار گیرد.
پروتزهای قشری
محققان زیادی برای بازیابی بینایی در افراد نابینا، تمرکز مطالعاتی خود را بر روی تحریک قشر بینایی اولیه از طریق الکترودها که به ناحیهی V۱ وارد میشوند، منعطف ساختهاند. یکی از محدودیتهای عمدهی این روش، ایجاد یک سیستم پردازش تصویر بمنظور تولید تصاویر الکترونیکی قابل فهم برای نورونهای قشری است. آرایههای انعطاف پذیر که از الکترودهای نفود کننده بهره میبرند، در مدلهای حیوانی بسیاری از جمله میمونها مورد بررسی قرار گرفتهاند. با این حال، هنوز توانایی این رویکرد در فراهم آوردن بینایی موثر، روشن نیست.
تحریک کنندههای زبانی
طی ده سال اخیر محققان در حال توسعهی ابزاری برای انتقال ورودیهای سازمانیافتهی فضایی به زبان از طریق یک ماتریکس الکترودی در درون زبان بودهاند. در این روش افرادی که نابینا هستند، با استفاده از یک دوربین، یک کامپیوتر و ابزار ورودی، قادر به شناسایی الگوهای بینایی پایه خواهند بود.
مشابه حالتی که افراد با استفاده از نوک انگشتهای خود به خواندن حروف بریل میپردازند، در این روش افراد قادر به تشخیص الگوهای مخصوص ساده با کمک تحریک زبان خواهند بود که شناسایی الگوهای سادهی هندسی مانند دایره، مربع و مثلث را ممکن میسازد.
وضعیت کنونی
- رویکردهای مبتنی بر اپتوژنتیک تاکنون بصورت محدود در افراد مبتلا به رتینیت پیگمنتوزا که نورونهای شبکیهای داخلی سالمی داشتند، کاربرد داشته است. هنوز مشکلات عمدهای برای ایجاد حساسیت بالا به نور بدون محدودیت زمانی وجود دارد.
- طیف بسیار وسیعی از انواع مختلف نابینایی وجود دارد که به درمانهای متنوعی بر اساس سن آغاز بیماری، سن آغاز درمان و مرحلهی دژنراسیون نیاز دارند.
- در وضعیت کنونی، اطلاعات زیادی در مورد سمیت، کاربرد طولانی مدت، ایمنی و کارآمدی رویکردهای مبتنی بر اپتوژنتیک در دسترس نیست.
- در بسیاری از موارد حساسیت طیفی کانالهای حساس به نور که در رویکردهای اپتوژنتیکی به غشای سیتوپلاسمی سلولهای شبکیهای داخلی افزوده میشوند، بطور غیر مستقیم با حساسیت کانالهای رنگی متنوع در شبکیه و مغز ارتباط دارد. این مورد، میتواند به تصویر مختل کننده با رنگ اشتباه (“chromatic pointillistic chaos”) در درمان نابینایی انسان منجر شود که شناسایی قطعات خط، مناطق رنگی مرتبط و دیگر موارد را که باعث تشکیل تصویر میشوند، با مشکل مواجه میسازد. این مشکل را میتوان با ایجاد پروموترهایی که با کانالهای رنگی مخصوصی ارتباط دارند و اپسین به خصوصی با حساسیت طیفی مناسب را فراهم میآورند، برطرف نمود.