تکنیک RAPD -PCR که به arbitrarily primed PCR و AP-PCR نیز مشهور است، از روشهای نسبتا سریع انگشتنگاری DNA میباشد. RAPD (Random Amplified Polymorphic DNA) تکنیکی از PCR است که امکان مطالعه پلیمورفیسمهای ژنتیکی را در میان جمعیتی از ارگانیسمها فراهم میکند. این متد بر پایه تولید امپلیکونها، در نتیجه استفاده از الیگونوکلئوتیدهایی است که به صورت تصادفی به قطعه هدف متصل میگردند (arbitrary priming). به عبارت دیگر قطعات به صورت تصادفی تکثیر شده و توسط تکنیکهای اسکن وابسته به تکثیر قطعات هدف، بررسی میشوند. الگوی حاصل، پروفایلی منحصربهفرد از واکنش RAPD انجام شده روی نمونه موردنظر به دست میدهد که برپایه خصوصیات ارگانیسم موردمطالعه قرار دارد.
این تکنیک، در صورت نیاز به مقایسه سریع هر کدام از نمونهها، متدی مناسب در آنالیز باکتریها، قارچها، گیاهان و مطالعه جمعیتهای انسانی است. اطلاعاتی که در مورد فراوانی مارکرهایی مانند RAPDها، AFLPها و میکروستلایتها به دست میآید، روشی را به منظور طبقهبندی افراد در دستههای ژنوتیپی ارائه میدهد و در مطالعات واریانتهای ژنوتیپی در میان گونهها بسیار مناسب میباشد. در مقایسه با سایر تکنیکهای وابسته به PCR که در تشخیص تفاوتهای ژنتیکی و کارایی در طبقهبندیهای تاکسونومیک خاص متغیر هستند، RAPD ابزاری مقرونبهصرفه در مطالعات تاکسونومیک است.
به علت وجود احتمال تولید محصولات غیرمرتبط با والدین، استفاده از این تکنیک در تستهای ابوتی که نیاز به نتایجی با قطعیت بالا دارند، توصیه نمیشود. مارکرهایی از RAPD که دارای جدایی همزمان (cosegregation) با صفات مربوط به بیماریزایی هستند، میتوانند ابزاری قدرتمند را به منظور تعیین سویه باکتریها و قارچها فراهم کنند. در مطالعات گیاهشناسی، RAPD-PCR ابزاری مفید به منظور فراهم کردن مارکرهای مرتبط با بررسی توارث صفات مختلف است. این تکنیک همچنین در شناسایی توالیهای غیرطبیعی DNA در سرطانهای انسانی به کار میرود. به طور معمول، اثرانگشتهای ژنومی که توسط AP-PCR از بافتهای نرمال و توموری تهیه میشوند، میتوانند در بررسی توالیهای حذفشده و یا تکثیر شده سلولهای سرطانی استفاده شوند.
AP-PCR سنتز DNA را با تنها یک پرایمر آغاز میکند که به صورت تصادفی به نواحی مکمل خود در ژنوم متصل میشود. پرایمر مورداستفاده طولی در حدود ۱۰ جفتباز داشته و محتوای گوانین-سیتوزینی آن به میزان ۴۰-۷۰ درصد است. منطق پشت انجام این کار آن است که در شرایط با stringency پایین، پرایمر الیگونوکلئوتیدی سنتزشده تعدادی از توالیهای مکمل خود را در DNA الگو پیدا خواهد کرد. پس طول این پرایمر باید به اندازهای باشد که دارای جایگاههایی با تعداد مناسب بوده (نباید بیش از ۴-۳ کیلوباز باشد) و فاصله هر جفت پرایمر با جهتگیری متضاد از همدیگر به گونهای باشد که بتوانند در نتیجه PCR، امپلیکونهای منحصر به نمونه موردبررسی را تولید کنند. نوارهای تولیدشده با اندازه متفاوت که با الکتروفورز قابل نمایش میگردند، اثرانگشت ژنتیکی فرد را میسازند.
RAPD از نقطهای آغاز میشود که پرایمر مورداستفاده دارای تطابق ناقصی با توالی الگو است؛ یعنی شرایطی که low stringent است. برای رسیدن به این هدف، چرخههای اولیه (به طور معمول پنج چرخه اول) در دماهای پایین (۳۷–۵۰°C) انجام شوند که امکان هیبریداسیون بین پرایمر و توالی الگو را در نواحی دارای mismatch، فراهم میآورد. سپس چرخههای بعدی در شرایط high stringent انجام میگیرند. در این چرخهها، دما تا ۵۵°C (مانند PCR استاندارد) افزایش یافته و واکنش تا ۳۰-۳۵ چرخه دیگر پیشرفت میکند. درنتیجه، حین چرخههای تکثیری PCR، تنها بهترین mismatchهای موجود در چرخههای اولیه تکثیر میگردند.
محصول مراحل برشمرده، قطعاتی هستند که انتهایشان مکمل پرایمر مورد استفاده است. نواحی مورد تکثیر شامل توالیهایی بسیار متنوع و عمدتا دربرگیرنده توالیهایی غیرکدکننده هستد که در بین گونههای مختلف طول متفاوتی دارند. در صورتیکه واکنش به دقت بهینهسازی شود، ممکن است ۵۰ تا ۱۰۰ قطعه مشخص DNA به دست آید که میتوانند توسط PAGE از همدیگر تفکیک شوند. به منظور مقایسه میتوان در سایر ستونهای الکتروفورز، نتایج واکنشهای RAPD مربوط به نمونههای از پیشتعیینشده را قرار داد.
AP-PCR قطعات حذفشده و یا تکثیرشده DNA را به صورت شدتهای متفاوت در الکتروفورز، نمایش میدهد. در نتیجه ژنومهای مورد بررسی به صورت کیفی و کمی از یکدیگر افتراق داده میشوند. البته، علیرغم مشاهده شدن تفاوت در شدتها، ممکن است تفاوتهای موجود مربوط به حذفها یا تکثیرهای واقعی نباشند؛ اما میتوان گفت که میتوانند وجود پلیمورفیسمها را در جمعیتهای انسانی نشان دهند. پلیمورفیسمهای مربوط به RAPD، میتوانند هم درنتیجه تغییرات کروموزومی و در نواحی موردتکثیر و هم در نتیجه وجود تنوع در بازها و تغییر در الگوی اتصال پرایمر رخ دهند.
از آنجاییکه AP-PCR بر پایه وجود نواحی مکمل پرایمر در DNA الگو و تکثیر تصادفی (arbitrary) قطعات در شرایط کمدقت قرار دارد، در یک واکنش PCR واحد، نواحی ژنومی متنوعی میتوانند به صورت همزمان تکثیر شوند. درنتیجه تفاوت در این جایگاهها منجر به تشکیل الگوهای منحصر به فردی از اثرانگشت DNA میگردد. این تفاوتها امکان تعیین هویت ارگانیسمها را در سطح گونه یا سویه فراهم میآورد. لازم به ذکر است که دقت فرایند تعیین گونه/سویه، میزان پیچیدگی اثرانگشت و تشخیص پلیمورفیسم DNA همگی وابسته به پرایمری هستند که به منظور انجام تست RAPD انتخاب شده است.
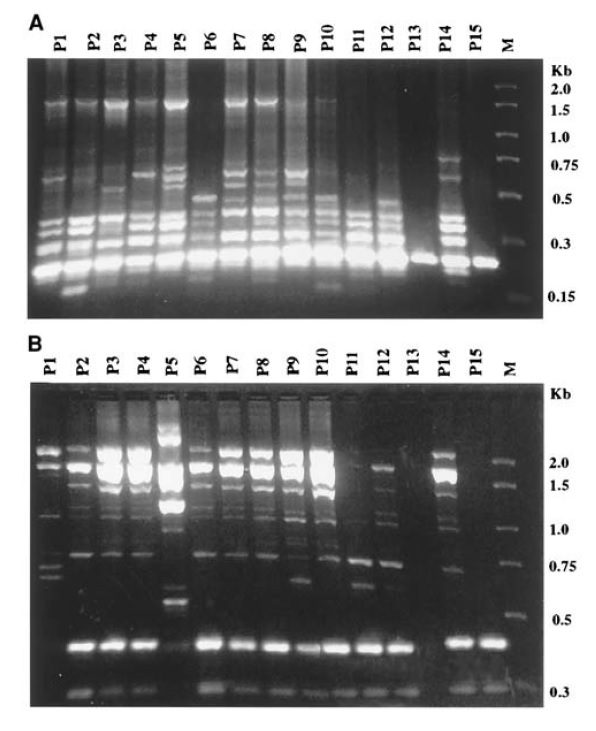
تصویر ۱. انگشتنگاری RAPD از ۱۵ نمونه کلینیکی مربوط به Candida parapsilosis که پس از تفکیک در اثر الکتروفورز در ژل آگارز ۱.۲% حاصل شده است. اندازه نوارها نمایانگر تعداد جفتبازها است.
اختصاصیت RAPD به معنای تولید اثرانگشتهای توافقی از روی چندین جایگاه است که در نتیجه وجود چندین جایگاه هدف تصادفی حاصل میشوند. به منظور رسیدن به اثرانگشتهای توافقی و تولید آنها با دقت بالا در شرایطی که پرایمر به صورت تصادفی متصل میشود، کاهش طول پرایمرهای مورداستفاده و جلوگیری از فعلوانفعالات میان امپلیکونها با الحاق mini-hairpin ها به انتهای ۵’ آنها، باید انجام گیرد.
مزیت اساسی AP-PCR در آن است که قطعات DNA مورد هدف، میتوانند با استفاده از همان پرایمر اولیه تکثیر و کلون شوند. این تکنیک، به آسانی انجام میشود؛ تنها به مقادیر اندکی از DNA ژنومی نیاز دارد و نیازی با استفاده از بلاتینگ و تکنیکهای شناسایی رادیواکتیو ندارد. همچنین انجام RAPD نیازی به آشنایی با توالی DNA ژنوم مورد هدف ندارد. علت آن است که طی این تکنیک پرایمرها به ناحیهای در ژنوم متصل خواهند شد، اما مکان دقیق آن مشخص نخواهد بود. این ویژگی، RAPD را به متدی مناسب برای بررسی DNA ارگانیسمهایی کرده است که چندان موردتوجه دانشمندان قرار نگرفتهاند و توالی آنها معین نیست.
لازم به ذکر است که ویژگی اخیر، استفاده این تکنیک را محدود به مولکولهای DNA الگوی سالم و دستنخورده کرده و امکان استفاده از نمونههای DNA تجزیه شده را از بین میبرد. قدرت تفکیک این تکنیک پایینتر از تکنیکهای اختصاصی و هدفمندی مانند آنالیز STRها است. در سالهای اخیر، RAPD برای شناسایی فیلوژنی گونههای متنوع گیاهی و جانوری مورد استفاده قرار گرفته است.
تکنیک AP-PCR نواقص دیگری نیز دارد. نخست، با اینکه میتوان توسط RAPD موجودات دارای تفاوت ژنتیکی را از یکدیگر افتراق داد، قابلیت بازتولید الگوی نوارها، در صورت بهکارگیری پرایمرها و شرایط واکنش یکسان نیز، ممکن است حتی از روزی به روز دیگر متفاوت باشد. به علت وجود این مشکل است بسیاری از ژورنالهای علمی مطالعاتی را که مبنای آزمایشاتشان تنها این تکنیک است را نمیپذیرند. دوم آنکه، مشخص شده است که غلظت MgCl2 و توالی مورداستفاده میتواند الگوی تشکیل نوارها را تحت تاثیر قرار دهد. سوم، با وجود اینکه شرایط با دقت پایین تنها در چرخههای اولیه استفاده میشوند، دمای اتصال پایین احتمالا نتیجه کل آنالیز را به خطر خواهد انداخت.
تکنیک RAPD به علت سادگی و سرعتی که در تعیین واریانتهای ژنتیکی موجود در DNA دارد، از سوی متخصصان ژنتیک جمعیت موردتوجه فراوانی قرار گرفته است. اما فرض یکسان بودن نوارهایی که ظاهرا وزن مولکولی مشابهی دارند، از مشکلات دیگری است که در آنالیزهای RAPD پیش میآید. در صورتی که نوارها در شرایط مهاجرت همزمان تشکیل شوند، یکسان در نظر گرفتن نوارهای با وزن مولکولی یکسان در حالتی درست است که افراد موردبررسی همگی به جمعیتی یکسان تعلق داشته باشند. اگر افراد موردبررسی متعلق به گونههاو جمعیتهای متفاوتی باشند، این موضوع صحت نخواهد داشت. درنتیجه، تکنیک RAPD آنالیزی دقیق را روی جمعیتهای نزدیک به یکدیگر انجام داده و دقت آن در بررسی جمعیتهای دور از هم پایینتر است.
SCAR
SCAR (sequence characterized amplifi ed regions) از انواع بهبودیافته RAPD میباشد. این مارکرها درنتیجه توالییابی انتهای مارکرهای RAPD و طراحی پرایمرهایی بلندتر (با طول ۲۴-۲۲ نوکلئوتید) حاصل میشوند و میتوانند لوکوس موردنظر را به صورت اخصاصی تکثیر نمایند. از معایب مارکرهای RAPD آن است که مارکرهایی غالب هستند و هیچگونه اطلاعاتی را مبنی بر حالتهای هتروزیگوتی فراهم نمیکنند. راهحل، تبدیل مارکرهای RAPD به مارکرهایی همغالب به نام SCAR است. SCARها خود معمولا غالب هستند و تبدیل برخی از آنها به مارکرهای همغالب درنتیجه تجزیه آنها توسط آنزیمهای محدودکننده tetra-cutting انجام میگیرد. در این حالت، وجود پلیمورفیسم از روی نتایج الکتروفورز در ژل denaturing و یا SSCP استنتاج میشود.
آنالیز SCAR، علاوه بر اینکه اختصاصیت بالایی دارد، بر مبنای حضور/ عدم حضور امپلیکونی خاص میباشد. این موضوع به طرز قابل توجهی تفسیر نتایج را سادهتر میکند و خصوصا در مواقعی اهمیت دارد که تعداد فراوانی از نمونهها را بخواهیم بررسی کنیم. SCAR ها همچنین امکان نقشهبرداری مقایسهای (comparative mapping) و مطالعات homology را در بین گونههای مرتبط با یکدیگر فراهم میکنند.
