قابلیت ارتباط سریع میان سلولهای موجود زنده از کلیدیترین دستاوردهای تکامل در طی میلیونها سال بوده است. این ارتباطات از اشکال سادهای همچون ترشح مواد به اطراف سلول تا تارهای عصبی بسیار سریع متغیر بوده است. در این بخش به توضیح انتقال سیگنال در موجودات عالی و دستاورد عظیم دانشمندان برای مطالعهی آن میپردازیم. انتقال سیگنال بین سلولها توسط کانالهای یونی میانجگری میشود. این کانالها پروتئینیهایی هستند که به شکل حفره در غشای پلاسمایی سلولها جا خوش کردهاند. در بدن، فعالیت پالسی کانالهای یونی موجب تحریک سلولهای عضلانی و نورونها میشود. در ارگانهای حسی، کانالها فعالیتهای فیزیکی و شیمیایی محرک را به سیگنالهای الکتریکی در سیستم عصبی تبدیل میکنند. حتی سلولهایی که به سیستم عصبی مرتبط و متصل نیستند، مانند سلولهای خونی و ایمنی نیز از کانالهای یونی برای فرآیندهای پیامرسانی استفاده میکنند.
رسمیسازی تئوری یونی برای پتانسیل غشای سلول و تحریکپذیری غشای سلولی، ناشی از متودولوژی جدیدی بود که به محققین اجازهی اندازهگیری مستقیم جریانهای یونی را از خلال غشای سلول میداد. این دستاورد بدون کشف آکسونهای غولپیکر ماهی مرکب توسط جان یانگ (John Young)، که به استانداردی در فیزیولوژی عصب تبدیل شد، ممکن نبود. با استفاده از این آکسونها، کنث کول (Kenneth Cole)، هاوارد کورتیس (Havard) توانستند تغییرات امپدانس را به کمک الکترودهای خارج سلولی محاسبه کنند. طبق محاسبات آنها مشخص شد که در حین پتانسیل عمل، تغییر محسوس و سریعی در مقاومت غشایی به وجود میآید؛ این موضوع نشاندهندهی تولید جریان خلال غشایی بود. پس از این یافتهها، کول و کورتیس با همکاری یکدیگر، و الن هوجکین (Alan L. Hodgkin) و اندرو هاکسلی (Andrew F. Huxley) بهطور مستقل، توانستند مینیالکترودهایی را بسازند که قابلیت وارد شدن به آکسون غولپیکر را دارا بود (قطر این آکسونها کمتر از ۱ میلیمتر بود). ماحصل این تلاشها محاسبهی مستقیم اولین پتانسیل غشایی در حالت استراحت (منفی۵۰ میلیولت) و در حال پتانسیل عمل بود.
مدتی بعد در سال ۱۹۴۹ تکنیک ولتاژ-کلمپ (voltage clamp) که اجازهی محاسبهی مستقیم پتانسیل استراحت و عمل، و تثبیت ولتاژ غشای نورونها برای اهداف آزمایشی را به پژوهشگران میداد، توسط کول توسعه یافت.
با وجود شواهد ارائه شده در آن زمان، تئوری یونی، زمان زیادی نیاز داشت که بهطور جامع توسط دانشمندان مورد پذیرش قرار گیرد؛ در حقیقت تا دههی ۱۹۷۰، واحدهای شیمیایی مانند استیل کولین اغلب به عنوان عامل اساسی در انتقال پیام عصبی مورد پذیرش بودند.
ولتاژ کلمپ
ولتاژ کلمپ به آزمایشگر این اجازه را میدهد تا پتانسیل غشا را در سطوح از پیش تعیین شدهای ثابت نگه داشته و از تغییرات جریان غشا که روی پتانسیل آن تأثیر میگذارد، جلوگیری کند. با کنترل پتانسیل غشا، میتوان اثر تغییرات آن را روی رسانایی غشا به تکتک یونها اندازه گرفت.
ولتاژ کلمپ از یک جفت الکترود داخل و خارج سلولی تشکیل میشود؛ از این جفت الکترودها برای اندازهگیری پتانسیل و عبور جریان از غشا استفاده میکنند. با استفاده از یک تقویتکنندهی فیدبک منفی، ولتاژ کلمپ قادر است تا مقدار صحیحی از جریان را از عرض غشا به منظور ثابت نگه داشتن پتانسیل آن در محدودهای از پیش تعیین شده، عبور دهد.
دپلاریزاسیون با باز کردن کانالهای وابسته به ولتاژ دریچهدار، عبور این یونها را از عرض غشا کلید میزند. این تغییر در جریان غشایی، پتانسیل غشا را تغییر خواهد داد ولی ولتاژ کلمپ، آن را در سطح دلخواه نگه میدارد.
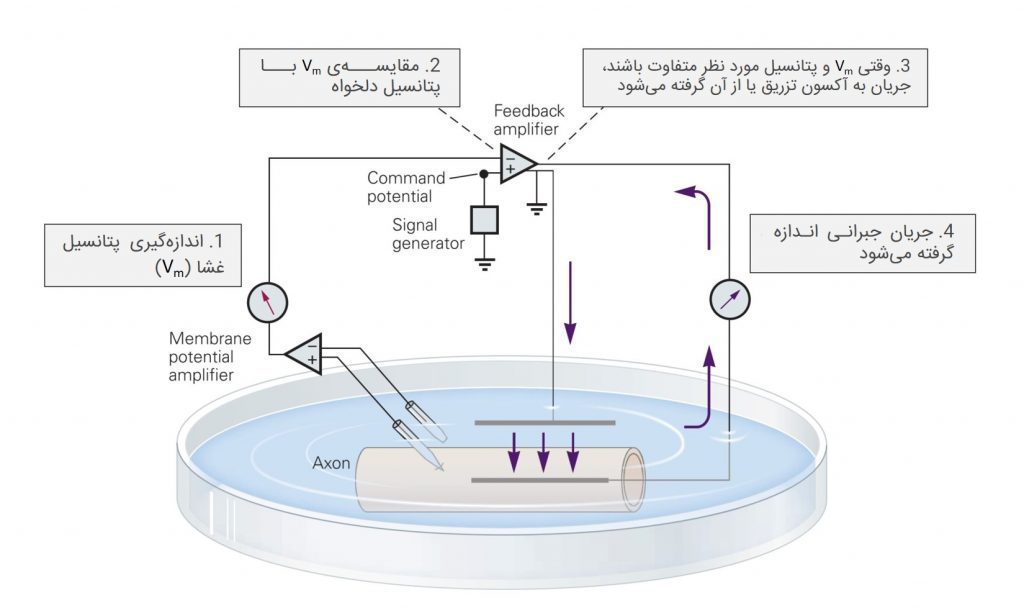
برای اندازهگیری دقیق رابطهی جریان-پتانسیل در غشای سلول، پتانسیل غشا بایستی در عرض کل سطح آکسون یکی شود. این امر با الکترود جریان داخلی با رسانایی بسیار بالا که مقاومت آکسونی را به صفر کاهش میدهد، امکانپذیر میشود.
وقتی کانالهای دریچهدار سدیم در پاسخ به دپلاریزاسیونی جزئی باز شدند، به دلیل شیب الکتروشیمیایی رو به داخل، جریانی از یونهای سدیم به سمت داخل سلول ایجاد خواهد شد. این جریان با افزایش بارهای مثبت در سمت داخل غشا و کاهش آن در طرف خارج، به پیشبرد دپلاریزاسیون کمک میکند.
ولتاژ کلمپ با خروج بار مثبت از سلول و انتقال آن به محلول بیرونی، به طور همزمان با این پروسه مقابله مینماید. با ایجاد جریانی که برابر و مخالف با جریان غشاست، مدار ولتاژ کلمپ به طور خودکار از دست زدن به پتانسیل غشا از آن مقداری که برایش تعیین شده، جلوگیری میکند. در نتیجهی این امر، توزیع بار در دو سوی غشا زیاد تغییر نکرده و اتفاق خاصی برای پتانسیل غشا (Vm) نمیافتد.
پس میتوان گفت، ولتاژ کلمپ یک سیستم فیدبک منفی است. به سیستمی فیدبک منفی میگویند که در آن مقدار خروجی سیستم (در این مورد Vm)، برای آن سیستم ورودی محسوب شود که با مقدار مرجع (سیگنالی که ما اعمال کردهایم) مقایسه میگردد. هر اختلافی بین سیگنال مورد نظر و سیگنال خروجی نوعی “کنترلگر” (در این مورد تقویتکنندهی فیدبک) را فعال مینماید که به طور اتوماتیک آن اختلاف را کم خواهد کرد. بدین ترتیب، پتانسیل واقعی غشا به صورت خودکار دنبالهرو پتانسیل سیگنال ما خواهد بود.
این روش در اوایل دههی ۱۹۵۰ توسط هوجکین و هاکسلی برای پی بردن به مکانیسم یونی پتانسیل عمل که مسئول فعالیتهای آکسونی بودند، به کار گرفته شد.
یافتههای آنان نشان میداد، تحریکپذیری غشاها وابسته به ورود غیرفعال یونها از خلال غشاهای بیولوژيک و شیب الکتروشیمیایی آنها است. (شکل ۵)
تئوری یونی علاوه بر موارد اشاره شده، به تأثیر نفودپذیری اختصاصی به یونهای خاص در تعیین خصوصیات تحریکپذیری سلولها اشاره دارد. تئوری هوجکین-هاکسلی همچنین راههای متعددی را برای ورود و خروج یونها از طریق کانالهای آبی و یا انتقالدهندههای یونی فرض کرده است.
پچ کلمپ
تا سال ۱۹۵۰ بیولوژیستها قادر به مطالعهی جریانهای الکتریکی نشأت گرفته از جاری شدن یونها در سطح ماکروسکوپیک بودند. با این حال در دهه ۱۹۷۰ پیشرفتهای صورت گرفته توسط گروه عظیمی از دانشمندان و آزمایشگاهها راه را برای بررسی هر کدام از کانالهای یونی به صورت مجزا فراهم نمود. دو چهرهی بسیار تأثیرگذار از میان این افراد اروین نهر و برت سکمن (Erwin Neher, Bert Sakmann) بودند. تکنیکی موسوم به Patch Clamp که نهر و سکمن به سبب توسعهی آن موفق به دریافت جایزهی نوبل پزشکی و فیزیولوژی در سال ۱۹۹۱ شدند، این امکان را برای اولین بار مهیا کرد.
توضیح رفتار کانالهای یونی غشا به صورت تکی، پیشرفتی عظیم در دنیای بیولوژی مولکولی محسوب میشد که این دو دانشمند را مستحق دریافت جایزهی نوبل کرد. اروین نهر در آن سالها مسئول دپارتمان بیوفیزیک غشا در انستیتو تحقیقاتی ماکس پلانک (Max Plunk) بود. وی پس از اتمام دوران مدرسه در سال ۱۹۶۵، مدرک کارشناسی خود را در سال ۱۹۶۷ از دانشگاه ویسکانسین (Wisconsin) دریافت کرده و سپس موفق به اتمام دورهی دکتری خود در رشته بیوفیزیک غشا در سال ۱۹۷۰ شد.
برت سکمن همزمان با دریافت جایزهی نوبل در سال ۱۹۹۲، رئیس دپارتمان فیزیولوژی انستیتو تحقیقاتی ماکس پلانک بود. وی در سال ۱۹۶۹ مدرک پزشکی خود را از دانشگاه مونیخ دریافت کرده و سپس از سال ۱۹۷۰ تا ۱۹۷۳ مشغول به تحصیل و انجام تحقیقات در حوزهی بیوفیزیک بوده است.
تکنیک patch clamp
تکنیک patch clamp با وجود اساس بسیار سادهاش، انقلابی بود. در این تکنیک، پیپت شیشهای بسیار نازکی بهطور محکم به غشای سلول متصل میشود؛ این اتصال سبب ایزوله کردن بخش کوچکی از غشا و کانالهای موجود در آن میگردد. سپس کانالهای یونی بهصورت شیمیایی و الکتریکی دستکاری شده و مورد بررسی قرار میگیرند. از دیگر کاربردهای این تکنیک آن است که پژوهشگر را قارد میسازد تا بخش کوچکی از غشا را جداسازی کرده و یا پنجرهای به درون سیتوپلاسم سلول، به منظور دستکاری محتوای درون سلولی ایجاد نماید.
در تمامی این کاربردها، پچ کلمپ دانشمندان را قادر میسازد تا تأثیرات کانالهای یونی بر پتانسیل سلولی و سایر اعمال حیاتی سلول از جمله ترشح و انقباض را مورد مطالعه قرار دهد. از سال ۱۹۷۶ که نهر و سکمن نسخهی اولیهی این تکنیک را معرفی نمودند، صدها آزمایشگاه در سراسر جهان به بهینهسازی و یافتن کاربردهای جدید برای آن مشغول بودهاند.
مقالات منتشر شده در سالهای ۱۹۶۹ و ۱۹۷۰، زمانی که این دو دانشمند مشغول اتمام دورهی دکتری خود در رشته بیوفیزیک غشا در انستیتو روانپزشکی ماکسپلانک در مونیخ بودند، انگیزهی اصلی آنها برای مطالعهی کانالهای یونی بود. یافتههایی که توجه نهر و سکمن را به خود جلب کرده بودند در رابطه با غشاهای لیپیدی سنتتیک بود که در فرم خالص خود نارسانا هستند. این در حالیست که راس بین (Ross C. Bean) و همکارانش نشان داده بودند که استفاده و الحاق مقادیری قابل ردیابی از برخی آنتیبیوتیکها و پروتئینها سبب تغییر در جریان عبوری از این غشاها میشود؛ این یافتهها پیشنهاد میکرد که مواد مورد استفاده، سبب ایجاد حفراتی در غشا میشوند که هر یک توانایی باز و بسته شدن دارند. به بیانی دیگر، با کمک این مواد یونها قادر به عبور از غشا هستند.
طولی نکشید که پژوهشگران متوجه شدند پیامهای الکتریکی بین سلولهای عصبی و سایر انواع سلولها، باید از طریق غشای پلاسمایی احاطهکنندهی این سلولها منتقل شود، که خود ماهیت لیپیدی دارد. الن هوجکین و اندرو هاکسلی از دانشگاه کمبریج، در مطالعات قبلی خود که با هدف تجزیه و تحلیل کیفیت انتقال پیامهای الکتریکی از عرض غشای سلولی صورت گرفته بود، بر روی مفهوم کانالهای یونی کار کرده بودند. این دو به دلیل تلاشهای ارزشمند خود در همین حوزه، در سال ۱۹۶۳ موفق به کسب جایزهی نوبل شدند. نهر و سکمن که هر دو به بیوفیزیک غشا علاقمند بودند، تصورشان بر این بود که اگر بتوانند اندازهگیریهای لازم را با دقت و تفکیکپذیری بالا انجام دهند، خواهند توانست دنیایی میکروسکوپی از مولکولهای دخیل در پیامرسانی را آشکار سازند.
در سالهای بعدی، شواهد بیشتری جمع شد که نشان میداد کانالهای یونی واقعاً در غشای سلولی وظایفی را بر عهده دارند. یکی از مهمترین مطالعات در این مورد توسط دو تن از پژوهشگران کالج دانشگاهی لندن، به نامهای برنارد کاتز (Bernard Katz) و ریکاردو میلدی (Ricardo Miledi) انجام شده است. این دو پژوهشگر در سال ۱۹۷۲ یک ارزیابی آماری از افتوخیزهای ولتاژ در محل پیوستگاه عصبی – ماهیچهای به عمل آوردند. سیناپس بین سلول عصبی و فیبر عضلانی، پیوستگاه عصبی – ماهیچهای خوانده میشود. یافتههای آنها نشان میداد که پیام سیناپسی از رویدادهای الکتریکی کوچک با پتانسیل ثابت تشکیل میگردد، که شباهت معنیداری به سیگنالهای برخاسته از کانالهای مصنوعی دارد.
اما کاتز و میلدی قادر نبودند در مورد خصوصیات دقیق این کانالها اظهار نظر کنند. آنها فقط میتوانستند بر اساس یافتههای مطالعهی تحلیلی خود و با بهرهگیری از چندین فرض ممکن، حدسهایی در مورد خصوصیات این کانالها بزنند. در آن سالها، هیچگونه روش مستقیمی برای اندازهگیری هر یک از واحدهای رویدادی سازندهی پیام سیناپسی در دست نبود. تکنیکهای استانداردی که در این دوره جهت اندازهگیری جریان الکتریکی عرض غشایی به کار میرفت، نویز پسزمینهای معادل با دهمیلیاردم یک آمپر داشت. اما این نویز ضعیف در واقع ۱۰۰ برابر قویتر از جریان یک واحد رویدادی بود، و همین باعث میشد این جریان غیر قابلاندازهگیری شود.
نهر و سکمن در سال ۱۹۷۳ تصمیم گرفتند که این مشکل را از طریق کاهش دادن نویز پسزمینه برطرف سازند. آنها میدانستند که اجزای الکتریکی در دسترس تنها هنگامی از تفکیکپذیری لازم برخوردار بودند که بتوان سطح کوچکی از غشای سلولی را انتخاب و از سایر قسمتهای آن جدا ساخت. راه حل آنها این بود که یک میکروپیپت شیشهای را بر روی سطح پاکسازی شدهی فیبر عضلانی قرار دهند. نهر و سکمن امیدوار بودند که این میکروپیپت نارسانا بتواند چند عدد از کانالهای یونی موجود بر سطح غشای سلول را از بقیه جدا کند، تا بتوانند همین چند کانال را مورد مطالعه قرار دهند.
اما برقراری یک ارتباط محکم بین میکروپیپت شیشهای و غشای فیبر عضلانی به این سادگیها امکانپذیر نبود. مانند بسیاری از پژوهشگران قبلی که از پیپتهای خارج سلولی استفاده کرده بودند؛ این دو پژوهشگر نیز باید راهی پیدا میکردند که بتوانند با نشت الکتریکی موجود بین مایع خارج سلولی و بخش داخلی پیپت، مقابله کنند. هر طور که شده بود، در نهایت سکمن و نهر توانستند با پاکسازی دقیق سطح خارجی غشای فیبر عضلانی، و بهینهسازی شکل و اندازهی سر پیپت جریانهایی را که از خلال این کانالها عبور میکردند، مشاهده نمایند. این جریانها در پاسخ به استیلکولین آزاد شده به پیوستگاه عصبی – ماهیچهای به وجود میآمدند. این آزمایش اولیه توانست بسیاری از فرضیههایی را که تا پیش از این در مورد جریانهای عرض کانالی مطرح شده بودند، تأیید نماید. یکی از مهمترین فرضیهها، این بود که جریانهای عرض کانالی، رویدادهای شبهپالسی با پتانسیل ثابت و مدتزمان متغیر هستند.
کیفیت نامطلوب تماس پیپتی – ماهیچهای و نویز پسزمینه، ثبت دقیق جریانهای عرض کانالی خارج از پیوستگاه عصبی – ماهیچهای را برای آنها دشوارتر کرده بود. چند سال پس از این آزمایش بود که نهر و سکمن به صورت اتفاقی متوجه شدند که با اعمال یک نیروی مکش بسیار ضعیف از طریق سر پیپت (همراه با ایجاد تغییرات جزئی در روند کلی کار) میتوان مقاومت تماس پیپتی – عضلانی را به بیشتر از یک میلیارد اهم افزایش داد؛ جهشی که چندین قدم رو به جلو محسوب میشد. این تغییرات باعث شد تا بتوان به کمک همین روش اعمال نیروی مکش، بخشی از غشای سلولی را برش داده و به صورت جداگانه مورد مطالعه قرار داد. پس از آن بود که ثبت ولتاژ کانالهای یونی تکی با تفکیکپذیری بالا امکانپذیر شد.
دقیقترین اطلاعات در مورد نقش کانالهای یونی در انتقال بین سیناپسی پیام الکتریکی، از طریق آزمایشهایی به دست آمده که بر روی همین پیوستگاه عصبی – ماهیچهای عضلهی اسکلتی انجام شده است. نورونهای پیشسیناپسی، استیلکولین را در قالب بستههای مجزای چندمولکولی به نام کوانتا (quanta) به فضای پیوستگاه عصبی – ماهیچهای آزاد میکنند. مولکولهای استیلکولین برای مدتزمان کوتاهی به گیرندههای خود بر روی سلول پسسیناپسی (عضله) متصل گشته و باعث برقراری جریان الکتریکی در عرض غشای صفحهی انتهایی عضله میشوند. این جریان صفحهانتهایی در واقع مجموع تمام جریانهای اولیه است که از عرض صدها هزار کانال منتقل شدهاند.
به منظور اندازهگیری هر یک از این جریانهای اولیه به صورت جداگانه، میتوان سر پیپت را در محل صفحهی انتهایی بر روی یک فیبر عضلانی قرار داد. این بخش از غشای فیبر عضلانی دربردارندهی کانال گیرندهی استیلکولین است. اگر غلظت کمی از استیلکولین از طریق محلول داخل پیپت به این محل تزریق شود، جریان اندازهگیری شده توسط پیپت بین دو سطح جا به جا خواهد شد. در یک سطح، عملاً هیچگونه جریانی از کانالها عبور نمیکند، چرا که تمام کانالها بسته هستند. زمانی که یکی از این کانالها در پی اعمال ولتاژ به غشا، از وضعیت بسته به باز تغییر حالت بدهد، جریانی برابر با ۲.۵ پیکوآمپر ناگهان از عرض آن عبور خواهد نمود. پس از یک دورهی زمانی متغیر، کانالی که تا پیش از این باز بود، دوباره به وضعیت بسته برمیگردد. با بسته شدن مجدد کانال، جریان الکتریکی نیز قطع میشود.
این کانال زمانی باز میشود که مولکول استیلکولین به آن اتصال پیدا کرده و فرآیند باز شدن را تسهیل نماید. جدا شدن مولکول استیلکولین از کانال باعث بسته شدن مجدد آن میشود. مدتزمان متغیر و تصادفی وصل بودن استیلکولین به گیرنده و جدا شدن آن، بازتابی از طبیعت احتمالی و غیرقطعی برهمکنشهای بین مولکولهای استیلکولین و گیرندههایشان است. بزرگی جریان نشاندهندهی ظرفیتی است که این کانالها در انتقال یونها دارند. در مورد کانال استیلکولین، دو یون سدیم و پتاسیم عامل انتقال جریان هستند. با مقایسهی بزرگی جریانهای الکتریکی اندازهگیری شده و توزیع مدتهای زمانی، و با در نظر گرفتن پیشبینیهای گوناگون، میتوان تعیین کرد که یونها چگونه با هر مولکول از کانالها وارد برهمکنش میشوند؛ و این برهمکنش چگونه به باز و بسته شدن کانال منجر میگردد.
در سیناپسهای دستگاه عصبی مرکزی، آمینواسیدهایی مانند گلیسین، گاما – آمینوبوتیریک اسید و ال – گلوتامات اصلیترین انتقالدهندههای سیگنال در تماسهای بسیار سریع به حساب میآیند. شکل شبهپالسی جریانهای اندازهگیری شده برای کانالهای متصلشونده به این انتقالدهندهها نشان میدهد، که این کانالها هم به صورت تصادفی باز و بسته میشوند. به همین دلیل، ممکن است عملکرد این کانالها نیز در اساس به عملکرد کانالهای استیلکولین موجود در صفحهی انتهایی شباهت داشته باشد. ولی با این حال، کانالهای متصلشونده به انتقالدهندههای عصبی در دستگاه عصبی مرکزی، پیچیدگی بیشتری دارند. از این جهت که این کانالها ممکن است نیمهباز یا نیمهبسته باشند. حتی ممکن است زیردستههای متفاوتی از این کانالها در قسمتهای گوناگون مغز یافت شوند.
انتقال اطلاعات از دستگاه عصبی مرکزی به پیوستگاه عصبی – ماهیچهای باید با بیشترین سرعت ممکن صورت بگیرد. در آکسونهای پوشیده شده با غلاف میلین که مسئول هدایت این پیامها در مهرهداران هستند، انتقال پیام در امتداد آکسون از طریق کانالهای مشابهی که تا پیش از این توضیح دادیم، صورت نمیگیرد. در مورد این آکسونهای ویژه، هدایت پیام عصبی از طریق کانالهای سریعتری انجام میشود که به تغییرات ولتاژ در غشای سلول پاسخ میدهند.
کنث کول، با توسعهی متد ولتاژ کلمپ، آغازگر راهی بود که در ادامه اروین نهر و برت سکمن با بهینهسازی آن و افزایش تفکیکپذیری نسبت به کانالهای یونی، دریچهی جدیدی به بیولوژی مولکولی سلول گشود.
