Hot start PCR فرایندی است که میتواند احتمال تکثیر قطعات غیراختصاصی را در PCR کاهش داده و میزان تولید محصول موردنظر را افزایش دهد. تکثیر این قطعات ناشی از شروع زودهنگام واکنش در دماهای پایین قبل از آغاز آن است. اساس تکنیک Hot start PCR غیرقابل استفاده کردن یکی از مواد اصلی واکنش است تا زمانی که دمای چرخه اول از دمای مرحله اتصال (Annealing) بالاتر رود. درنتیجه واکنش تکثیر تنها پس از مرحله دناتوراسیون اولیه رخ میدهد. این کار باعث افزایش اختصاصیت PCR میگردد.
Hot start در ابتدا به عنوان تکنیکی برای متوقف ساختن عملکرد تکثیری DNA پلیمراز در دماهای پایین به کار میرفت؛ اما امروزه روشهای دیگری نیز توسعه یافتهاند که مواد اولیه اصلی واکنش را هدف قرار داده و به این ترتیب عملکرد PCR را با جلوگیری از تکثیر قطعات غیرهدف بهبود میبخشند. از جمله این مواد میتوان به یونهای منیزیم، DNA پلیمراز، پرایمرهای الیگونوکلئوتیدی و dNTPها اشاره کرد.
توانایی آزمایش PCR در تشخیص توالی موردنظر در زمینههای مختلفی همچون پزشکی قانونی و تشخیص پزشکی کاربرد دارد. این موارد نیاز به دقت بالایی دارند و درنتیجه تکنیک PCR مورداستفاده باید اختصاصیت، حساسیت و قابلیت تکثیر بالایی داشته باشد. یکی از دلایل کاهش کارایی فرایند PCR تکثیر قطعات غیرهدف و تولید دایمرهای پرایمر و محصولات ناشی از اتصال پرایمر به نقاط غیراختصاصی است. تولید این قطعات برای آزمایش PCR زیانآور است، درنتیجه تکنیکهای فراوانی بای جلوگیری از این اتفاق ارائه شدهاند.
تصور میشود که اتصال غیراختصاصی پرایمر در دمای پایین و شرایط کنترل نشده مرحله آمادهسازی مخلوط واکنش و نیز هنگام اولین افزایش دمای واکنش به ۹۴ درجه سانتیگراد در مرحله دناتوراسیون اولیه انجام میشود. دمای مرحله آمادهسازی در حدود ۲۵ درجه است و برخی آنزیمهای PCR در این دماها فعالیت پلیمرازی قابل توجهی از خود نشان میدهند. همچنین هنگام افزایش دمای مخلوط از ۲۵ درجه به ۹۴ درجه باید از ۷۲ درجه نیز عبور کنیم که دمای بهینه فعالیت آنزیم پلیمراز است.
در این شرایط پرایمرها که به مقدار بسیار بیشتری نسبت به توالی هدف در نمونه حضور دارند، علاوه بر توالیهای هدف، به توالیهای غیراختصاصی نیز متصل میشوند و انتهای ۳’ موردنیاز برای فعالیت آنزیم فراهم میگردد. درصورتیکه دما به حدی برسد که برای فعالیت آنزیم مناسب شود، تکثیر انجام و دایمرهای پرایمر و محصولات حاصل از اتصال نادرست پرایمر تشکیل میشوند. این فرآوردهها در مراحل بعدی PCR نیز به همراه توالی موردنظر مجددا تکثیر شده و با آن در اتصال به پرایمرها رقابت میکنند. در نهایت میزان قطعات غیرهدف افزایش و محصول موردنظر کاهش مییابد.
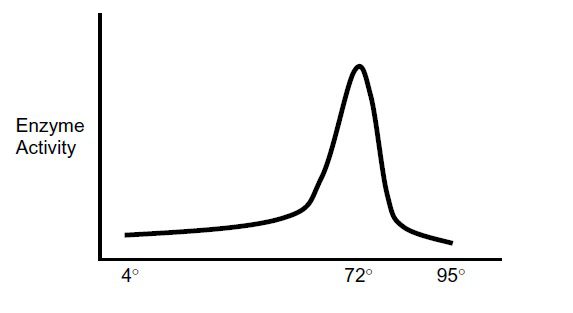
به منظور رفع نواقص ذکر شده، انواع مختلف تکنیکهای hot start PCR به گونهای طراحی شده اند که بتوانند از وقوع این تکثیرهای غیراختصاصی جلوگیری کنند. هدف از انجام این تکنیکها این است که بتوانیم آنزیم پلیمراز را تا دمایی که حداقل بالاتر از دمای ذوب پرایمرها (Tm) است، غیرفعال و بدون استفاده نگه داریم. به عبارت دیگر باید بتوانیم جلوی گسترش پرایمرهای متصل به مولکولهای DNA را در دمای پایین و پیش از شروع نخستین چرخه بگیریم، تا زمانی که به دمای مناسب اولین مرحله دناتوراسیون برسیم و پرایمر و توالی الگو کاملا از هم جدا شده باشند. در این حالت حتی اگر اتصال نادرست پرایمرها اصلا رخ ندهد نیز میزان آن بسیار کاهش خواهد یافت.
این کار با جلوگیری از شرکت یکی از مواد اولیه ضروری در واکنش صورت میگیرد. این ماده معمولا آنزیم DNA پلیمراز است. پس از افزایش دما و شروع چرخه حرارتی، آنزیم پلیمراز عملکرد خود را از سر میگیرد و باعث ادامه گسترش پرایمرها در شرایطی میشود که به نفع هیبریداسیون پرایمرها و توالی هدف اختصاصیشان است. این موارد اساس تکنیک hot start PCR را تشکیل میدهند.
نخستین متدهای hot start PCR از طریق اضافه نکردن تعدادی از مواد اولیه مانند آنزیم پلیمراز و یا کوفاکتور منیزیم در مرحله آمادهسازی مخلوط واکنش و به صورت دستی انجام میگرفتند. افزودن این مواد زمانی انجام میگرفت که مخلوط واکنش به دماهای بالای چرخه حرارتی در نخستین دناتوراسیون (حدود ۸۰ درجه سانتیگراد) میرسید. به عنوان مثال ابتدا دمای واکنش را افزایش داده و سپس با بیرون آوردن مخلوط از دستگاه Thermal cycler به لولهها آنزیم اضافه میکردند.
نوآوری دیگری که در این زمینه صورت گرفت، قرار دادن لایهای از موم میان جزئی که میخواهیم جدا نگه داشته شود، از سایر مواد اولیه بود. به عنوان مثال مخلوط بافر، پرایمرها، یون منیزیم و dNTPها در دمای اتاق تهیه و در ته لوله واکنش قرار داده میشد. این مخلوط سپس به وسیله موم ذوب شدهای که دمای ذوب آن پایین و در حدود ۵۳-۵۵°C است، پوشانده میشد. آنزیم پلیمراز به روی موم افزوده میشد و سدی پدید میآمد که جلوی واکنش این مواد با هم را گرفت. با ذوب شدن موم در دماهای بالای نخستین مرحله دناتوراسیون، آنزیم با سایر ترکیبات مخلوط و واکنش ادامه مییافت. همچنین موم مذاب به سطح لوله میآمد و به عنوان مانعی برای تبخیر عمل میکرد. نسخه سادهتر این روش، استفاده از ذراتی پوشیده شده با موم است که حاوی مواد اولیه واکنش هستند.
هیچ کدام از این روشها ایدهآل نیستند. خارج کردن لولهها از دستگاه و افزودن مقادیر تقریبا تصادفی از آنزیم به تکتک آنها باعث ایجاد خطاهای فراوانی میشود. همچنین استفاده از موم به علت نیاز به صرف زمان برای ذوب موم و نیز دشواری جداسازی محصولات از موم جامد در پایان واکنش، کارایی بالایی ندارد. از زمان معرفی تکنیکهای اولیه که به صورت دستی انجام میشدند تاکنون، روشهای دیگری نیز معرفی شدهاند که انجام این فرایند را آسانتر کرده و مراحلی را که نیاز به دستکاری دارند به حداقل میرسانند.
از جمله این روشها استفاده از موادی است که یون منیزیم موردنیاز برای انجام واکنش را تهنشین میکنند و یا این یون را به صورت ذراتی پوشیدهشده با موم مورد استفاده قرار میدهند. از جدیدترین تکنیکها استفاده از تجهیزات microfluidی است که میتوانند با دقت بالایی میزان مواد اولیه افزودهشده را کنترل کنند. بیشترین میزان پیشرفت در تغییر عملکرد آنزیم DNA پلیمراز رخ داده است و جزو عملیترین روشها است. از جمله این تغییرات میتوان به استفاده از آنتیبادیهای علیه DNA پلیمراز مورد استفاده (آنتیبادی جلوی عملکرد آنزیم را میگیرد تا زمانی که دما به اندازه نخستین دناتوراسیون شود. با رسیدن به این دما آنتیبادی تجزیه و PCR آغاز میگردد)، آپتامرها (الیگونوکلئوتیدهایی که به آنزیم DNA پلیمراز متصل میشوند)، تغییرات شیمیایی، اتصال پروتئینها (protein fusion)، جهشهای نقطهای حساس به دما در آمینواسیدها و لیگاندهای بیاثر (inert) وابسته به دما (به نقاط فعال آنزیم متصل و در دماهای بالا از آن جدا میشوند. با پایین رفتن دما از یک حد آستانه در مرحله اتصال، این مولکولها دوباره متصل شده و باعث غیرفعال شدن آنزیم میگردند.) اشاره کرد. این تغییرات آنزیم پلیمراز را تا زمانی که hot start فعال شود، متوقف میکنند. استفاده از پروتئینهای فرعی (accessory proteins) نیز از روشهای مبتنی بر پلیمراز است، اما در دماهای مختلف با مواد اولیه PCR واکنشهای متمایزی میدهند و درنتیجه بازده بالاتری دارند. استفاده از پرایمرهای تغییریافته نیز از جمله سایر تکنیکها است و شامل استفاده از تغییراتی است که باعث بهبود هیبریداسیون میشوند و یا پرایمرهایی است که با استفاده از فعالیت اگرونوکلئازی ۳’ به ۵’، اشعه فرابنفش و thermal deprotection ؟؟ قابل برداشت هستند. تکنیک جدیدتر، ایجاد تغییر در dNTP ها است.

Hot start PCR خصوصا در مواقعی مفید است که تکثیر غیراختصاصی به علت وجود مقادیر بسیار کم DNA الگو، پیچیده بودن توالی آن مثلا در long PCR و استفاده از جفت پرایمرهای متعدد مثلا در multiplex PCR مشکلساز باشد. این تکنیک همچنین در RT-PCR نیز بسیار حیاتی است و میتواند در تکثیر توالیهایی پیچیده کمککننده باشد.
