colony PCR یا whole cell PCR تکنیکی است که به منظور بررسی وجود تغییر ژنتیکی دلخواه در پلاسمیدهای وارد شده به باکتریها و مخمرها در اثر ترانسفورماسیون، مورد استفاده قرار میگیرد. این فرایند مستقیما روی کلونیهای باکتریایی انجام میشود و طی آن توالیهای هدف به طور مستقیم با PCR تکثیر میشوند، بدون اینکه نیاز به استخراج و خالصسازی DNA پیش از PCR داشته باشیم. این هدف در صورتی محقق میشود که سلولها به تعداد کافی لیز شوند. لیز سلولها در اثر دمای بالای مرحله دناتوراسیون اولیه توالیهای الگو و ترکیب این مرحله با فرایندهای دیگری که DNA را قابل دسترستر میکنند، انجام میگیرد.
مقاله مرتبط: PCR چیست؟
این تکنیک برای رسیدن به این هدف از حساسیت بالای PCR بهره میبرد؛ به این نحو که مقادیر اندک DNA الگوی موجود در نمونهای با آمادهسازی بسیار اولیه، میتواند نواری قابل مشاهده در الکتروفوز ایجاد کند. در نتیجه colony PCR ابزاری قدرتمند برای غربالگری سریع و آسان تعداد فراوانی از کلونیها است تا نتایج مثبت حقیقی از مثبت کاذب تشخیص داده شوند.
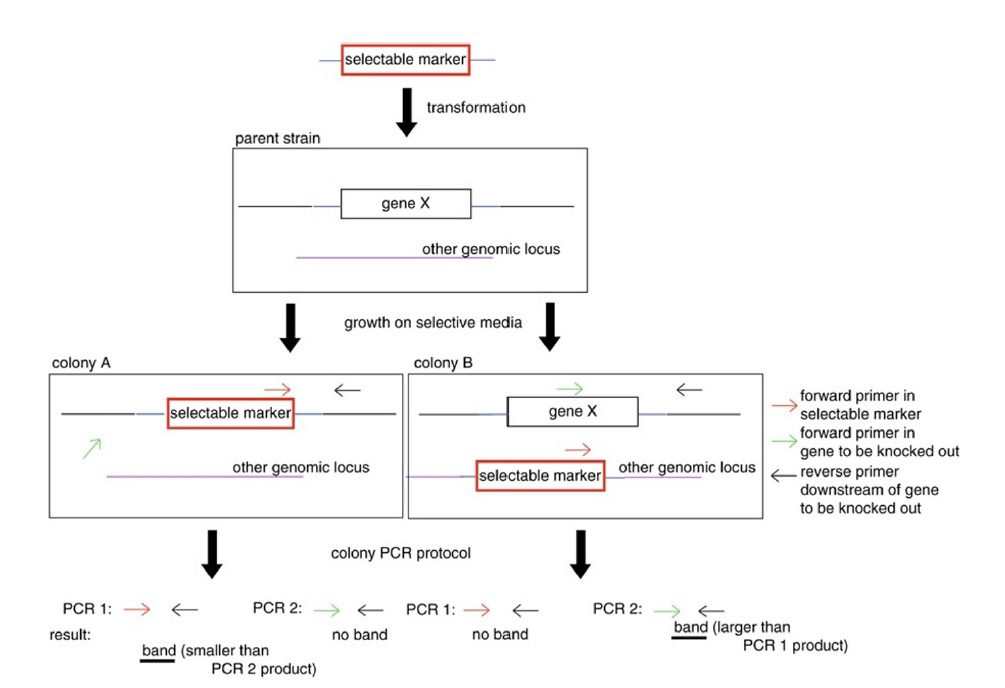
استراتژیهای دستکاری ژنتیکی باکتریها و مخمرها معمولا با همراه کردن تغییر موردنظر با یک مارکر انتخابی، مانند ژن مقاومت به آنتیبیوتیک، و در قالب یک ساختار قابل انتقال به ارگانیسم انجام میگیرد. این ساختار میتواند یک تکه DNA خطی باشد که در این صورت برای الحاق پایدار به ژنوم باید تحت تاثیر نوترکیبی هومولوگ قرار بگیرد؛ و یا اینکه میتواند پلاسمیدی حلقوی باشد. پس از ترانسفورماسیون، ارگانیسم در محیط کشت انتخابی کشت داده میشود.
نتیجه یک ترانسفورماسیون موفق، رشد یک تا چند صد عدد کلونی در پلیت کشتدادهشده است. با این حال، وقایع مختلفی میتواند منجر به باقی ماندن مارکر انتخابی در ساختار ارگانیسم و از دست رفتن تغییر ژنتیکی موردنظر شود. پیامد این موضوع، رشد کلونیها در غیاب این تغییر است، در حالیکه مارکر انتخابی بیان میشود. پس نوعی تکنیک غربالگری به منظور تشخیص کلونیهای دارای ساختار ژنتیکی موردنظر از کلونیهای حامل مارکر انتخابی موردنیاز است.
مقاله مرتبط: مهندسی ژنتیک چیست؟
تشخیص وجود یا عدم وجود یک توالی خاص در سلولها به صورت روتین در زمینههایی همچون میکروبشناسی بالینی، مهندسی ژنتیک و پزشکی قانونی موردنیاز است. colony PCR به این منظور مورد استفاده قرار میگیرد و در بسیاری از موارد جایگزین روشهای قدیمیتری مانند تهیه کشتهای کوچک از چندین کلونی، استخراج و خالصسازی DNA میکروارگانیسمهای موجود در هر کشت و برش با آنزیمهای محدودکننده به منظور مشخص کردن حضور ساختار موردنظر است.
مزیت colony PCR بر استفاده از این تکنیکها، سرعت بیشتر آن و نیز صرفهجویی در هزینه است که در نتیجه حذف مرحله استخراج اتفاق میافتد. حذف این مرحله و در نتیجه به حداقل رسیدن مراحل پردازش نمونه، مزیت دیگری نیز دارد و آن افزایش حساسیت است. این موضوع در مواقعی که مقدار نمونه اولیه محدود است، مانند تحقیقات پزشکی قانونی، اهمیت فراوانی دارد و دلیل این اهمیت آن است که در مراحل خالصسازی، مقداری از نوکلئیکاسید موجود در نمونه از بین میرود. در نتیجه در صورت اندک بودن مقدار ماده آغازگر، عمل خالصسازی مهار خواهد شد. کاهش پردازش نمونه همچنین امکان آلودگی نمونهها را کاهش میدهد و باعث کاهش نتایج مثبت کاذب و افزایش حساسیت PCR میگردد.
در تعدادی از استراتژیهای کلون کردن، ابتدا در یک ارگانیسم ساختار موردنظر ایجاد و پس از بازیابی، توسط PCR تکثیر میشود. درنهایت این ساختار در اثر ترانسفورماسیون وارد یک ارگانیسم دیگر میگردد. colony PCR میتواند مستقیما به منظور تولید محصول موردنیاز برای ترانسفورماسیون دوم استفاده شود.
به منظور انجام colony PCR ابتدا باید مشخص کنیم که نوع ارگانیسم مورد آزمایش چیست و چه ویژگیهایی دارد. چون این فرایند در باکتریهای گرم مثبت، گرم منفی، قارچها و … اندکی تفاوت دارد. در مرحله بعدی باید آماده سازی PCR انجام گیرد. طراحی و سنتز پرایمرها باید پیش از آغاز پروتکل صورت بگیرد و در موفقیت colony PCR بسیار حیاتی است.
پرایمرهایی که برای مشخص کردن الحاق یک ساختار به ژنوم استفاده میشوند، دو دسته هستند: دسته اول اختصاصی ساختار موردنظر و دیگری اختصاصی ژنوم مجاور منطقه الحاق میباشد. پرایمرهای دسته اول یک جفت بوده و میتوانند همان پرایمرهایی باشند که برای تکثیر قطعه الحاق شده از آنها استفاده شده است. دسته دوم پرایمر insert-specific نام دارد و با فاصله نامتقارنی از نقطه الحاق میتواند استفاده شود. ؟؟؟؟ پرایمرهایی که برای تایید نوترکیبی هومولوگ مورد استفاده قرار میگیرند، دو نوع هستند: پرایمر forward مخصوص ساختار الحاق شده است، و پرایمر reverse مخصوص توالیهای پاییندست این نقطه در ژنوم میباشد. (تناقض در انواع پرایمرها- نیاز به بررسی بیشتر)
Colony PCR اختصاصا با طراحی پرایمرهایی سر و کار دارد که در صورت حضور ساختار موردنظر، محصولی اختصاصی با اندازه مشخص تولید میکنند، و در صورت بدون تغییر بودن جایگاه دستکاری شده، محصولی با اندازه متفاوت تولید خواهد شد. پس هم در حضور ساختار و هم در نبود آن محصول تولید خواهد شد. علت این موضوع آن است که با تولید محصول تنها در صورت وجود ساختار مورد نظر، این دو حالت نمیتوانند از هم تشخیص داده شوند: نبود ساختار و انجام نشدن PCR، که در هر دو مورد محصولی ایجاد نمیشود. همچنین بیشترین کارایی colony PCR در حالتی است که طول محصول کمتر از یک کیلوباز باشد.
پس از طراحی پرایمرها، مخلوط PCR آماده و در لولههای PCR که در یخ قرار دارند، ریخته میشود. در مرحله بعدی، از نوک میکروپیپت استریل برای انتقال تعدادی از سلولهای هر کلونی به لوله PCR مربوطه استفاده میگردد. سلولهای مورداستفاده باید از کلونیهای تازه تهیه شوند، چون در این حالت مقدار DNA موجود به حداکثر میرسد. همچنین تعداد سلولها باید بسیار اندک باشد و تهیه این مقدار از طریق تماس محدود نوک پیپت با کلونی انجام میشود. سلولهای زنده میتوانند حاوی مهارکنندههای PCR باشند. همچنین آگارز نیز از مهارکنندههای اساسی PCR است و نباید برداشته شود.
لولهها سپس در دستگاه PCR قرار داده میشوند. چرخه اول دارای مرحله دناتوراسیون طولانی است که باعث لیز سلولها و آزاد شدن DNA آنها میشود. در مرحله بعدی، مقداری از محصول این واکنش برداشته شده و به عنوان الگو در واکنش PCR استاندارد مورد استفاده قرار میگیرد. یک نمونه چرخه حرارتی در جدول ۱ نمایش داده شده است. این برنامه در تکنیکهای مختلف colony PCR متفاوت است.
| شماره چرخه | دناتوراسیون | اتصال | گسترش |
| ۱ | ۹۵°C به مدت ۴ دقیقه | ۵۰°C به مدت ۲ دقیقه | ۷۲°C به مدت ۲ دقیقه |
| ۲۵-۳۰ | ۹۴°C به مدت ۱ دقیقه | ۵۴°C به مدت ۲ دقیقه | ۷۲°C به مدت ۱ دقیقه |
| چرخه پایانی | ۷۲°C به مدت ۱۰ دقیقه، سپس سرد کردن تا ۱۰°C |
جدول ۱. چرخه حرارتی colony PCR؛ منبع: Cold Spring Harb. Protoc. ;2006
در پایان محصولات در ژل آگارز الکتروفورز میشوند. در صورتیکه نوار موردنظر مشاهده شود، نتیجه قطعا مثبت است (فرض میکنیم که آلودگی وجود نداشته است). در صورتیکه نوار مشاهده نشود، نتیجه ممکن است منفی کاذب باشد. علت این موضوع احتمالا نبود DNA کافی و یا وجود مهارکنندههای فراوان باشد.
