ژن درمانی شامل طیف وسیعی از تکنولوژیها میشود که میتوانند برای درمان گروههای مختلف بیماری استفاده شوند. که در بحث این تکنولوژیها باید تمایزها در نظر گرفته شود.
مکانیسمهای متفاوت ژن درمانی:
منظور از ژن درمانی، قرار دادن مادهی ژنتیکی برای اصلاح یک ناهنجاری است که میتواند شکلهای متفاوتی داشته باشد:
- الحاق ژن: نسخه جدیدی از ژن وارد سلول میشود.
- تغییر ژن: ژنی که در آن جایگاه قرار دارد، تغییر میکند.
- تشریح ژن: ژن خاصی حذف شده و یا با همتای نرمال خود جایگزین میشود.
چنین تغییر ژنتیکی، شامل وارد کردن ماده ژنتیکی جدیدیست که مستقیما پروتئینها را کد میکند و یا ژنهای موجود را با سرکوب یا تقویت ژن خاصی، تحت تاثیر قرار میدهد.
چشمانداز فعلی ژن درمانی در انسان شامل ژن درمانی با تغییر ژن و تشریح ژن نمیشود زیرا این دو خیلی پیچیدهتر از وارد کردن ژن به سلولاند. چنین دستکاریهای ژنی فعلا در برخی ویروسها، مخمر و باکتری قابل انجام است. شاید تکنولوژیهای ضروری که امکان تشریح ژن و یا کنترل تغییر ژن در انسان و حیوان را داشته باشد، در آینده کشف شود. در این مقاله، منظور از ژن درمانی، الحاق ژن است.
ژن شامل دئوکسی ریبونوکلئیک اسید (DNA) است. DNA نیز زنجیرههای دراز مولکولی به نام نوکلئوتید دارد. تمام اطلاعات ژنتیکی وراثتی در دنباله نوکلئوتیدی DNA کدگذاری میشود. DNA شامل اطلاعات تمام مواد تشکیل دهنده است و آنها را کنترل میکند.
هر توالی DNA اطلاعات پروتئینهای مخصوص خود از جمله: آنزیمها، هموگلوبین یا رسپتورهای متنوع سطح سلول را دارند. توالیهای DNA که اطلاعات یک محصول را دارند، ژن نامیده میشوند. DNA در ژنهای سوماتیکی با درمان سلولهای زایا متفاوت نخواهد بود. زیرا ممکن است توالیهای متفاوتی بسته به اینکه ژن چگونه در یک آزمایش خاص تنظیم میشود به مجاورت ژن اضافه شوند.
برای مثال، در درمان ژنی سلولهای سوماتیکی نحوه عملکرد پزشک در راستای اصلاح ناهنجاری ژنتیکی که موجب نقص آنزیمهای ADA یا PNP میشود، است. نقص ADA در اثر کمبود یا عدم وجود آنزیم آدنوزین دآمیناز صورت میگیرد. نقص PNP نیز، ناهنجاری متفاوتی با همانندهای بالینی است که در اثر کمبود یا عدم وجود آنزیم پورین نوکلئوزید فسفوریلاز اتفاق میافتد. نقص ژنی، در اثر توالی اشتباه DNA به دلیل جهش است. جهش به دلیل جایگزینی اشتباه یک نوکلئوتید یا از دست دادن یک یا چند نوکلئوتید در قسمتی از توالی شکل میگیرد. توالی تغییر یافته، آنزیم غیرنرمالی را کد میکند که عملکرد ندارد و یا باعث تولید محصولات پروتئینی ناکافی میشود.
با کمبود آنزیم یا وجود حالت بدون کاربرد آن ،واکنشهای شیمیایی وابسته به ADA یا PNP به حالت نرمال در سلول صورت نمیگیرد که باعث تجمع برخی مواد شیمیایی که ADA یا PNP آنها را از بین میبرند یا کمبود موادی که این آنزیمها آنها را تولید می کنند، میشوند.
این ناهنجاریها صفات ژنتیکی مستعد به وراثت اند و معمولا اگر قبل از دو سالگی درمان نشوند، کشندهاند.
ناهنجاریهای ایمنی شدید میتوانند با پیوند مغز استخوان درمان شوند. (Friedrich, 1984) اما تمام بیماران واجد شرایط پیوند نیستند و فرایند آن بسیار پرهزینه و پرخطر است. نقص ADA یا PNP میتواند با ژن درمانی سلول سوماتیک درمان شود: با برداشت مغز استخوان فرد مبتلا، الحاق ژن نرمال برای تولید آنزیم به آن و بازگرداندن سلول درمان شده به بدن بیمار در جایی که بتواند رشد کند و شاید آنزیم موردنیاز به اندازه کافی تولید شود و ماده شیمیایی مضر را از بین برود، بدین ترتیب عملکرد ایمنی به حالت عادی برمیگردد. ژن درمانی سعی در بازگردانی عملکرد آنزیم با الحاق DNA برای تولید پروتئین نرمال، دارد.
به جای درمان فقط مغز استخوان یا سلولهای سوماتیک، سلولهای زایا که سلولهای جنینی اند میتوانند تحت درمان قرار گیرند تا یک نقص ژنتیکی را اصلاح کنند. درمان سلول زایا میتواند تمام سلولهای بدن را تحت تاثیر قرار دهد که هر دوی سلولهای سوماتیک و زایا را شامل میشود. در بحث نقص ADA یا PNP , ژن درمانی سلول زایا میتواند با الحاق ژن صحیح به جنین بیمار حین باروری صورت گیرد. که باعث ایجاد ژن PNP یا ADA نرمال با تولید آنزیم نرمال در بافت است.
ژن درمانی سوماتیک
در ژن درمانی سوماتیک، ژنهای درمان شده به سلولهاس سوماتیک منتقل میشود. اما ژنهای درمان شده به نسل بعد منتقل نمیشوند، بنابراین فرزندان بیمار کماکان احتمال ابتلا دارند. این نوع ژن درمانی، در درمان بیماریهای مختلف مانند: سیستیک فیبروزیس، دیستروفی عضلانی، سرطان و برخی بیماریهای عفونی، موثر است. با این حال، اثربخشی ژن درمانی سوماتیک معمولا کوتاه مدت است.
ژن درمانی میتواند به دو گروه طبقه بندی شود: داخل و خارج بدن موجود زنده.
ژن درمانی خارج از بدن موجود زنده
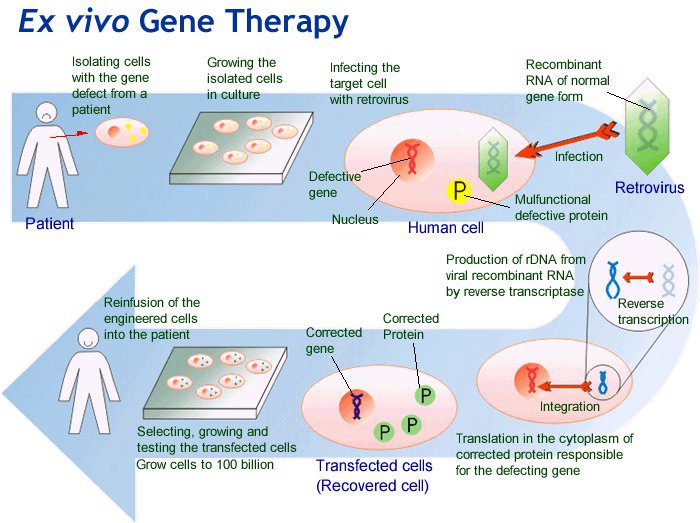
مزایای نسبی ژن درمانی ex vivo، عبارتند از: توانایی هدف قرار دادن انواع خاصی سلول برای تولید ژن مورد علاقه قبل از جذب سلولها به میزبان است. علاوه بر این سازگار با ایمنی است، زیرا سلولها از بیمار بدست میآیند تا از رد پیوند جلوگیری شود. معایب بالقوه این روش شامل: نگهداری آن و تغییر ژنتیکی در آزمایشگاه است، پس سلول میزبان باید قادر به تکثیر باشد. بنابراین برخی انواع سلولها مانند نورونها نمیتوانند اهداف انتقال برای ژن درمانی ex vivo قرار گیرند. علاوه بر این این کار تهاجمی است. پیوند سلولها نسبت به تزریق سوسپانسیون وکتورهای ژن درمانی داخل بدن، یک فرایند تهاجمی درونی است.
ژن درمانی داخل بدن موجود زنده
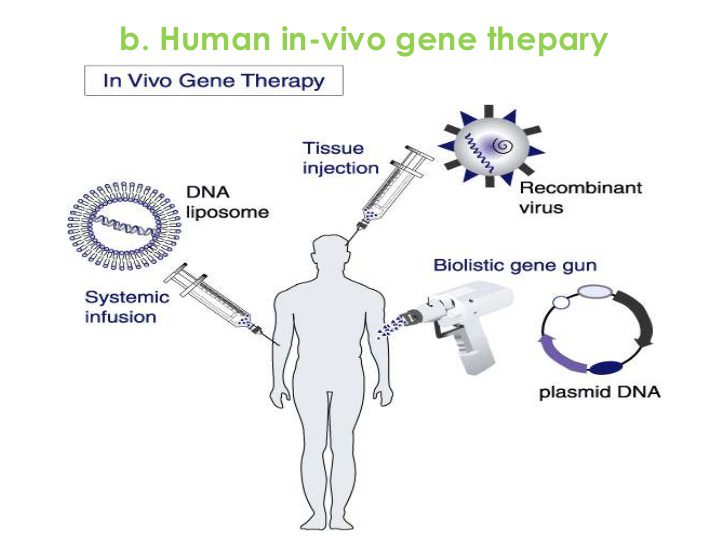
ژن درمانی in vivo ، محصولات مستقیم مواد ژنتیکی به داخل بدن انسان وارد می شود. روشهای فیزیکی مورد استفاده در این روش مبتنی بر ایجاد منافذ گذرا بر غشای سلول با روشهای مکانیکی، الکتریکی، اولتراسونیک، هیدروداینامیک یا انرژی لیزری است. با این کار ورود DNA به سلول هدف تسهیل میشود. بافت هدف این تکنیک شامل پوست، ریه، روده بزرگ، عضله، پانکراس، کبد، مغز استخوان، طحال و مغز است.
مزیت ژن درمانی in vivo ، سادگی آن است. دستکاری ژنی توسط تک مرحلهی تزریق وکتور به ارگان مورد نظر جهت اصلاح اختلالات صورت میگیرد. علاوه براین درصد تهاجمی بودن این روش حداقل است که دلیل آن فرایندهای ساده و ایمنی بکار رفته در این روش است. علاوه بر این، این روش قابل تکرار است. با استفاده از روشهای دستکاری ژنی in vivo، میتوان از همان محل برای تزریق دوباره استفاده کرد. با این حال پتانسیل زیانهای مرتبط با این روش، شامل: غیر اختصاصی بودن عفونت سلول هدف است. با تزریق وکتور به CNS،انواع مختلفی از سلول میتواند آلوده شود، مثل:نورونها، گلیا، سلولهای عروقی. علاوه براین در این روش ممکن است سمیت ایجاد شود. برخی وکتورهای داخل بدن برای سلولهای میزبان سمیاند که پاسخهای ایمنی را به ارمغان میآورند.
ژن درمانی سلولهای زایا
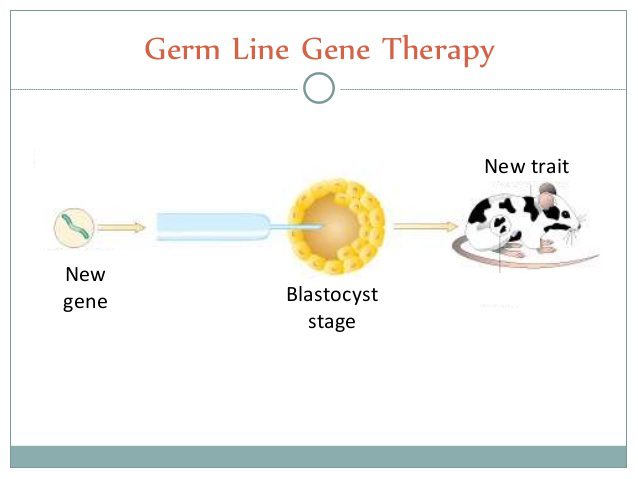
دو روش اصلی انجام ژن درمانی ژرمینال عبارتند از : استفاده از تکنیک لقاح آزمایشگاهی برای درمان رویانی که نقص ژنتیکی جدی را قبل از لانه گزینی در رحم مادر دارد و عملکرد برخی متخصصان برای حذف ژنهای معیوب از سلولهای زاینده برخی بزرگسالان دچار نقص برای اجتناب از انتقال آن به نسلهای بعد است. مزایای این روش نسبت به ژن درمانی سوماتیک، عبارتند از داشتن فرزند سالم، کارایی و صرفه جویی در هزینه است.
به طور خلاصه، نتیجه ژن درمانی سوماتیک،محدود به سلولهای اعضای بدن بیمار است و به نسل بعد منتقل نمیشود. تمام ژن درمانیهایی که تا به امروز صورت گرفته بر سلولهای سوماتیک انجام گرفته است. در حالیکه تصحیح ژن سلول زایا باعث ایجاد تغییر ژنتیکی در تمام سلولهای بدن و انتقال آن به فرزندان میشود. مهندسی سلولهای زایا در بسیاری از کشورها بحث برانگیز و ممنوع است.

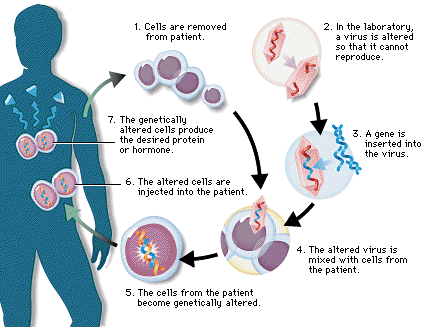
مفید
مفید و خوب