QF-PCR سالهاست که به عنوان یکی از روشهای تشخیص پیش از تولد مورد استفاده قرار گرفته است و روشی مقرون به صرفه، دقیق و سریع برای تشخیص آنوپلوئیدیهای معمول میباشد. از مزایای اختصاصی این روش میتوان تشخیص تریپلوئیدیها، موزائیسم و آلودگی توسط سلولهای مادری (maternal cell contamination=MCC) را نام برد.
در دهه ۱۹۵۰، مجموعه کروموزومهای انسانی به درستی شناخته شدند و ۳ سال بعد از آن نیز، علت سندروم داون کشف شد. در سال ۱۹۶۹، نخستین تشخیص پیش از تولد سندروم داون به کمک کشت سلولهای مایع آمنیوتیک (Amniotic Fluid=AF) انجام شد. به علت ریسک بالای آمنیوسنتز و نیاز به افراد با تخصص بالا، این کار برای سالها در مراکز معدود و تنها برای افراد با خطر بالای تولد نوزاد مبتلا به سندورم داون انجام میشد. تشخیص این افراد در ابتدا بر اساس سن مادر صورت میگرفت اما بعدها روشهای غربالگری اختصاصیتری به این منظور شناسایی شدند؛ مانند مارکرهای سونوگرافی.
با ایجاد روش سونوگرافی real-time، انجام آمنیوسنتز نیز کمخطرتر شد. بعدها پیدایش روش CVS (Chorionic Villus Sampling) امکان پیشبینی سندروم داون را در سه ماهه اول ایجاد کرد. کشت سلولهای مایع آمنیونی، ویلیهای کوریونی و خون جنینی و تهیه کاریوتایپ از آنها، به منظور تعیین جنینهای دارای تریزومی ۲۱ و سایر ناهنجاریهای کروموزومی از اوایل دهه ۱۹۷۰ در سراسر جهان در حال انجام شدن است. گزارش نتایج کاریوتایپ، حدود ۲ هفته زمان میبرد. این زمان به منظور تهیه تعداد کافی از سلولها و تفسیر نتایج مورد نیاز است.
افرادی که دارای ریسک بالای سندروم داون هستند نیاز به روشهای سریعتری برای تایید و یا رد سندروم داون و سایر ناهنجاریها دارند تا بهتر بتوانند بارداری را مدیریت کنند. در صورتی که نتایج نرمال باشند، از میزان استرس این افراد کاسته خواهد شد و در صورتیکه غیرنرمال باشند، امکان تصمیمگیری سریعتر در مورد ادامه بارداری فراهم خواهد شد.
در اواسط دهه ۱۹۹۰ تکنیک FISH (Fluorescent in situ Hybridization) به عنوان روشی سریع برای تشخیص تعداد کروموزومهای ۲۱ در سلولهای کشتنشده معرفی شد. استفاده از پروبهای بیشتر امکان بررسی تریزومی کروموزومهای ۱۳ (سندروم Patau)، ۱۸ (سندروم Edwards) و اختلالات تعدادی کروموزومهای جنسی را فراهم میکند. FISH در عرض ۱۸ تا ۲۴ ساعت انجام میشود؛ اما نیاز به نیروی کار زیادی دارد، هزینه تهیه پروبها بالاست و درنتیجه تنها قابلیت انجام بر روی تعداد محدودی از نمونهها را دارد.
معرفی QF-PCR
QF-PCR (Quantitative fluorescent PCR) برای نخستین بار در سال ۱۹۹۳ ارائه شد و در اواسط دهه ۱۹۹۰ پژوهشهای گستردهای بر روی آن صورت گرفت که به کشف روشهای مبتنی بر QF-PCR برای اختلالات کروموزومهای جنسی نیز منجر شد. نخستین استفاده از این تکنیک در کلینیک در سال ۲۰۰۱ انجام گرفت.
مقاله مرتبط: PCR چیست؟
اساس روش QF-PCR تعیین تعداد کروموزومها با تکثیر توالیهای DNA تکراری پشت سر هم (STR) اختصاصی هر کروموزوم است. این توالیها از لحاظ اندازه پلیمورفیک هستند و بسته به تعداد تکرارهای هر STR طول آنها بین کروموزومها و افراد مختلف متفاوت است. تکثیر این قطعات با استفاده از PCR و پرایمرهای فلورسنت انجام میگیرد.
محصولات PCR که با مواد فلورسنت لیبل شدهاند توسط الکتروفورز جداسازی میشوند و یا میتوان مقادیر آنها توسط آنالیزورهای ژنتیکی اتوماتیک (automated genetic analyzer) مانند ۳۱۰۰ genetic analyzer بررسی کرد. نتایج به صورت قلههایی مشاهده میشوند. تعداد نسبی کپیهای هر الل در مورد هر مارکر با در نظر گرفتن نسبت تعداد قلهها و نیز ارتفاع آنها به دست میآید. نتیجه آزمایش بسیار سریع و در حد ۲۴ تا ۴۸ ساعت آماده میشود.
استخراج DNA موردنیاز برای انجام PCR از سلولهای مایع آمنیونی (AF)، نمونههای CV و یا خون جنینی، به صورت کشت نشده استفاده میشود. نحوه آمادهسازی نمونه، فرایندهای استخراج و سایر مراحل بین مراکز مختلف متفاوت است. به عنوان مثال میتوان از چندین ویلی که از نقاط مختلف بیوپسی برداشته شدهاند استفاده و آنها را با استفاده از آنزیمها و یا فرایندهای فیزیکی تخریب و DNA را استخراج کرد.
مقاله مرتبط: تکنیکهای استخراج DNA
الگوی اللی که دارای دو قله هم اندازه (۱:۱) در ناحیه یکسانی از کروموزوم باشد، نشاندهنده دو کپی از ناحیه موردنظر است و درنتیجه فرد نرمال و هتروزیگوت است. در صورتی که فرد برای الل موردنظر هوموزیگوت باشد تنها یک قله مشاهده میشود. این اتفاق در افراد مونوزومی مانند سندروم ترنر نیز رخ میدهد. الگوی اللی تریزومیها به صورت ۳ قله هماندازه (۱:۱:۱) و یا دو برابر بودن یکی از قلهها نسبت به دیگری (۲:۱ و یا ۱:۲) است. حالت دوم به علت تاثیر میزان دوز (dosage effect) ایجاد میشود که آن هم ناشی از وجود بیش از حد یکی از اللها است.
سلولهای تریزومی ممکن است در اثر جدا نشدن کروموزومها در میوز و یا میتوز ایجاد شوند. در صورتیکه نتیجه QF-PCR وجود حداقل یک مارکر با ۳ نوع الل دارای طولهای متفاوت باشد، بارداری از نوع تریزومی است و اشکال در میوز رخ داده است. در صورتیکه الگوی ۲:۱ مشاهده شود، نشان از وجود اشکال در میوز و یا میتوز و درنتیجه نشاندهنده یک بارداری عادی با خطاهای رخداده در حین میتوز است که به موزائیسم منجر میشود.
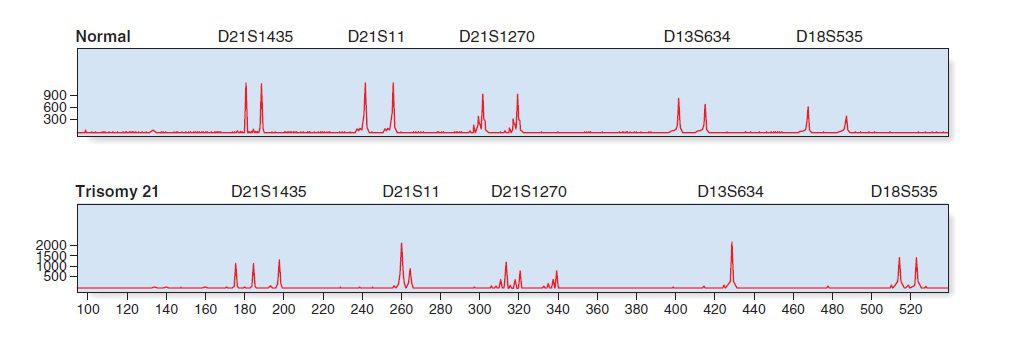
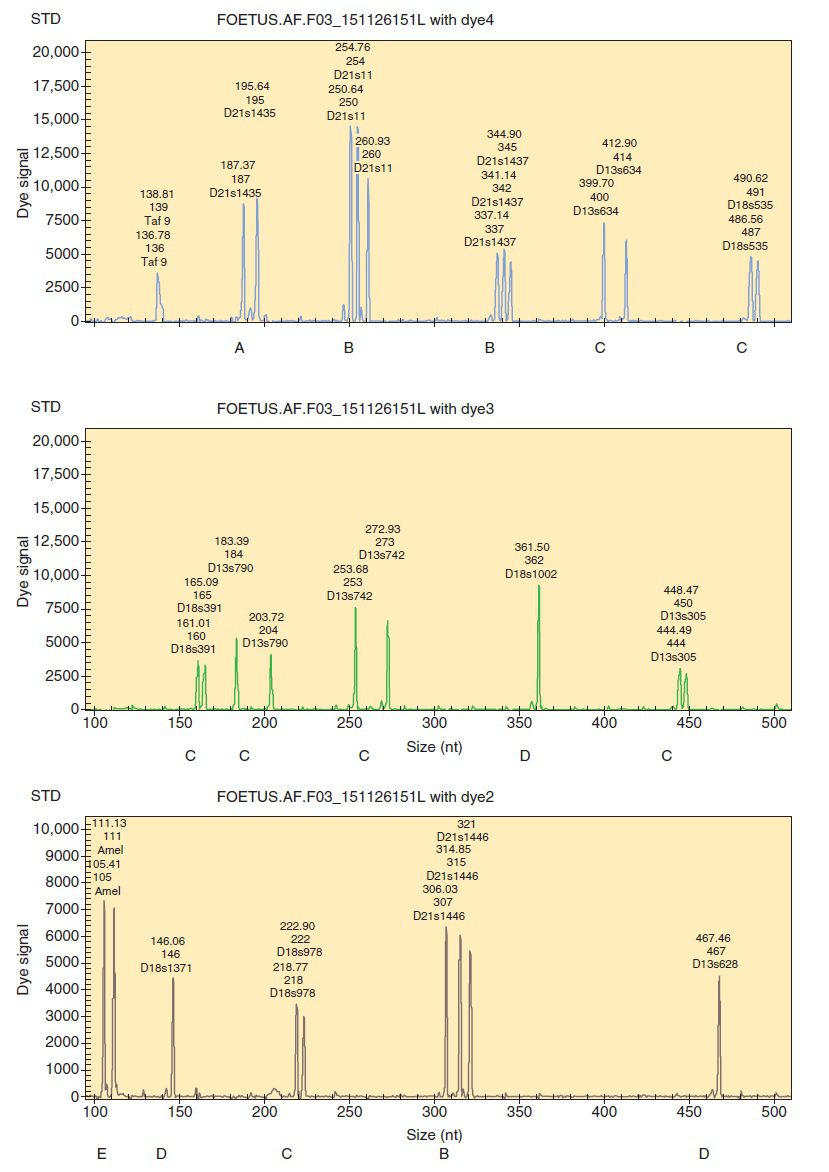
این روش همانند تکنیک FISH برای تمامی کروموزومها قابل استفاده است، اما معمولا تنها کروموزومهای ۱۳، ۱۸، ۲۱ و کروموزومهای جنسی مورد بررسی قرار میگیرند. برای انجام این بررسی از Multiplex-PCR استفاده میشود و تعداد مارکرهای به کار رفته برای هر کروموزوم ممکن است تا ۶ عدد نیز برسد. این کار زمان و هزینه را نسبت به انجام PCRهای جداگانه به طرز قابل توجهی کاهش میدهد.
مقاله مرتبط: تکنیک Multiplex PCR
از جمله مشکلات موجود در بررسی آنوپلوئیدیهای کروموزومهای جنسی این است که، آنالیز مارکرهای STR نمیتواند افراد هوموزیگوت و مونوزومی را از هم تشخیص دهد. هنگامی که STRهای اختصاصی کروموزوم X استفاده میشوند، ممکن است الگوی QF-PCR به دست آمده برای افراد XX هوموزیگوت غیرقابل افتراق از افراد دارای یک کروموزوم X در سندروم ترنر باشد. افزودن مارکرهای کروموزوم X بیشتر میتواند احتمال وقوع این مشکل را کاهش دهد، اما آن را حذف نمیکند. در این موارد تست کروموزومهای جنسی باید به صورت جداگانه انجام شود.
QF-PCR میتواند تریپلوئیدیها را نیز شناسایی کند. نتایج حاصل از QF-PCR به حدی مطمئن هستند که در صورت اثبات اختلالات کروموزومی میتوان اقدامات لازم را انجام داد. طی مطالعهای که روی ۲۲۵۰۴ نمونه انجام شد، ۹۸.۶ درصد از تشخیصها در کروموزومهای اتوزوم درست انجام گرفته بودند؛ این میزان در FISH تنها ۶۵ درصد است. بیشترین نتایج منفی کاذب در آنوپلوئیدیهای کروموزومهای جنسی به دست آمده بودند. با این حال این تست غالبا به عنوان غربالگری در نظر گرفته میشود و باید نتایج کاریوتایپ نیز مدنظر قرار بگیرند.
QF-PCR مزایایی نسبت به FISH دارد. QF-PCR بر روی تعداد کمتری از سلولها نیز قابل انجام است و چون آنالیز آن میتواند به سادگی automated شود، امکان پردازش تعداد بیشتری از نمونهها به صورت همزمان فراهم است. همانطور که اشاره شد این روش نسبت به FISH دقیقتر است و به نیروی کار کمتری نیاز دارد. در نتیجه بر خلاف روش FISH که تنها برای افراد کمی انجام میگرفت، QF-PCR این قابلیت را دارد که برای تمام افراد بارداری که از آنها نمونهبرداری شده است، استفاده شود.
QF-PCR همچنین میتواند سایر ردیفهای سلولی موجود در نمونه را تشخیص دهد. استفاده از مارکرهای میکروستلایت علاوه بر تعیین تعداد کپیهای توالی مارکر، میتواند ژنوتیپ نمونه مورد آزمایش را نیز فراهم کند. مزیت این موضوع مشخص شدن سایر سلولهای حاضر در نمونه است و میتواند MCC، موزائیسم، کایمریسم، ژنوتیپ دوقلوها و دوتخمی یا تکتخمی بودن آنها، بارداریهای مولار و آلودگی خارجی را تشخیص دهد.
تعیین MCC در هر دو نمونه کشت نشده AF و CV برای جلوگیری از تشخیص اشتباه ضروری است. MCC الگوی خاصی به مارکرهای هر کروموزوم میدهد و در بسیاری از موارد از موزائیسم قابل افتراق است. MCC غالبا در نمونههای AF آلوده به خون یافت میشود. در مورد نمونههای CV وجود MCC به کیفیت بیوپسی و مراحل جداسازی ویلیها دارد. در صورتیکه ژنوتیپ دیگری در نمونه CV یک جنین مونث یافت شود، نتایج QF-PCR و کاریوتایپ باید به دقت تفسیر شوند، چون ممکن است عمده سلولهای مورد بررسی منشا مادری داشته باشند. در این گونه موارد برای تفسیر مطمئنتر نتایج ممکن است نیاز به نمونه خون مادری و نیز AF باشد.
مجموع این ویژگی ها باعث میشود که QF-PCR به عنوان آزمایش مکمل و حتی به مرور جایگزین روشهای سیتوژنتیکی متداول در تشخیص پیش از تولد شود.
