یکی از خصوصیات اصلی بسیاری از بیماری های عصبی، تجمع آهسته رسوبات پروتئین در سلول های عصبی مغز می باشد. از رایج ترین شکل بیماری زوال عقلی، از آلزایمر گرفته تا انسفالو ترومای مزمن یا بیماری های زوال عقلی که صدمات تکراری در سر ایجاد می کند؛ همگی در اثر رسوب پروتئین رخ می دهد.
Rauch و همکارانش درباره ی سرنخ هایی که موجب گسترش پروتئین مضر می شود؛ در مجله ی Nature ارائه دادند؛ آن ها گیرنده های سطح سلولی را که اجازه حرکت پروتئین تاو در بین نورون ها می دهد، شناسایی کردند.
آسیب شناسی پروتئین تاو
در اشکال تاو مرتبط با زوال عقلی، یا تاووپاتی، پیشرفت بیماری با گسترش رسوبات تاو در مغز ارتباط دارد. آسیب شناسی نشان می دهد؛ تاشدگی نادرست تاو و ورود آن به نورون های سالم علت بیماری است. تاو پاتولوژیک در تعامل با حالت طبیعی (فیزیولوژیکی) موجود در نورون، به عنوان الگویی برای عملکرد نادرست پروتئین طبیعی عمل می کند و باعث آسیب شبکه های عصبی می شود.
بنابراین علاقه زیادی به توضیح مکانیسم هایی که به بیماری تاو اجازه می دهد تا از یک نورون خارج شده و وارد دیگری شود، وجود دارد.
انتشار پروتئینهای بیماری زا در مغز یک فرآیند فعال است؛ به جای اینکه به سادگی منجر به مرگ نورونهای آسیب دیده و تجزیه و تحلیل محتوای آنها شود. غشاهای خارجی هر دو سلول، اصلی و هدف، به طور فعال در تعامل با یکدیگرهستند. به طوری که تاشدگی نادرست پروتئین تاو میتواند با پروتئین تاو فیزیولوژیکی در سیتوپلاسم سلولهای دریافت کننده برهمکنش کند.
Rauch و همکارانش در این فکر بودند که آیا یکی از اعضای خانواده پروتئین، لیپوپروتئین(LDLR) با چگالی پایین در سطح عصبی میتواند کلید ورود باشد؟!
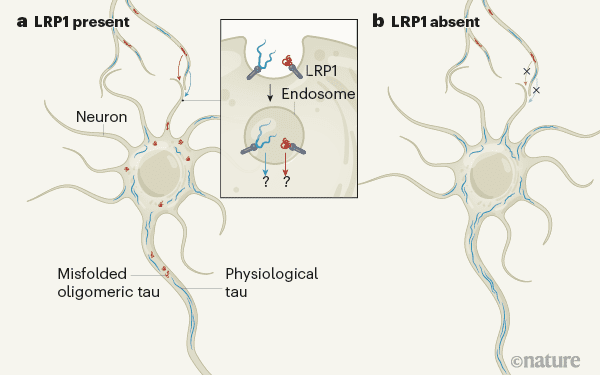
گیرنده سطحی برای جذب پروتئین تاو. اشکال نادرست پروتئین تاو می تواند از طریق نورون ها در بیماری عصبی تولید شود. Rauch و همکارانش کشف کرده اند(a)؛ که پروتئین حاوی غشای LPR1 به عنوان گیرنده برای هر دو حالت طبیعی (فیزیولوژیکی) تاو، و همچنین برای رشته های کوتاه (الیگومرها) تاو، نادرست عمل می کند. اتصال بین LPR1 و تاو منجر به جذب تاو به سمت نورون ها و گسترش آن از طریق اتصال به شبکه های عصبی می شود. پس از وارد شدن، تاو در محفظه های محدود، غشایی موسوم به اندوزوم ساکن می شود. نحوه فرار آن از طریق غشای اندوزوم به داخل سیتوپلاسم ناشناخته است. b نشان می دهد که عدم وجود .LPR1، از انتقال تاو از طریق مغز در موش های زنده جلوگیری می کند و به طور بالقوه مانع از گسترش آسیب شناسی می شود. (تائو فیزیولوژیکی در همه نورون ها ایجاد می شود و علی رغم عدم انتقال، در سراسر شبکه های عصبی نیز وجود دارد.)
از دست دادن LRP1 سبب چه می شود؟
نویسندگان همه اعضای خانواده LDLR را به طور جداگانه، از نورون های رشد یافته در محیط کشت را حذف کردند. آن ها نشان دادند؛ كه از دست دادن LRP1 به طور خاص، باعث کاهش تاو در نورون ها می شود. جالب اینجاست که در ازبین رفتن ورود کلیه اشکال محلول، فیزیولوژیکی تاو و توده های کوچک تجمع دهنده (الیگومرها) تائولوژیک دخیل بوده است.
نقش LRP1 چیست؟
LRP1 می تواند واسطه انتقال، هم از نظر فیزیولوژیکی و هم از نظر پاتولوژیکی باشد. (انتقال تاو فیزیولوژیکی از طریق شبکه های عصبی قبلاً شرح داده شد، اگرچه نقش آن مشخص نیست.) همچنین دریافتیم که از بین رفتن LRP1، فقط بخشی از جذب “قطعات فیبریل” بزرگ تر تاو را مختل و مسدود می کند. با این حال این قطعات ممکن است از طریق مکانیسم های بلعیده شدن که کمتر در نورون ها شناخته شده است، صورت گیرد.
همچنین نویسندگان دریافتند: تاو برای اتصال به LRP1 با عوامل دیگری ازجمله حمل کننده ی چربی هاApoE رقابت می کند. آن ها در ادامه به الگوبرداری از مناطقی که تاو و LRP1 در تعامل هستند، پرداختند.
در بررسی صورت گرفته، دو دمین دربخشی ازLRP1 خارج از سلولی (ectodomain) و همچنین اسیدهای آمینه نظیر لیزین موجود در تاو که موجب بیماری می شود، نشان داده شد. هدف قرار دادن این قسمت های باقی مانده با مکانیسم غیر فعال سازی شیمیایی، مانع از جذب تاو در نورون ها شده و اهمیت آن ها را برجسته می کند.
بررسی ارتباط میان LRP1 و پروتئین تاو
یافته های حاصل از کشت سلولی همیشه به طور کامل در بدن (شرایط in vivo) ترجمه نمی شوند. محققان برای آزمایش ارتباط میان LRP1 در انتقال پروتئین تاو از طریق شبکه های مغزی، از کاهش میزان بیان LRP1 در مغز موش واز بیان ژن های تاو جهش یافته در مغز انسان استفاده کردند. این تاو جهش یافته، به آسانی از طریق مغز موش های وحشی گسترش می یابد. اما نویسندگان دریافتند که این ماده در موش هایی که فاقد LRP1 هستند، محدود به محل بیان است.
این یافته های شگفت انگیز نشان می دهد که LRP1 در واقع یک کلید برای انتقال تاو در مغز های سالم است.
نویسندگان درباره ی تشخیص تاشدگی نادرست تاو انسانی در مناطق مغزی دور از محلی که در آن گروه بیان پروتئین را القا کرده بود، محدود کرده و موش ها را در مراحل اولیه گسترش تاو تجزیه و تحلیل کردند.
علاوه بر این، هیچ نشانه ای وجود ندارد که تاو جهش یافته ی منتقل شده در مغز، شاهد صفحات بتا که یکی از ویژگی های رسوب تاو می باشد باشیم. در واقع هیچ مدرکی مبنی بر اینکه سلامت عصبی در این مغزهای تحت کنترل، تأثیر منفی داشته، وجود ندارد. بنابراین، نشان دادن قطعی LRP1 در گسترش آسیب شناسی تاو یا برعکس، نشان دادن این امر که مهار LRP1 می تواند مانع پیشرفت پاتولوژی شود، جلوگیری می کند.
شناسایی گیرنده ها
شناسایی گیرنده ها اجازه می دهد؛ تاو به سلول های عصبی دسترسی پیدا کند و پیشرفت بزرگی در شناخت ما از زیست شناسی تاو و گسترش آن در مغز به دنبال دارد.
درحقیقت چشم اندازی را برای تجزیه و تحلیل دقیق ازورود و خروج داخل سلولی و رویدادهای سیگنالینگ به دنبال وارد شدن تاو، در هر دو فعال شدن شرایط عادی و آسیب شناختی ایجاد می کند. این ممکن است به تشریح نقش ضعیف درک شده برای انتقال تاو فیزیولوژیکی از طریق شبکه های عصبی کمک کند.
این امر به طور مستقیم با تلاش هایی که جهت متوقف کردن گسترش تاو از طریق روش های درمانی آنتی بادی، مرتبط است؛ زیرا بیشتر این رویکردها بین فیزیولوژیکی و پاتولوژیک تمایزی قائل نمی شوند.
شناسایی LRP1
شناسایی LPR1 به عنوان دروازه ورودی عصبی برای تاو امکان بررسی سیستم سیگنالینگ متفاوت LPR1 که توسط تاو امکان پذیر است فراهم می کند. مشاهدات پایه مربوط به تغییرات نورون هایی می باشد که پروتئین تاو را دریافت می کنند. دانستن این وقایع اولیه، برای یافتن راهکارهایی برای مبارزه با بیماری های مرتبط با تاو قبل از ایجاد صدمات برگشت ناپذیر در مغز بسیار مهم است.
نقش LRP1
LRP1 به طور گسترده ای در مغز بیان می شود. در موش ها از دست دادن این گیرنده از نورون ها باعث نقص در انتقال عصبی تحریکی و عملکرد حرکتی می شود. همچنین پیشنهاد شده است که LRP1 در پاکسازی ساخت آمیلوئید بتا پپتید(تجمع آن سبب بیماری آلزایمر) و در ترمیم پوشش میلین (عایق نورون ها) نقش دارد.
بنابراین، اگرچه نتایج فعلی ممکن است به پتانسیل مسدود کردن عملکرد LRP1 اشاره داشته باشد؛ اما این مداخله لزوماً از نظر درمانی مفید نخواهد بود. اثر مثبت احتمالی متوقف کردن گسترش تاو در مغز، ممکن است با نقص در عملکرد شبکه و افزایش رسوب آمیلوئید جبران شود.
عمل تخریب چگونه صورت می گیرد؟
با این حال، دانستن گیرنده سطح سلول برای تاو، امکان تحقیقات در نورون را فراهم می کند. پس از وارد شدن به واسطه گیرنده، تاو در محفظه های داخل سلول که به عنوان آندوزوم شناخته می شود، ساکن می شود و از این طریق به طورمعمول تخریب می کند (لیزوزوم) و یا دوباره به سطح سلول باز می گردد.
این یک سؤال پیش می آید:
چگونه تاو از اندوزوم برای همکاری از آن استفاده می کند و به عنوان الگویی برای تاشدگی نادرست تاو در سیتوپلاسم عمل می کند؟
درک بهتر این مسیر ممکن است گزینه هایی را برای تغییر مسیر تاو داخلی برای تخریب یا صادرات برجسته کند.
سرانجام الگو برداری Rauch و همکارانش از باقیمانده های آمینه اسید در تاو که به آن اجازه می دهد تا با LRP1 تعامل داشته باشد، در ترکیب با ساختارهای جدید از سازگاری های مختلف تاو پاتوژن، می تواند طراحی مولکول هایی را که تاو را برای مقابله با گسترش آن امکان پذیر سازد.
شاید این اقدام اولین قدم در جهت جلوگیری از پیشرفت بیماری مرتبط با تاو باشد.
