باکتریهایی که در معرض آنتیبیوتیک قرار دارند زمانی که سلولهای مقاوم کافی در اطراف آنها، عامل غیرفعالکنندهی آنتیبیوتیکی بیان کنند، میتوانند زنده بمانند.این یافتهی جدید از اینکه چگونه بافت میکروبی میتواند با درمان آنتیبیوتیکی سازش پیدا کند توسط گروهی از میکروبیولوژیستهای دانشگاه Groningen microbiologists همراه با همکارانشان از سندیگو، ۲۷ دسامبر در ژورنال PLOS Biology منتشر شده است.
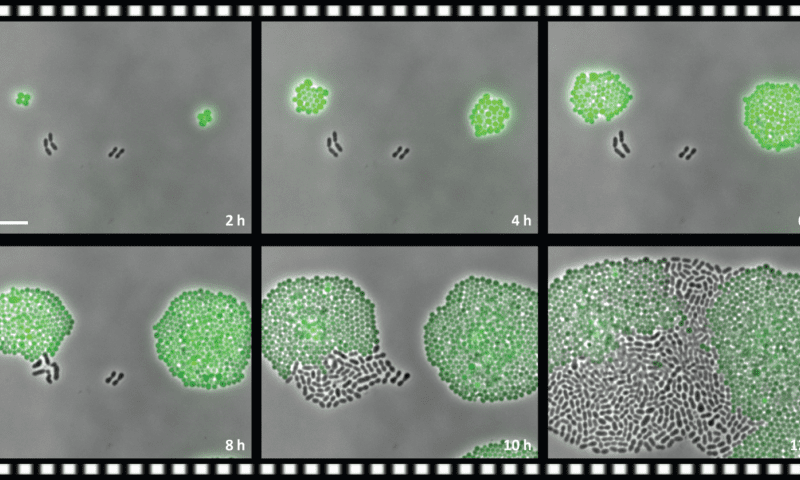
باکتریها استافیلوکوکوس که با پروتئینهای فلوروسنت سبز لیبل شدهاند، ژن مقاومتی را برای آنتیبیوتیک کلرامفنیکل بیان میکنند. در مقابل آنها، باکتریهای سیاه استرپتوکوکوس نومونیا قرار دارند که این ژن را بیان نمیکنند. در محیط کشتی که حاوی آنتیبیوتیک است، سلولهای سبز شروع به رشد کرده و تقسیم میشوند در حالی که سلولهای غیرمقاوم سیاه این کار را انجام نمیدهند. پس از گذشت زمان، سلولهای سیاه شروع به تقسیم شدن کرده و حتی از همراهان سبز خود نیز جلو میزنند.
چه اتفاقی در حال رخ دادن است؟ میکروبیولوژیست، Robin Sorg اولین نویسندهی تحقیق اینگونه توضیح میدهد: ” سلولهای مقاوم آنتیبیوتیک را دریافت کرده و آن را غیرفعال میکنند. در نقطهای مشخص، غلظت در محیط رشد به پائینتر از سطح حیاتی میرسد و سلولهای غیرمقاوم شروع به رشد میکنند”. چیزی شبیه این قبلاً هم دیده شده بود. “سلولهای مقاوم به پنیسیلین میتوانند آنزیم بتا-لاکتاماز را ترشح کنند که آنتیبیوتیک را تجزیه میکند ولی در کیس ما آنتیبیوتیک در داخل سلول مقاوم غیرفعال شد”.
مرور زمان
این اکتشاف با استفاده از میکروسکوپی گاهگذر time-lapse به عمل آمده و توسط مدل محاسباتی و مدلی از نومونیای موشها نیز تأیید شده است. “در موشها ما مشاهده کردیم که باکتریهای استرپتوکوکوس سازگار هنگامی که جانوران با باکتریهای مقاوم هم آلوده میشوند از درمان با کلرامفنیکل نجات پیدا کردند”. علاوه بر این نتایج، انتقال ژن مقاومت را غیرمحتمل دانستهاند. این اطلاعات با شواهد حکایتشدهی کلینیکی مطابقت میکند، جایی که باکتری سازگار با آنتیبیوتیک برخی اوقات از بیمارانی که نتوانستهاند با آنتیبیوتیک درمان شوند، کشت داده میشوند. این همیشه پزشکان را سردرگم کرده است. کار ما شاید یکی از توضیحات ممکن را ارائه دهد”.
بنابراین باکتری سازگار در حضور باکتری مقاوم میتواند به مدت طولانیتری نجات یابد و حتی در نهایت در رقابت با آن پیروز شود. این چه معنایی میتواند برای گسترش مقاومت آنتیبیوتیکی داشته باشد؟ “مسأله پیچیده است”. ما بر این نکته واقفیم که مصرف آنتیبیوتیک در انتخاب، به مقاومت میانجامد، اگرچه پروسه و این که مقاومت چرا به این سرعت گسترش مییابد، کاملاً برای ما مفهوم نیست. مطالعات روی سلول منفرد مثل تحقیق ما به تکمیل برخی از جزئیات کمک میکند”.
متابولیسم
چیزی که باید به آن اشاره کرد این است که سلولهای سازگار در محیط، رشدشان را متوقف میکنند ولی نمیمیرند. “مکانیسم بسیاری از نابودیها بر پایهی آنتیبیوتیک بر تقسیم سلولی ویا حداقل به سلولهایی با متابولیسم فعال متکیست. ما سلولها را از بین نمیبریم و احتمالاً آنها را قویتر هم نمیکنیم اما قطعاً به آنها زمان برای برداشت ژنهای مقاومت را از محیط میدهیم”.
این دانستهها میتواند پزشکان را هنگام معالجهی بیماران با آنتیبیوتیک مطلع سازد. “ما میدانیم که باید از این داروها با احتیاط استفاده کنیم ولی به نظر میرسد که باید محتاطتر باشیم”. Sorg پیشطرح تکنیک دارویی شخصی را در سر دارد که در آن میکروبهای غیرپاتوژن حاضر در بیمار به منظور داشتن ژن مقاومت بررسی میشوند. “این موضوع خطر انتقال به پاتوژنها را افزایش میدهد”.
البته برای جلوگیری از رخداد مقاومت در میکروارگانیسمهای غیرپاتوژنیک، مضایقه در به کار بردن آنتیبیوتیک نیز مهم است و شاید روزی که درک ما از این مکانیسمِ مسئول پخش مقاومت آنتیبیوتیکی کاملتر شد، راهی برای توقف آن پیدا کنیم.