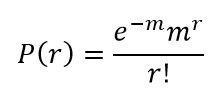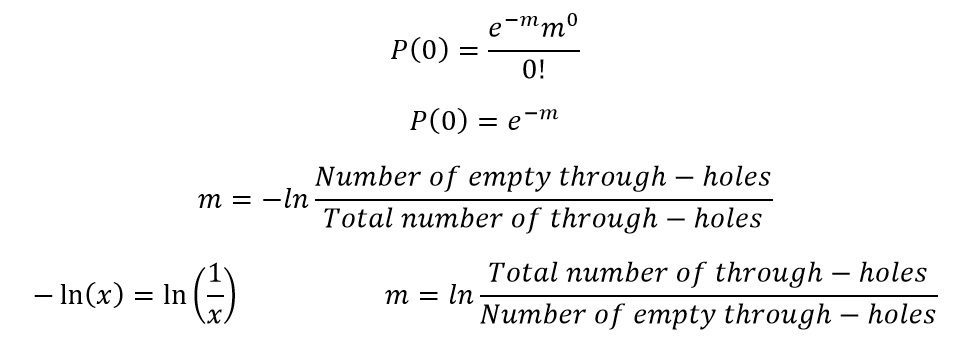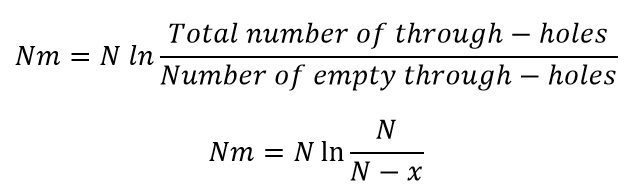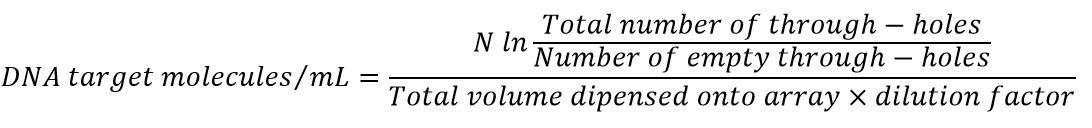Digital PCR یا dPCR روشی دقیق و بسیار حساس برای تعیین میزان DNA و یا RNA موجود در نمونه است. Digital PCR از لحاظ مواد اولیه موردنیاز برای واکنش و مرحله تکثیر اسیدنوکلئیکها شبیه qPCR یا Real-time PCR میباشد؛ به این صورت که از روش تکثیر PCR استاندارد و متدهای تشخیصی مبتنی بر پروبهای فلئورسنت استفاده میکند. با این تفاوت که میتواند میزان قطعی (و نه نسبی) نوکلئیکاسیدهای موجود در نمونه را آن هم بدون نیاز به منحنیهای استاندارد و رفرنسها به دست آورد. Real-time PCR نیاز به نرمالیزهکردن با کنترلها (رفرنسها و منحنی استاندارد) دارد و مقداری که به دست میآورد نسبی است. در Real-time PCR تغییرات در بازده فرایند تکثیر نیز میتواند نتایج آن را تحت تاثیر قرار دهد و این اتفاق در dPCR رخ نمیدهد.
همچنین حساسیت این روش به حدی است که میتواند توالیهای کمیابی مانند جهشهای نقطهای را در میان حجم زیادی از توالیهای طبیعی شناسایی کند. این کار در روش qPCR ممکن نیست چون سیگنالهای آزادشده از توالیهای طبیعی میتواند سیگنالهای توالی جهشیافته را بپوشاند. تکنیک Digital PCR با به حداقل رساندن رقابت بین توالیهای هدف با کاهش حجم واکنش، به مشکل تکثیر توالیهای کمیاب غلبه کرده و تعیین میزان نوکلئیکاسیدها را دقیق و قطعی میکند. علاوه بر این موارد، dPCR برخلاف Real-time PCR برای تعیین مقدار نوکلئیکاسید الگوی اولیه موجود در نمونه به محاسبه تعداد چرخهها نیازی ندارد و از توزیع پواسون برای تعیین دقیق میزان توالیهای الگو استفاده میکند.
مقالات مرتبط:
تاریخچه Digital PCR
در سال ۱۹۹۲، برای نخستین بار مفهوم Digital PCR معرفی شد. در این سال Sykes و همکارانش روشی بر پایه PCR به منظور تعیین دقیق میزان DNA موجود در نمونه اولیه معرفی کردند که با استفاده از limiting dilution و توزیع پواسون انجام میگرفت. آنان با انجام یک آزمایش PCR دومرحلهای توانستند ژن بازآراییشده زنجیره سنگین ایمونوگلوبولین را که متعلق به یک کلون لوسمیک بود، از میان تعداد زیادی از لنفوسیتهای با بازآرایی طبیعی شناسایی کنند. طی این مطالعه پژوهشگران سیستمی جدید برای تعیین تعداد الگوهای اولیه را با شمارش تعداد واکنشهای مثبت و منفی شناسایی کردند و راه را برای توسعه Digital PCR گشودند.
در سال ۱۹۹۷، Kalinina و همکارانش روش جدیدی برای PCR معرفی کردند که در مقیاس نانولیتر و با استفاده از لولههای مویین شیشهای انجام میشد. تکثیر قطعات در درون لوله از طریق فلورسانس معلوم میشد. در این آزمایش، تشخیص وجود تنها یک توالی DNA الگو در میان کل ژنوم از طریق فرایند PCR ساده ممکن شد. حجم کم مخلوط واکنش و استفاده از پروبهای TaqMan امکان وقوع این فرایند را به وجود آورد.
در سال ۱۹۹۹، Vogelstein و Kinzler از روشهای پیشین استفاده و نسخهای از این تکنیک را ارائه کردند که از پلیتی با ۹۶ چاهک برای انجام PCR استفاده میکرد. مطالعه آنها برای نخستین بار به منظور تعیین نسبت اللهای جهشیافته به نرمال در بیماران مبتلا به سرطان کولورکتال انجام شد. آنان DNA را از مدفوع بیماران استخراج و به حدی رقیق میکردند که تقریبا یک مولکول الگو در هر دو چاهک قرار بگیرد و در هر چاهک دارای مولکول هدف تنها یک مولکول تکثیر شود. در گام بعدی، انواع جهشیافته و سالم ras با استفاده از پروبهای hairloop که به ترتیب با رنگهای قرمز و سبز فلورسنت لیبل شده بودند، شناسایی میشدند. واژه Digital PCR برای نخستین بار توسط این پژوهشگران استفاده شد.
پروب لیبلشده با قرمز به نحوی طراحی شده بود که فقط در صورت وجود جهش فعالکننده بین کدون ۱۲ و ۱۳ به توالی ras متصل شود. پروب سبز نیز تنها وجود ras را بدون توجه به سالم و یا جهشیافته بودن آن تشخیص میداد. در نتیجه با محاسبه نسبت تعداد چاهکهای دارای هر دو سیگنال سبز و قرمز به چاهکهایی که تنها دارای سیگنال سبز بودند، تعیین نسبت اللی ژنهای ras جهشیافته به سالم ممکن میشد.
این سیستمها بسیار آهسته و دشوار بودند و بررسی حجم زیادی از نمونه به وسیله آنها ممکن نبود. توسعه روش Digital PCR مناسبتر برای انجام آنالیزهای پیچیده با توسعه Emulsion PCR، چیپهای microfluid و microarrayها ممکن شد. این تکنیکها به ترتیب باعث ایجاد droplet digital PCR در سال ۲۰۱۰ توسط Hindson، PCR amplification on a microfluid chip در سال ۲۰۰۶ و جداسازی روی microarrayها در سال ۲۰۱۰ شدند. دستگاههای موردنیاز برای این تکنیکها به صورت تجاری و در فرمتهای مختلف در دسترس هستند.
روش انجام Digital PCR
روش تعیین غلظت سلولهای باکتری در یک کشت را درنظر بگیرید؛ در این حالت کشت باکتری به صورت پیدرپی رقیق میشود و درنهایت مقداری از مخلوط رقیق شده در محیط رشد آگار کشت داده میشود. پس از انکوباسیون و تشکیل کلونی، کلونیها شمرده شده و تعداد آنها به dilution factor تقسیم میگردد. در این حالت فرض میشود که به علت رقیق بودن مخلوط اولیه هر کلونی باکتریایی از یک سلول باکتری به وجود آمده است.
تقسیم باکتری ها باعث میشود باکتری منفردی که قبلا با چشم غیرمسلح قابل مشاهده نبود، مشاهده شود. برای اینکه دقت این روش بیشتر شود، باید فاصله کلونیها به حدی باشد که بتوان شمارش را با اطمینان انجام داد. کلونیها نباید بر روی همدیگر رشد کنند، وگرنه غلظت به دست آمده کمتر از غلظت واقعی خواهد بود. همانند این مثال، شناسایی یک مولکول DNA هدف با استفاده از PCR و پروبهای فلورسنت TaqMan، امکان مشاهده مولکولی را که قبلا با چشم غیرمسلح دیده نمیشد، فراهم و با روشی مشابه آنچه که برای تعیین میزان باکتریها گفته شد، به تعیین غلظت اسیدنوکلئیکها کمک میکند.
در این تکنیک، نمونه DNA به طور پیدرپی رقیق میشود. پس از رقیقسازی به میزان موردنیاز، قسمتی از آن بین تعداد زیادی از ظرفهای واکنش تقسیمبندی میگردد، به طوریکه ۰، ۱، و یا تعداد کمی از مولکولهای هدف در درون هر ظرف جای بگیرند. این مرحله مختص Digital PCR است و گامی مهم در این واکنش محسوب میشود. ظروف واکنش حاوی مواد اولیه، پرایمرها و پروبهای فلورسنت هستند که با مواد اولیه واکنش Real-time PCR یکسان میباشد.
مرحله بعدی، انجام واکنش PCR عادی با Thermal cycler است و واکنش PCR باید به طور کامل انجام گیرد. پس از پایان واکنش، تعداد واکنشهای مثبت و منفی از روی وجود یا عدم وجود سیگنال، محاسبه میشوند؛ به این صورت که واکنشهای دارای سیگنال فلورسنت مثبت هستند و با ۱ شمارهگذاری و واکنشهایی که تنها دارای سیگنال پیشزمینه هستند با ۰ شمارهگذاری میشوند. علت نامگذاری این تکنیک به Digital PCR نیز همین موضوع است: واکنش یا سیگنال تولید میکند (۱) و یا اینکه نمیکند (۰). در نهایت با استفاده از توزیع پواسون تعیین دقیق غلظت مولکولهای هدف انجام میگیرد.
کمپانیهای بسیاری دستگاههای موردنیاز برای Digital PCR را تولید میکنند. این ماشینها از روشهای مختلفی برای تقسیمبندی و نیز شناسایی محصولات تولیدشده استفاده میکنند؛ اما اساس روش Digital PCR در همه آن ها یکسان است. یکی از دستگاههایی که به این منظور به کار میرود، Thermo Fisher Scientific’s QuantStudio 12K Flex است. این دستگاه دارای یک صفحه نازک فلزی (array) به ابعاد ۲.۵ در ۸ سانتیمتر است که ۳۰۷۲ حفره هیدروفیل دارد. هر حفره میتواند ۳۳nL از مواد واکنش PCR را در بر بگیرد. پرایمرها و پروبهای TaqMan به صورت خشک شده درون حفرات قرار دارند.
نمونه DNA رقیقشده به همراه سایر مواد موردنیاز برای تکثیر DNA مانند DNA پلیمراز، dNTPها، MgCl۲ و بافر به درون حفرات موجود در صفحه وارد میشود. سپس صفحه در دستگاه که دارای واحد Thermal cycler است، قرار میگیرد و تکثیر قطعات آغاز میگردد. دوربین تعبیه شده در دستگاه، تصویر صفحه را پیش از شروع چرخه حرارتی و پس از آن ثبت میکند. این کار باعث مشخص شدن افزایش فلورسانس در حفرات که به علت واکنش پرایمرها و پروب با DNA هدف صورت میگیرد، میشود.
تصور کنید که تنها یک مولکول DNA هدف در صفحه وجود دارد. اینکه این قطعه در کدام حفره قرار خواهد گرفت کاملا تصادفی است. اما چون این مولکول تنها مولکولی است که در صفحه توزیع میشود، شانس این که تنها مولکول موجود در حفرهای که در آن واقع شده است، باشد، ۱۰۰ درصد است؛ چون مولکول DNA هدف دیگری وجود ندارد که بتواند همراه با مولکول موردنظر در آن حفره قرار بگیرد.
در صورتیکه دو مولکول DNA هدف به طور تصادفی میان ۳۰۷۲ حفره توزیع شوند، به احتمال زیاد این دو مولکول در دو حفره جداگانه قرار خواهند گرفت. با این حال شانس اینکه هر دو در یک حفره قرار بگیرند نیز وجود دارد، هر چند اندک باشد. در صورتیکه قسمتی از مخلوط رقیقشده که میخواهیم در صفحه توزیع کنیم، دارای ۳۰۰۰ مولکول DNA باشد، این مولکولها بر حسب تصادف میان ۳۰۷۲ حفره توزیع میشوند. برخی حفرات هیچ مولکولی دریافت نخواهند کرد و برخی ممکن است ۱ مولکول یا بیشتر دریافت کنند.
توزیع پواسون احتمال وجود حفرهای با هر تعداد مولکول DNA را در صفحه محاسبه میکند؛ به شرطی که توزیع آنها کاملا تصادفی و مستقل از هم باشد. رابطه احتمال پواسون به شکل زیر است:
P کسری از حفرات است که دارای r مولکول DNA هدف هستند؛ درصورتیکه به طور میانگین m مولکول هدف در هر حفره به طور تصادفی در سراسر صفحه تقسیمبندی شده باشند. همچنین e=2.71828 میباشد. در Digital PCR اگر واکنشی دارای DNA هدف باشد، صرف نظر از تعداد مولکولها، نور تولید کرده و مثبت تلقی خواهد شد و در غیر این صورت منفی خواهد بود. پس نمیتوان فهمید که در هر حفره دقیقا چه تعداد مولکول هدف وجود دارد. با این حال میتوان با قطعیت گفت که کدام حفرات قطعا دارای مولکول هدف بودهاند و کدامها و نیز چند تا از آنها سیگنال تولید نکردند.
در صورتیکه معادله توزیع پواسون را برای r=0 یعنی شرایطی که هیچ مولکول هدفی درون حفره وجود ندارد، حل کنیم، خواهیم توانست m (میانگین تعداد نسخههای مولکول هدف در هر حفره و در کل صفحه) را به دست آوریم. در این حالت خواهیم داشت:
طبق توزیع پواسون، زمانی که این کسر در تعداد کل چاهکها (۳۰۷۲) ضرب شود، مقدار تخمینی کل تعداد DNAها در صفحه (مجموع تعداد DNAهای موجود در حفرهها، با هر تعداد در هر حفره) به دست میآید. در رابطه زیر، Nm تعداد تقریبی کل مولکولهای DNA موجود در صفحه است؛ N برابر تعداد کل حفرات میباشد و X تعداد حفراتی که واکنش آنها مثبت است و سیگنال فلورسنت آزاد میکند را نشان میدهد.
زمانی که این کمیت به کل حجم نمونه DNAای که وارد صفحه شده است ضربدر dilution factor، تقسیم شود، غلظت DNA هدف در نمونه اصلی به دست خواهد آمد.
لازم به ذکر است که بهترین کارکرد Digital PCR و بیشترین دقت آن زمانی است که واکنشها به تعداد زیادی صورت بگیرند و هر چه تعداد واکنشهای تکثیری بیشتر باشد دقت بالاتر خواهد بود.

تکینک Droplet Digital PCR
تکینک Droplet Digital PCR نوعی از dPCR است که طی آن واکنشهای PCR درون هزاران قطره که اندازه آنها در حد نانولیتر است انجام میگیرد. در این روش نیز نمونه DNA ژنومی به حدی رقیق میشود که یک مولکول در درون هر قطره باشد و یا اینکه قطره فاقد مولکول هدف باشد.
مواد اولیه واکنش نیز مشابه Real-time PCR هستند. اساس این روش Emulsion PCR است به این صورت که انجام واکنش PCR در مخلوط روغن و آب، باعث ایجاد میلیونها ریزواکنش شده و دقت و سرعت واکنش افزایش مییابد. به عبارت دیگر هر قطره به عنوان یک واکنش PCR مستقل عمل میکند.
پس از تکثیر به کمک PCR، وجود و یا عدم وجود فلورسانس در هر قطره بررسی و تعداد قطرات واکنش مثبت (دارای سیگنال فلورسانس:۱) و واکنش منفی (فاقد سیگنال فلورسانس:۰) شمارش میشود. در نهایت با استفاده از توزیع پواسون، غلظت DNA هدف بر حسب تعداد نسخهها در میکرولیتر محاسبه میگردد.
کاربرد تکینک Digital PCR
همانطور که اشاره شد، مرحله تقسیمبندی که مخصوص dPCR است، به همراه توزیع پواسون، باعث دقت و حساسیت بیشتر این تکنیک نسبت به PCR استاندارد و qPCR شده است. در نتیجه dPCR برای کاربردهایی مناسب است که نیاز به تشخیص مقادیر اندک توالی هدف موجود در نمونه و بیشتر بودن دقت میزان به دست آمده دارند. تشخیص توالیهای هدفی که در backgroundی پیچیده قرار دارند، SNPها یا واریانتهای اللی و بررسی تغییرات واضح در میزان توالی هدف از کاربردهای دیگر این تکنیک است. تعدادی از کاربردها در زیر به طور خلاصه توضیح داده شدهاند.
بیوپسی مایعات: تهیه بیوپسی از مایعات، تستی غیرتهاجمی است که در خون بیمار، سلولهای سرطانی در گردش (CTC=circulating tumor cells) و یا DNA خارجشده از آنها (ctDNA= Circulating Tumor DNA) را مشخص میکند. استفاده از این تکینک برای تشخیص سرطان یا بررسی روند پیشرفت آن روزبهروز در حال افزایش است. برخلاف تهیه بیوپسی بافتی از تومور، بیوپسی مایعات کمترین خطر را برای بیمار دارد و میتواند چندین بار به منظور اهداف تشخیصی و نیز بررسی روند بیماری، مورد استفاده قرار گیرد.
ctDNAها و CTCهای هدف به میزان کم در پسزمینه پیچیدهای از cfDNA (cell-free DNA) قرار دارند. Droplet digital PCR با توجه به حساسیت بالایی که دارد میتواند به دقت این توالیهای کمیاب را در حضور مقادیر فراوانی از توالیهای دیگر شناسایی کند. علاوه بر تشخیص سرطان و بررسی روند بیماری، این تکنیک میتواند در تشخیص هتروژنیتی تومورها، جستوجوی بیومارکرها و بررسی عدم پاسخ به درمان نیز استفاده شود. دامنهی بیماریهایی که این تکنیک میتواند در آنها مورد استفاده قرار گیرد روز به روز در حال افزایش است. از جمله این بیماریها میتوان دیابت نوع یک، عفونتها، پیوند ارگان و تستهای غیرتهاجمی بارداری (به عنوان مثال تشخیص کروموزوم Y و یا ناهنجاریهای تکژنی از طریق بررسی سرم مادر) را نام برد.
تنوع تعداد کپی (CNV= Copy Number Variation): پژوهشگران تخمین میزنند که بیش از ۱۰ درصد ژنوم انسان از CNVهایی با اندازه بزرگتر از یک کیلوباز، و ۳۰ درصد آن از CNVهای بزرگتر از ۱۰۰ جفتباز تشکیل شده است. برخی از CNVها به بیماریهایی مرتبط شدهاند. این CNVها میتوانند به صورت ارثی منتقل شوند و یا به صورت de novo ایجاد گردند. علاوه بر بیماریها، وجود این توالیها در ژنهای حساس به دوز (dosage sensitive genes) با فنوتیپ و رفتارهای پیچیدهای در ارتباط است.
Digital PCR برای بررسی واریانتهای CNV بسیار مناسب است. این تکنیک میتواند به طور دقیقی میزان CNVها را در یک چاهک منفرد تعیین کند. این درحالی است که در qPCR به انجام شدن تعداد بیشتری از فرایندهای تکثیری نیاز دارد. به عنوان مثال برای تایید تغییر تعداد کپیها از ۴ به ۵ انجام بیش از ۱۸ واکنش qPCR موردنیاز است. به علاوه، دقت فرایند Digital PCR کمتر به میزان بازده فرایند تکثیر حساس است. این موضوع علت اصلی کم بودن دقت qPCR میباشد.
شناسایی توالیهای کمیاب: افزایش حساسیت شناسایی مولکولهای هدف با فراوانی اندک، میتواند نتایج گستردهای از تشخیص سریعتر و دقیق تغییرات سلولی در مراکز آزمایشگاهی و تحقیقاتی گرفته تا توسعه تستهای غیرتهاجمی بیشتر، داشته باشد. Digital PCR بازده بیشتری در شناسایی و تعیین میزان چنین توالیهایی دارد؛ چون به تعداد چرخههای انجامگرفته وابسته نیست. علاوه بر آن، تقسیمبندی نمونه رقابت میان توالی موردنظر با توالیهای فراوانتر پسزمینه را کاهش میدهد. کاربردهای Digital PCR در این زمینه عبارتند از:
- تشخیص سرطان با شدتی پایینتر از شدت قابل شناسایی توسط تستهای رایج
- بررسی جهشهای جدیدی که همزمان با رشد تومورها ایجاد میشوند
- تشخیص ویروسها مانند HIV در سطحی پایینتر از سطح قابل شناسایی توسط تستهای رایج
- انجام تستهای غیرتهاجمی روی مایعات بدن مانند بررسی ctDNA در سرطان
- تشخیص رد پیوند
بیان ژن: دقت بالای Digital PCR باعث دقیقتر شدن نتایج اندازهگیری میزان بیان ژن نیز میشود. این موضوع دانشمندان را قادر میسازد تا متوجه تغییرات بیان ژن در سطوح پایینتر مانند کمتر از دو برابر نیز بشوند. Digital PCR امکان بررسی بیان ژن را هم در سطح DNA و هم RNA و در موارد زیر فراهم میکند:
- تشخیص و اندازهگیری متیلاسیون DNA ژنومی
- بررسی میزان رونویسی به صورت دقیق
- تشخیص mRNAها و miRNAهای با turnover بالا خصوصا آنهایی که در ماتریکسی پیچیده مانند خون قرار دارند؛
آنالیز سلول واحد (Single-Cell Analysis): این کاربرد بسیار چالشبرانگیز است؛ استخراج یک سلول سالم و به دست آوردن نتایج دقیق از مقدار کم ماده اولیه از لحاظ تکنیکی کاری دشوار است. این ویژگیهای Digital PCR آن را به تکنیکی حساس و دقیق برای انجام این بررسی تبدیل کرده است:
- تشخیص دقیق مولکولهای هدف و تکثیر آنها زمانی که سطح این مولکولها پایین است؛
- عدم نیاز به منحنیهای استاندارد و ژنهای housekeeping
- کاهش حساسیت به مواد مهارکننده PCR
- تشخیص همزمان ۴ مولکول هدف از طریق Multiplex PCR
- امکان ترکیب با سایر تکنیک ها از جمله next-generation sequencing
تشخیص پاتوژنها و آنالیز میکروبها: شاید بیشترین کاربرد Digital PCR تاکنون در میکروبیولوژی بوده است. هم تشخیص پاتوژن و هم تخیص میکروبیوم، غالبا نیازمند تشخیص میزان اندک میکروارگانیسم در پسزمینهای پیچیده از سایر سلول ها است. کاربردهای Digital PCR در این زمینه عبارتند از:
- تشخیص ویروسها در سطحی پایینتر از سطح قابل شناسایی توسط تستهای رایج و بررسی روند بیماری
- تشخیص میزان پاتوژنها پیش و پس از عمل پیوند (allotransplantation)
- تشخیص و بررسی مقاومت میکروبی
- تشخیص پاتوژنها در غذاها