Asymmetric PCR نخستین بار در سال ۱۹۸۸ توسط Gyllensten و Elrich توصیف شد. هدف از انجام این فرایند آن است که به صورت ترجیحی تنها یکی از رشتههای DNA دورشتهای الگو را تکثیر کنیم. نوع پیشرفته Asymmetric PCR، تکینک LATE-PCR میباشد و کاربرد آنها زمانی است که قرار است تنها یکی از دو رشته مکمل DNA الگو تکثیر شود. DNA تک رشتهای حاصل از این واکنشها میتواند در توالییابی، هیبریداسیون DNA (به عنوان پروب) و به منظور افزایش میزان سیگنالهای تشخیصی در Real-time PCR استفاده شود.
فرایند کلی Asymmetric PCR شبیه به PCR عادی است، با این تفاوت که میزان پرایمر مورد استفاده برای رشته هدف بسیار بیشتر از رشته غیرهدف است. پرایمر دارای غلظت بالاتر پرایمر excess است و توالی هدف را تکثیر میکند. پرایمر با غلظت محدودشده نیز پرایمر limiting نامیده میشود. با پیشرفت واکنش Asymmetric PCR، هر دو پرایمر به منظور تولید DNA دورشتهای جدید مورد استفاده قرار میگیرند. با اتمام پرایمرlimiting ، سنتز رشته هدف به کمک پرایمر excess به صورت خطی (linear) ادامه پیدا میکند و در نهایت مولکولهای تکرشتهای تجمع مییابند.
امروزه تصمیمگیریهای حیاتی در مواردی همچون بیماریهای عفونی، پزشکی قانونی، سرطان، آزمایشهای ژنتیکی پیش از پیوند و … وابسته به تشخیص توالیهای خاصی در DNA هستند. حتی گاها ممکن است نیاز به تشخیص اللهای یک ژن single-copy در یک سلول واحد باشیم. Asymmetric PCR میتواند در این موارد مورد استفاده قرار گیرد.
روشهای symmetric PCR مانند Real-time PCR نیز میتوانند در تشخیص سریع میزان توالیهای کمیاب موجود در نمونه استفاده شوند. ولی این روشها خصوصا در تشخیص توالی موردنظر در نمونههای حاوی DNA اندک، حساسیت پایینی دارند واستفاده از آن ها مشکلاتی به همراه دارد. از جمله اینکه سرعت واکنش به تدریج کاهش مییابد و نمودار کفهای میشود. علت این موضوع اتصال دوباره رشتههای الگو به همدیگر و ممانعت از اتصال پرایمر و پروب به این رشتهها است. در واکنشهای Asymmetric PCR این مشکل با بهکارگیری غلظتهای نابرابر پرایمر برطرف میگردد؛ به این صورت که اتمام پرایمر limiting در فاز نمایی واکنش (exponential phase) در ادامه باعث تکثیر خطی (linear) رشته هدف پرایمر excess میگردد.
مقالات مرتبط:
- PCR چیست؟
- تکنیک Real-time PCR
Asymmetric PCR علیرغم این مزیتها، کاربرد گستردهای ندارد. کارایی این واکنشها پایین و چیزی در حدود ۷۰-۶۰ درصد است. این در حالی است که این میزان در واکنشهای symmetric PCR در حدود ۹۰ درصد میباشد. بهینهسازی (optimization) نسبت غلظت پرایمرها، میزان ماده آغازکننده واکنش و تعداد چرخهها در واکنشهای Asymmetric PCR بسیار دشوار است. همچنین رسیدن به CT در این واکنشها به تعویق میافتد و احتمال تکثیر قطعات غیراختصاصی بالاتر میرود. مجموعه این عوامل باعث کاربرد کم این تکنیک شدهاند.
از علل این موضوع، طراحی پرایمرها بدون در نظر گرفتن تاثیر غلظت بر دمای ذوب (Tm) آنها است (Tm دمایی است که در آن نصف مولکولهای DNA دورشتهای از هم جدا شده و تکرشتهای هستند و نصف آنها نیز به صورت دورشتهای باقی ماندهاند). کاهش غلظت هر نوع پرایمری باعث کاهش نقطه ذوب آن و پایین آمدن آن تا زیر دمای مرحله اتصال واکنش (annealing temperature) میشود. به عبارت دیگر اختلاف دمای ذوب پرایمر limiting و excess کمتر از صفر میگردد ((TmL – TmX)<0؛ TmL نشاندهنده دمای ذوب پرایمر limiting و TmX نشاندهنده دمای ذوب پرایمر excess است). در این حالت، با اینکه PCR انجام میشود، اما پرایمرها این فرصت را به دست میآورند که به نواحی غیراختصاصی نیز متصل شوند و درنتیجه تکثیر قطعات غیراختصاصی، کارایی واکنش کاهش مییابد.
نسخه بهبودیافته این روش، تکنیک Linear-After-The-Exponential PCR (LATE-PCR) است که از لحاظ استفاده از پرایمرهایی با غلظتهای متفاوت، مشابه Asymmetric PCR میباشد. تفاوت این دو روش تحولی است که در طراحی پرایمرها ایجاد شده و با افزایش کارایی واکنشهای Asymmetric PCR، بر محدودیتهای آنها غلبه کرده است. در این تکینک پرایمرها بر پایه primer-target hybridization equilibrium، به نحوی طراحی میشوند که اختصاصا قابل استفاده در غلظتهای نامساوی باشند. این نسبتها باید به گونهای تنظیم شوند که با اتمام پرایمر limiting، واکنش به طور ناگهانی از فاز نمایی و تولید مولکولهای DNA دورشتهای، وارد فاز خطی و تولید مولکولهای تکرشتهای شود. این موضوع اهمیت فوقالعادهای دارد، چون امپلیکونهای تک رشتهای تولیدشده در انتهای واکنش هستند که به پروب متصل میشوند. همچنین در این حالت میتوان از پروبهایی استفاده کرد که دردمای پایینتری به توالی هدف اتصال مییابند. در LATE-PCR سطح سیگنال فلورسنت تولیدشده نسبت به سایر واکنشها بالاتر و تنوع (variability) قطعات تکثیرشده نیز کمتر است.
این تکنیک برای نخستین بار در سال ۲۰۰۳ توسط Sanchez، Pierce، Rice و Wangh ارائه شد. دو بیماری تکژنی که در جریان این پژوهش مورد بررسی قرار گرفتند، بیماری Tay-Sachs (TSD) و سیستیک فیبروزیس (CF) بودند. TSD نوعی بیماری نورودژنراتیو کشنده است که در اوایل کودکی بروز میکند و جهش در ژن HEXA عامل این بیماری است. سیستیک فیبروزیس نیز ناشی از جهش در ژن CFTR میباشد که کدکننده کانال کلر است.
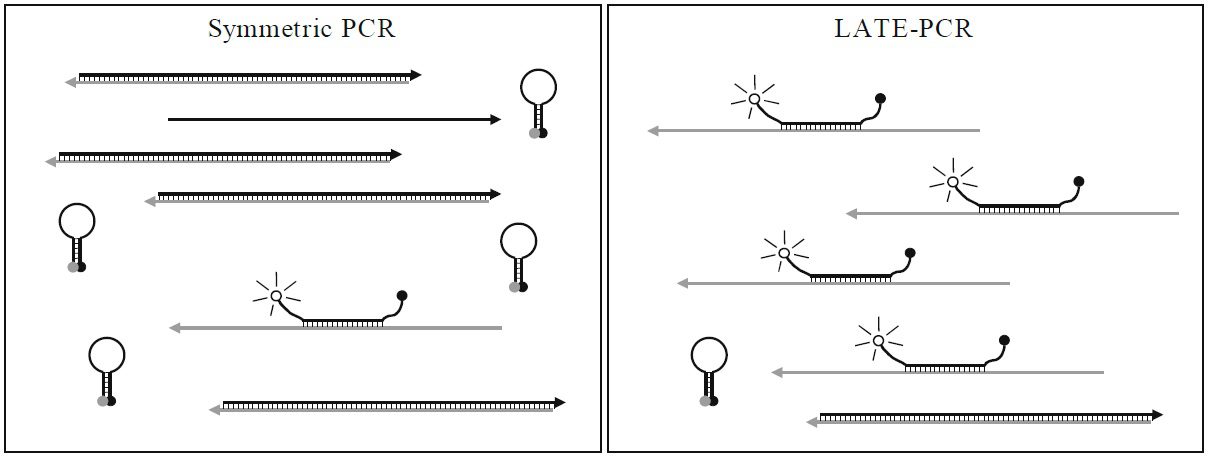
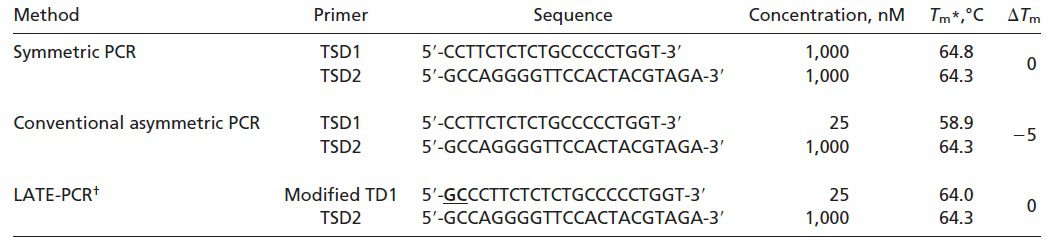
طبق جدول ۱ و تصویر ۲، در واکنشهای symmetric PCR مانند real-time PCR، غلظتهای برابری از پرایمرها با Tm یکسان، مورد استفاده قرار میگیرند و درنتیجه ΔTm در حدود ۰°C است. پروبهای مورداستفاده در این واکنشها High-Tm هستند و Tm آنها بالاتر از Tm پرایمرها و نیز پایینتر دمای مرحله اتصال واکنش است. علت بالاتر بودن Tm پروب نسبت به پرایمر این است که مطمئن شویم هیبریداسیون پروب با هدف، پیش از اتصال پرایمر صورت میگیرد. همچنین در روش real-time PCR به این علت که برای تجزیه پروب نیاز به خاصیت اگزونوکلئازی ۵’ آنزیم Taq پلیمراز داریم و این خاصیت در دماهای بالا فعال است، پروب مورداستفاده باید دمای ذوب بالایی داشته باشد. از آن جایی که این پروبها حساسیت کمتری نسبت به پروبهای Low- Tm دارند، قدرت تمایز اللها از یکدیگر و نیز کارایی واکنش کمتر است. علیرغم وجود مزایایی مانند کاهش خطر آلودگی محیط آزمایشگاه، صرفهجویی در زمان و آسانتر شدن روند automation، همانطور که اشاره شد، این روشها دارای معایبی نیز هستند. از جمله این که اتصال دوباره امپلیکونها به توالیهای الگو، با اتصال پرایمرها و پروبها رقابت کرده و در نهایت در پایان واکنش به آنها غلبه میکند. درنتیجه پروب تنها بخشی از کل امپلیکونهای تولیدشده را تشخیص میدهد. همچنین شناسایی محصولات در این روش به هیبریداسیون پروب و توالی هدف بستگی دارد و باید در مرحله اتصال و هنگامی که توالیهای هدف به صورت موقت تک رشتهای هستند انجام شود. در نتیجه همانطور که اشاره شد باید پروبهای High-Tm به کار گرفته شوند و نمیتوان از مزایای پروبهای Low-Tm استفاده کرد.
در واکنشهای Asymmetric PCR عادی، پرایمرهای مورداستفاده در واکنشهای symmetric به کار میروند، با این تفاوت که غلظت یکی از پرایمرها کمتر از دیگری است. در این حالت ابتدا پرایمرهای limiting و excess به صورت نمایی هر دو رشته DNA را تکثیر میکنند و باعث تولید محصولات دورشتهای میگردند. با اتمام پرایمر limiting، تکثیر رشته دیگر توسط پرایمر excess ادامه پیدا میکند. مولکول تکرشتهای که به این ترتیب تولید میشود، آزادانه میتواند به پروب متصل گردد. در تکنیک Asymmetric PCR، نتیجۀ طراحی پرایمرها بدون درنظر گرفتن تاثیر غلظت بر دمای ذوب آنها، کاهش Tm پرایمر limiting نسبت به پرایمر excess و ΔTm<0 است. TmL در این واکنشها حتی پایینتر از دمای مرحله اتصال است. در این حالت با اینکه PCR انجام میشود، اما پرایمرها به نقاط غیراختصاصی نیز متصل میگردند و همین موضوع است که کارایی واکنش را کاهش داده و باعث تاخیر در رسیدن به CT میشود. یک راهحل احتمالی برای این مشکل پایین آوردن دمای اتصال است؛ اما باعث افزایش تکثیر توالیهای غیراختصاصی در اثر اتصال نادرست پرایمرهای excess میشود. پروبهای مورداستفاده در Asymmetric PCR از نوع پروبهای High-Tm هستند و همانطور که گفته شد دارای حساسیت پایینی بوده و فاقد مزایای پروبهای Low-Tm هستند.
در LATE-PCR پرایمرهای limiting و excess به نحوی طراحی میشود که علیرغم کاهش غلظت، TmL بیشتر از TmX باشد (≥۰(TmL – TmX )). این کار با تنظیم طول و توالی انتهای ۵’ پرایمرها انجام میشود. به عنوان مثال میتوان طول پرایمر را افزایش داد و یا اینکه درصد (G+C) آن را بالا برد. TmX نیز باید به گونهای تنظیم شود که به دمای ذوب امپلیکون دورشتهای (TmA) نزدیک باشد تا بتواند به طور موفقیتآمیزی بر هیبریداسیون محصولات تکرشتهای به توالیهای هدف غلبه کند. همچنین تنظیم نسبت غلظت پرایمرها باید به گونهای انجام بگیرد که در ابتدا واکنش به صورت نمایی انجام و امپلیکونهای دورشتهای تولید شوند. سپس با کاهش ناگهانی غلظت پرایمر limiting، واکنش وارد فاز خطی گردد و پس از آن به صورت موثر در تعداد چرخههای بیشتری به تکثیر ادامه دهد. در تکنیک real-time LATE-PCR اتمام پرایمرهای limiting باید همزمان با رسیدن به چرخه آستانه باشد. برای اینکه این اتفاق رخ دهد، باید میزان پرایمر limiting، به دقت انتخاب شود. در تکنیک LATE-PCR به علت تجمع مولکولهای تکرشتهای حاوی توالی هدف در انتهای واکنش، نیازی به رقابت پروب با سایر توالیها در فاز نمایی وجود ندارد. درنتیجه امکان استفاده از پروبهای Low-Tm فراهم میشود. این پروبها stem و loop کوتاهتری دارند و درنتیجه Tm آنها پایینتر از Tm پرایمرها و نیز دمای اتصال واکنش است. در این حالت میتوان یا دمای اتصال پایین آورد و هیبریداسیون پروب را در همان مرحله اتصال انجام داد؛ و یا اینکه مرحله اتصال را از مرحله شناسایی محصولات جدا نمود. در حالت دوم، پروب Low-Tm پس از محله گسترش به پروفایل حرارتی افزوده میشود. موارد زیر از جمله مزایای این پروبها هستند:
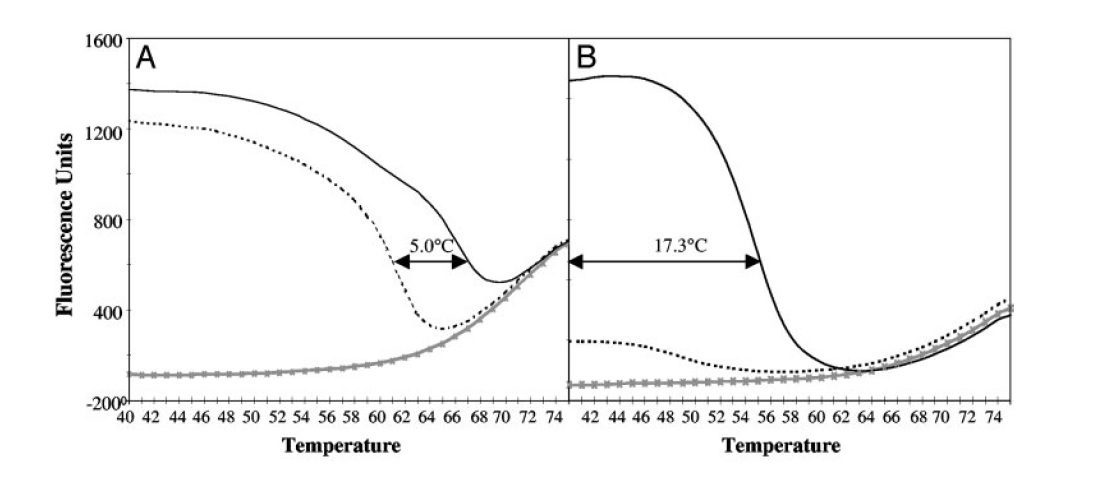
- پروبهای Low-Tm قدرت بیشتری در تمایز اللها (allele discrimination) نسبت به پروبهای High-Tm دارند. این ویژگی از آنجا ناشی میشود که طول توالی هدف پروبهای Low-Tm کوتاهتر است و وجود mismatch تنها در یک جفتباز میتواند بسیار ناپایدارکننده باشد (تصویر ۳).
- پروبهای Low-Tm سیگنال فلورسنت پسزمینه کمتری دارند و استفاده از آنها باعث افزایش نسبت سیگنال به noise میگردد.
- طراحی آنها آسانتر است.
- پروبهای Low-Tm در غلظتهای متنوعی قابل استفاده هستند، بدون اینکه کارایی واکنش کاهش پیدا کند. این پروبها در فاز نمایی تکثیر، باعث آسانتر شدن اتصال و گسترش پرایمرهای limiting روی رشتههای حاصل از گسترش پرایمرهای excess میشوند. درنتیجه میتوانند در غلظتهای بالا و اشباع بدون تاثیر بر کارایی واکنش استفاده شده و به تمام مولکولهای تکرشتهای اتصال یابند. این کار باعث افزایش درجه حساسیت واکنش میشود. درمقابل افزایش غلظت پروبهای High-Tm که در سایر واکنشها مورد استفاده قرار میگیرندٰ، باعث کاهش حساسیت میگردد. ….. (تصویر۴).
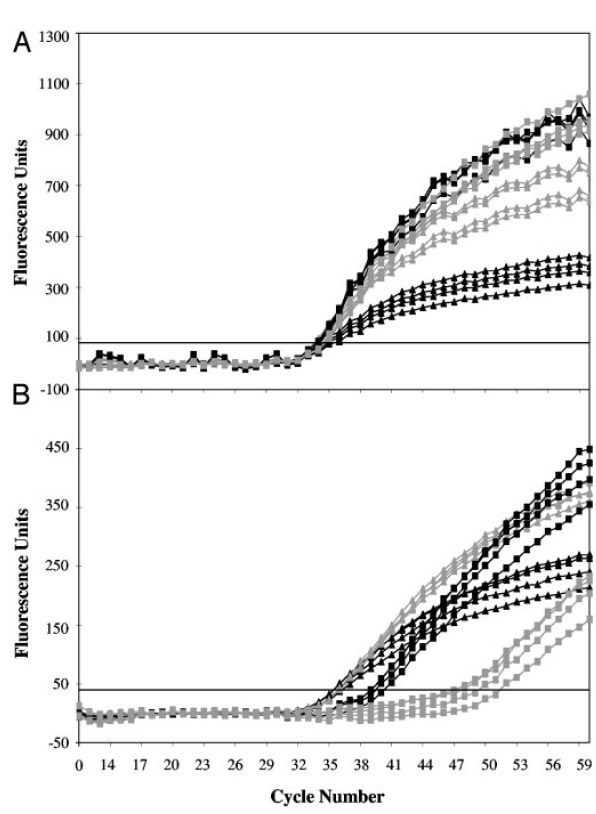
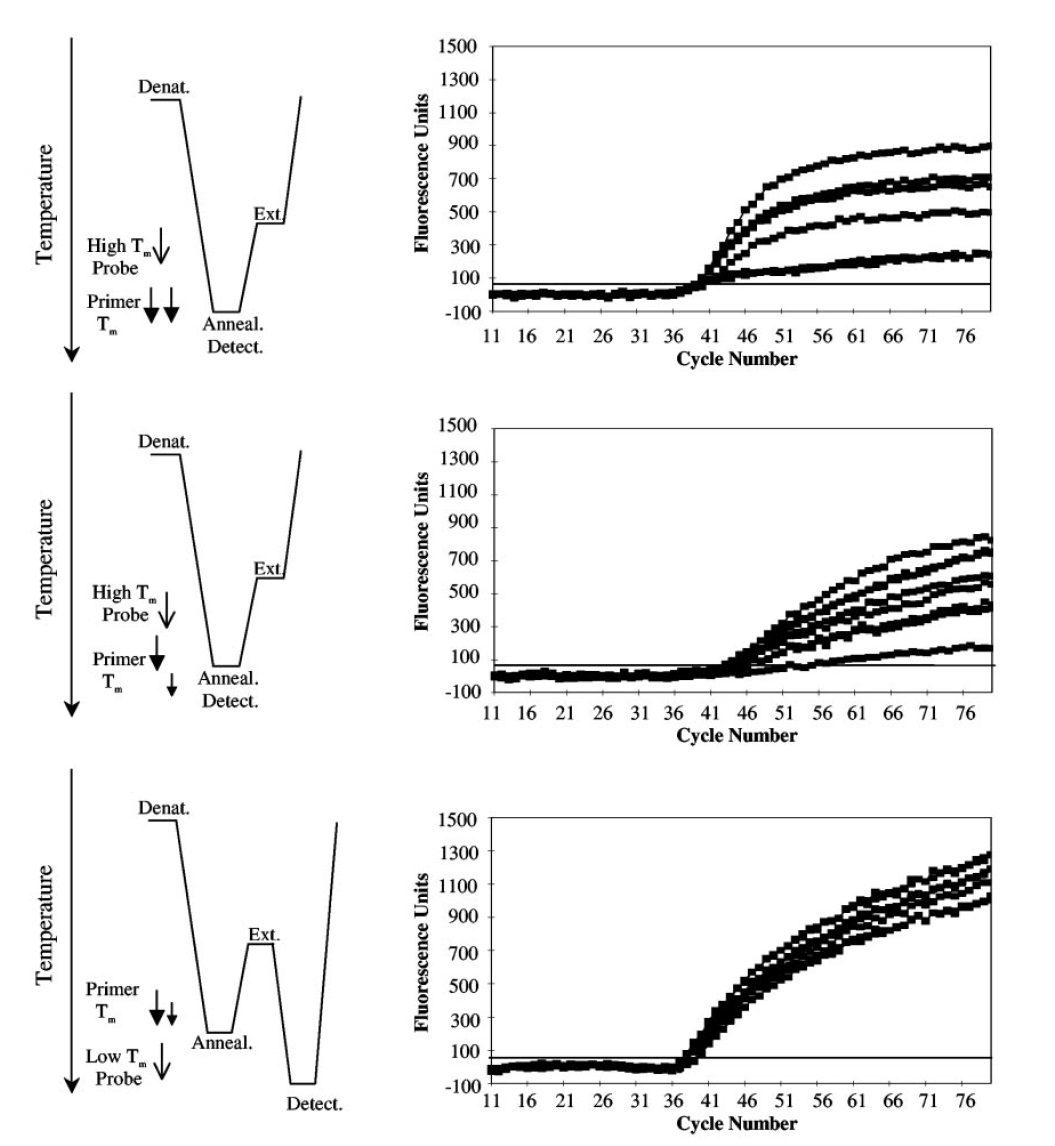
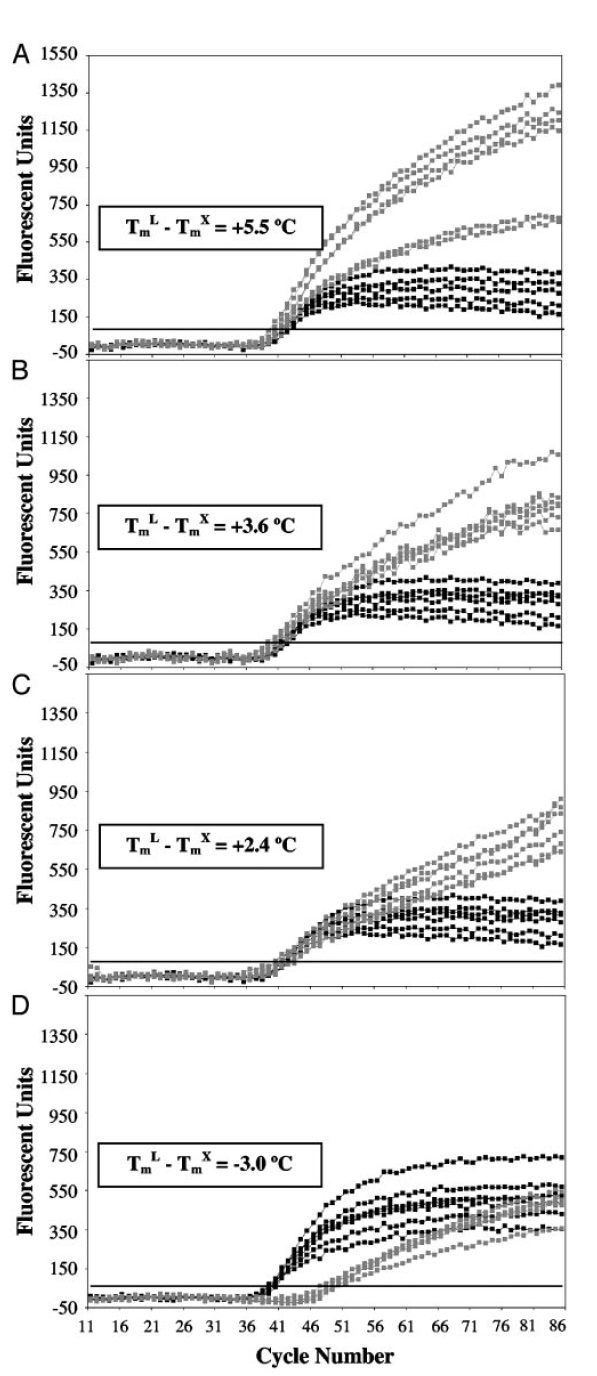
در آزمایشهای LATE-PCR با افزایش TmL نسبت به TmX ، CT کاهش یافته و کارایی واکنش افزایش مییابد. درصورتیکه (TmL – TmX )≥۰ باشد، میتوان از نسبتهای مختلفی از پرایمرها را به کار برد بی آن که بازده واکنش کمتر شود. درنتیجه با LATE-PCR طراحی پرایمرهای مناسب برای استفاده در انواع غلظتها آسانتر میگردد (تصویر ۵).
حساسیت این تکنیک به حدی بالا است که میتواند این وظایف را حتی بر روی یک مولکول الگو به انجام برساند. closed-tube بودن این تکنیک باعث تسهیل automation آن و نیز بازیابی محصولات تک رشته ای تولیدشده برای استفاده به عنوان پروب میگردد. LATE-PCR همچنین نیاز به جداسازی آنزیمی و یا مکانیکی محصولات تکرشتهای و خالصسازی آنها و انجام یک مرحله تکثیر خطی به صورت جداگانه را از بین میبرد و از این لحاظ برای استفاده در توالییابی بسیار مناسب است. این تکنیک میتواند بر روی تمام دستگاههای qPCR موجود اجرا شود و قابل استفاده در آزمایشهای تشخیصی بالینی است؛ خصوصا در شرایطی که مقدار نمونه اولیه اندک باشد. با توجه به موارد ذکر شده، تکنیک LATE-PCR روشی highly informative و مقرون به صرفه در تشخیص جهشها و توالییابی است و خصوصیاتی را که Gyllensten و Elrich برای آن در نظر گرفته بودند، داراست.
