این تکنیک ژنتیک مولکولی، برای نخستین بار در سال ۱۹۷۵ و توسط Edwin Southern معرفی شد و هدف از انجام آن، تشخیص واریانتهای ژنتیکی بود. کاربرد مهم هیبریداسیون Southern blotting در تعیین توالیهای هدفی است که مشابه ژن مورد استفاده به عنوان پروب هستند، اما دقیقا با آن یکسان نمیباشند. به عبارت دیگر، این تکنیک به منظور تعیین میزان قرابت توالیهای DNA یک منبع با منبعی دیگر استفاده میشود.
مقالات مرتبط:
- هیبریداسیون DNA
- نورترن بلاتینگ
- پروب های نوکلئیک اسیدی
توالیهای هدف میتوانند جزئی از خانواده ژنهای مرتبط با یکدیگر از لحاظ تکاملی، توالیهای DNA موجود در داخل یک ژنوم و یا دقیقا معادلی برای پروبی در داخل ژنومی دیگر باشند. در مورد آخر، ژنومها میتوانند از افراد مختلف یک گونه و یا از گونههای متفاوتی تهیه شوند. پس از این که با استفاده از این روش، مرتبط بودن پروب استخراج شده به سایر توالیهای ناشناخته معین شد، میتوان سایر اعضای خانواده ژنی را با بررسی کتابخانههای DNA مناسب، مشخص نمود.
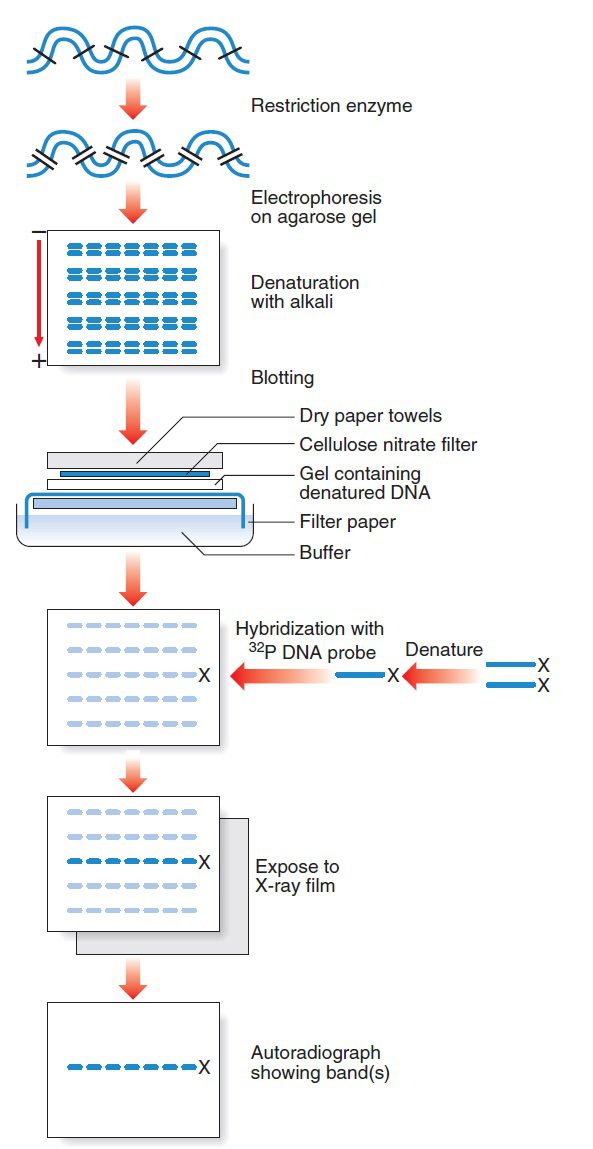
Southern blotting، متشکل از ایجاد هیبرید بین مولکولها DNA منشا گرفته از دو منبع مختلف بوده و دارای دو جزء اساسی است: توالی پروب (ژن دلخواه موجود در یک ارگانیسم) و توالی هدف (توالی DNA موجود در ارگانیسمی دیگر که باید ابتدا استخراج شود). تمرکز اصلی این تکنیک و نخستین گام آن، جداسازی DNA ژنومی با آنزیمهای محدودکننده میباشد. ممکن است یک یا چند آنزیم محدودکننده به این منظور استفاده شوند و قطعات ایجاد شده طولی از صدها تا هزاران جفتباز (۵۰۰ تا ۱۰۰۰۰) خواهند داشت.
قطعات DNA ایجادشده، سپس توسط الکتروفورز در ژل آگارز از همدیگر تفکیک میشوند. هر چه اندازه قطعه بزرگتر باشد، وزن مولکولی آن بیشتر و سرعت حرکت آن در ژل آهستهتر خواهد بود. هدف ما از انجام این کار، استفاده از پروب و تعیین قطعاتی است که حاوی ژن موردنظر میباشند. این کار را میتوان هنگام حضور قطعات در ژل نیز انجام داد؛ اما معمولا موثر نیست. زیرا ماتریکس ژل باعث هیبریداسیونهای نادرست فراوانی میشود که سیگنالهای مربوط به هیبریداسیونهای اختصاصی را پوشش میدهد. در عوض نوارهای DNA موجود در ژل به غشای نیتروسلولزی یا نایلونی انتقال داده میشوند و درنتیجه محیطی با آلودگی کمتر به منظور انجام دقیقتر واکنشهای هیبریداسیون فراهم میگردد.
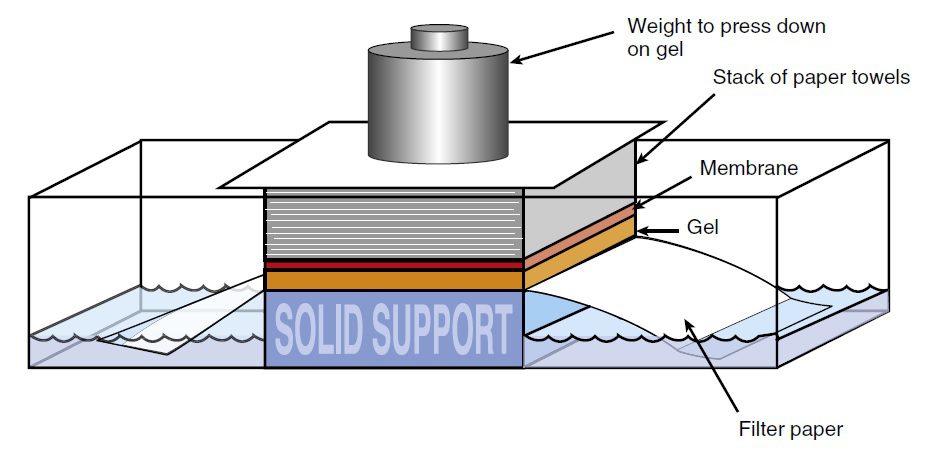
پس در گام دوم، DNA توسط مواد بازی دناتوره (یا انکوباسیون ژل در اسید قوی)، از ژل به یک غشای نیتروسلولزی یا نایلون منتقل و توسط پرتوهای فرابنفش ثابت میگردد. در واقع در این مرحله است که عمل بلاتینگ یا لکهگذاری به انجام میرسد. انتقال مولکولهای DNA تکرشتهای به غشا توسط capillary action صورت میگیرد. مولکولهای DNA پس از انتقال به غشا نیز تکرشتهای میمانند.
پس از این مرحله، پروبهای کوتاه، تکرشتهای و لیبلشده (مثلا cDNA های کلونشده از یک ژن)، با غشای حاوی مولکولهای DNA تکرشتهای انکوبه میشوند. انکوباسیون در دمایی انجام میگیرد که باعث هیبریداسیون مولکولهای DNA به صورت اختصاصی و با کمترین میزان mismatch شود. بسته به میزان موردانتظار از قرابت توالی پروب و هدف، دما و درنتیجه میزان mismatch قابل تحمل، میتواند تغییر کند. در دماهای بالا، پروب تقریبا به توالیهای کاملا منطبق متصل خواهد شد. این در حالی است که در دماهای پایین، پروب ممکن است به جایگاههایی با چندین mismatch اتصال یابد. تمام اتصالات غیراختصاصی پس از شستوشوی پایه از هم گسسته خواهند شد.
لیبل کردن مولکولهای پروب میتواند با استفاده از مواد رادیواکتیو مانند ۳۲P، بیوتین و یا دیگوکسیژنین انجام بگیرد. در صورتی که پروب رادیواکتیو باشد، از فیلم عکاسی استفاده میشود. در صورتیکه پروب با بیوتین و یا دیگوکسیژنین لیبل شود، غشا ابتدا باید تحت تاثیر سوبسترای chemiluminescent قرار بگیرد تا هیبریدهای تشکیل شده بین پروب و مولکول هدف مشخص شوند و سپس آن را در معرض فیلم عکاسی قرار دهیم. این روشهای غیررادیواکتیو، ایمنتر و سریعتر میباشند. البته لیبلهای بیوتین یا دیگوکسیژنین میتوانند با قرار گرفتن تحت تاثیر مواد کروموژن نیز مشاهده شوند.
درنتیجه قرار دادن غشا در معرض فیلم، موقعیت پروبهای اتصال یافته به توالیهای هومولوگ به صورت الگوی خاصی از نوارها تشکیل میشود که منطبق بر قطعات ژنومی نشاندهنده پروب مورداستفاده میباشند. از آنجایی که ثابت شدن DNA روی غشا دقیقا به ترتیبی که در ژل وجود داشت صورت میگیرد، طول نوارها نشان دهنده اندازه قطعات DNA خواهد بود. در صورت استفاده از مواد کروموژن در روش غیر رادیواکتیو، معمولا نوارهای آبی موقعیت هیبریدهای موردنظر را نشان خواهند داد.
در صورتیکه جایگاه تشخیص آنزیم محدودکننده مشخصی در ژن درنتیجه پلیمورفیسم یا جهشی بیماریزا تغییر یافته باشد، الگوی نوارها در آنالیز Southern blotting پروب مورد بررسی تغییر خواهد یافت. این فرایند به RFLP (Restriction fragment length polymorphism) معروف است. سالها پیش از اختراع تکنیک PCR، تشخیص دقیق جهشهای نقطه ای توسط Southern blotting انجام میشد. امروزه این متد پیچیده دیگر برای شناسایی واریانتهای ساده ژنتیکی استفاده نمیشود (PCR به طور موثرتری این کار را انجام میدهد). البته Southern blotting همچنان در شناسایی تغییرات اساسیتر در طول DNA، مانند بیماریهای تکرار سهتایی (trinucleotide repeat diseases)، روش انتخابی محسوب میگردد.
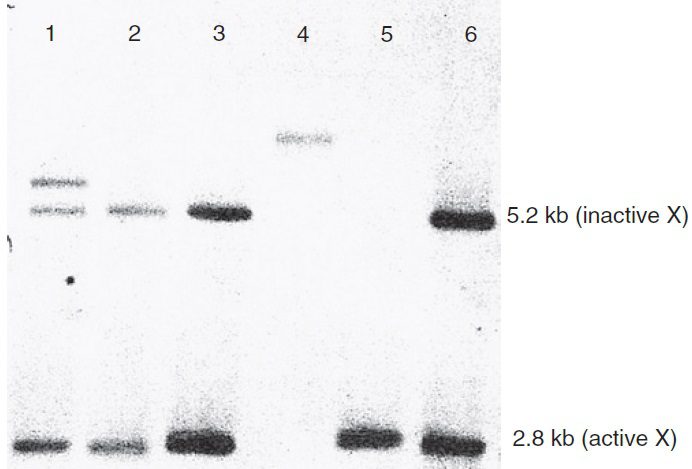
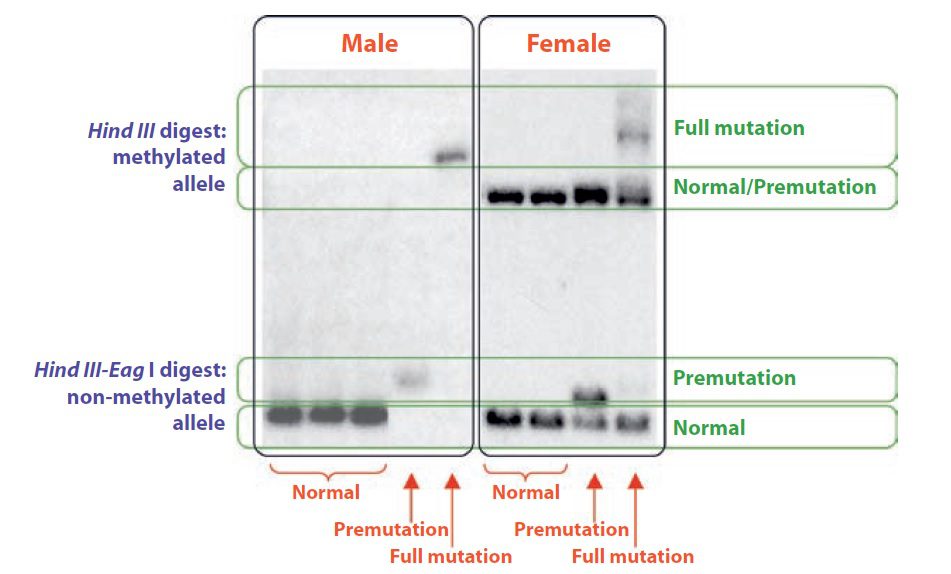
میشود.
