چکیده
مدروکسی پروژسترون استات ذخیره شده (DMPA) یکی از داروهای بسیار محبوب جهت پیشگیری از فعال شدن هورمون های بارداری به خصوص در مناظق با شیوع بالای ایدز و دیگر بیماری های مقاربتی (STI) است. در حالی که مطالعات مشاهده ای DMPA را به عنوان یک فاکتور مهم در STI شناسایی کرده اند، مکانیسم های زیر بنایی این اتصال نامشخص است. لوونورژسترول (LNG) پروژسترون دیگری جهت استفاده برای پیشگیری از بارداری هورمونی است، اما اثر آن بر حساسیت STI بسیار کمتر مورد توجه قرار گرفته است. با استفاده از یک مدل موش عفونت تناسلی HSV-2، مشاهده شد که DMPA و LNG به طور مشابهی سبب کاهش بیان ژن تناسلی desmosomal cadherin در desmoglein-1α (DSG1α)، افزایش دسترسی سلولهای التهابی به بافت تناسلی به همراه افزایش نفوذ پذیری مخاط اپیتلیال، و افزایش حساسیت به عفونت ویروسی می شوند. مطالعات اضافی انجام گرفته بر روی موش سالم، افزایش-DMPA سبب نفوذپذیری مخاط و ترویج التهاب بافت به همراه تسهیل حمله میکروبی درون زاد به واژن شدند. در مقابل، درمان DMPA و شیاف استروژن بطور همزمان سبب ترمیم عملکرد مخاط و مانع عفونت HSV-2 شد. ارزیابی بافت بیوپسی ectocervical زنان قبل و ۱ ماه بعد از شروع درمان با DMPA التهاب قابل ملاحظه ای را نشان داده و درمان را به تعویق انداخت. اما تغییرات مشاهده شده در موشهای تحت درمان با پروژسترون نشان دهنده درمان بود. نتایج تحقیقات ما نشان می دهد که DMPA و LNG سبب کاهش سد مخاطی آلت تناسلی؛ کاهش دفاع در برابر بیماری STI شد، اما ممکن است پایه و اساس استراتژی های جدید پیشگیری از بارداری حفاظت بیشتری را نشان بدهند.
مقدمه
زنان مبتلا به ایدز در کشورهای جنوب صحرای آفریقا، یکی از قربانیان ایدز هستند که بیشتر عامل ابتلا به ایدز در آنها، انتقال از مردان به زنان در حین رابطه جنسی می باشد. در حالی که مطالعات مشاهده ای متعدد انجام گرفته بر روی پیشگیری هورمونی از بارداری توسط مدروکسی پروژسترون استات تزریقی (DMPA) به عنوان یک عامل خطر مهم برای کسب اچ آی وی و دیگر عفونت های منتقله از راه جنسی (STI) شناسایی شده است، مطالعات دیگر موفق به شناسایی این ماده شدند. با این حال، بین استفاده از روش پیشگری هورمونی از بارداری و رفتار (به عنوان مثال، تمایل بالاتر به رابطه جنسی محافظت نشده در میان افراد استفاده کننده از روشهای پیشگیری بارداری هورمونی) ممکن است بین نتایج داده های حاصل از مطالعات مختلف تناقضات زیادی وجود دارد. لوونورژسترول (LNG) پروژسترون مورد استفاده در دستگاه های داخل رحمی (IUD) است که اثر ضد بارداری قابل برگشت و طولانی مدت (LARC) را نشان داده است، اما اثر آن بر حساسیت STI بسیار کمتر از DMPA، هم در تست های آزمایشگاهی و بالینی، کمتر مورد توجه قرار گرفته است.
با توجه به محدودیت های مطالعات مشاهده ای، علاقه به انجام آزمایش های کنترل شده تصادفی (RCT) به سبب دقیق تر بودن تعریف روابط بین حساسیت STI و استفاده از DMPA، LNG، و دیگر LARC وجود دارد. با این حال، شواهد موجود در حال حاضر اثبات کننده ارتباط بین استفاده از DMPA و STI و نگرانی از انتخاب تصادفی زنان به درمان خاص LARC می باشد، در حالی که مطالعات قبلی که بطور تصادفی زنان DMPA را دریافت می کردند، گزارشات کمتری در این مورد وجود دارد. علاوه بر این، تمامی تحقیقات بالینی، از جمله RCT، شناسایی مکانیسم های بیولوژیکی از LARC را به سبب افزایش حساسیت در بیماران STI مورد توجه قرار داده اند. در حالی که نازک شدن مخاط دستگاه تناسلی، سبب التهاب بافت، سرکوب پاسخ های ایمنی با واسطه سلولی و میکروبی واژن، تغییر برای اتصال DMPA با افزایش کسب STI، به عنوان مکانیسم پیشنهاد شده است که بطور تجربی هنوز اثبات نشده است. هدف از این تحقیق بررسی نتایج یک سری آزمایشات انجام گرفته با استفاده از مدل موش و آزمایشات بالینی دستگاه تناسلی که مکانیسم های دفاعی ضد ویروسی میزبان خاص فعال شده با پروژستین در LARC را به خطر می اندازد، می باشد.
نتایج
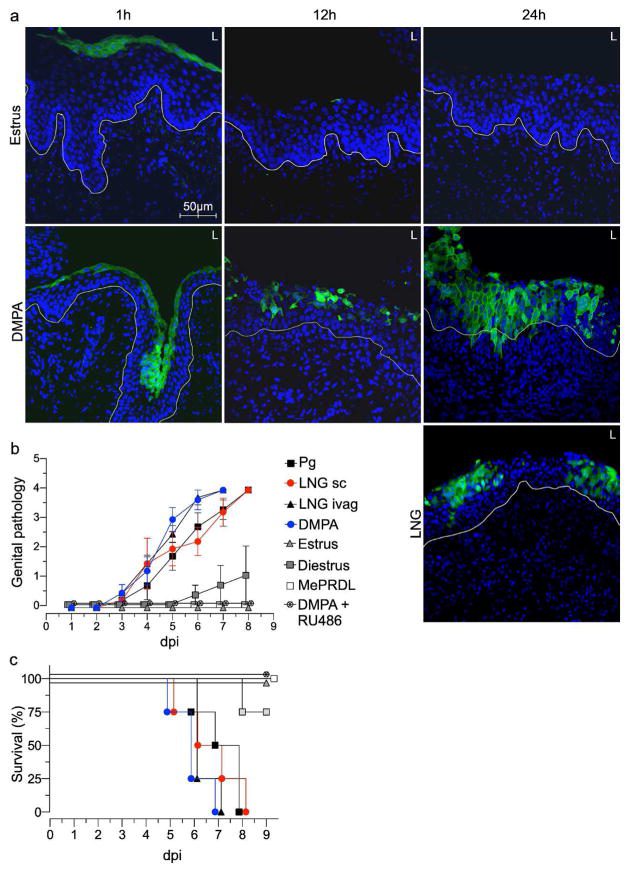
DMPA و LNG سبب افزایش حساسیت موش به ویروس هرپس سیمپلکس عفونتی نوع ۲ (HSV-2) شده و درمان با DMPA سبب افزایش عفونت ویروسی و باکتری در جوندگان مختلف و مدل های پستانداران غیرانسانی و عفونت دستگاه تناسلی زنان شد. به منظور تعریف مکانیسم مسئول این مشاهدات تجربی، در پژوهش حاضر ما یک سیستم که در آن DMPA باعث می شود موش بسیار مستعد ابتلا به عفونت شیاف ivag HSV شود، استفاده شده است. ویروس هرپس سیمپلکس (HSV-1 و HSV-2) پاتوژن انسانی است که سبب آلودگی سطوح مخاطی می شوند. تکرار اولیه این ویروس ها در سلول های اپیتلیال باعث عفونت لیتیک مولد شده و به سرعت به سیستم عصبی مرکزی انتشار می یابند. در مدل موشی مبتلا به عفونت تناسلیHSV-2، عفونت لیتیک به طور خاص باعث سبب آسیب تناسلی گسترده شده و خیلی زود به سبب تغییر آنسفالیت کشنده می شود.
در حالیکه هیچ MPA متصل به گیرنده پروژسترون (PR) و گیرنده گلوکوکورتیکوئید ها GR)، LNG) (معمولا در پروژسترون مورد استفاده در IUD ارائه شده برای LARC) به طور خاص اتصالات PR مشاهده نشد. با استفاده از همان موش های مدل عفونت HSV-2 (اما تحت درمان با ال ان جی به جای DMPA)، ما توانستیم تغییراتی ایجاد شده در استعداد ابتلا به پاتوژن ویروسی ناحیه تناسلی و نقش روابط عمومی یک آگونیست مشخص تر را بررسی کنیم. در این مطالعه، ما متوجه شدیم که LNG سبب افزایش انتشار HSV-1 فلوئورسانس و استعداد ابتلا به عفونت ivag HSV-2 از راه یکسان شده و نتایج مشابهی با DMPA بدست آمد (شکل ۱a و ۱C). سپس ما یک استراتژی مشابه را در این موش های مدل به منظور بررسی اثر تجویز متیل پردنیزولون (MePRDL) (آگونیست GR خالص)، پروژسترون (PG) و یا DMPA و mifepristone (RU486) (یک آنتاگونیست GR وPR) قبل از عفونت بکار گرفتیم.
شبیه به اثرات استفاده از DMPA یا LNG، عفونت کشنده در موش های تحت درمان با PG مشاهده شد (شکل ۱b و ۱c محل). در مقابل، هیچ عوارض و مرگ و میری در موش های درمان شده با DMPA و RU486 یا MePRDL مشاهده نشد (شکل ۱b و ۱c محل). جالب توجه است، تجزیه و تحلیل جداگانه از بافت های واژن موش در فحلی، و موش تحت درمان با DMPA، LNG و یا MePRDL، نشان داد که MePRDL به تنهایی بیان کننده ژن های تنظیم کننده گلوکوکورتیکوئید می باشد (به طور خاص، افزایش بیان القا شده از گلوکوکورتیکوئید لوسین زیپ، گلوکوکورتیکوئید کیناز ۱، دو فسفاتاز پروتئین اختصاصی ۱ و کاهش بیان گیرنده گلوکوکورتیکوئید مدوله) (شکل S1). روی هم رفته، مطالعات اولیه نشان داد که افزایش حساسیت موش ها به عفونت ivag HSV-2 از اثر پروژستین ها می باشد (از جمله MPA و LNG)، اما یک اثر آگونیست GR MePRDL نیست.
DMPA و LNG نفوذپذیری مخاط دستگاه تناسلی موش را افزایش داد
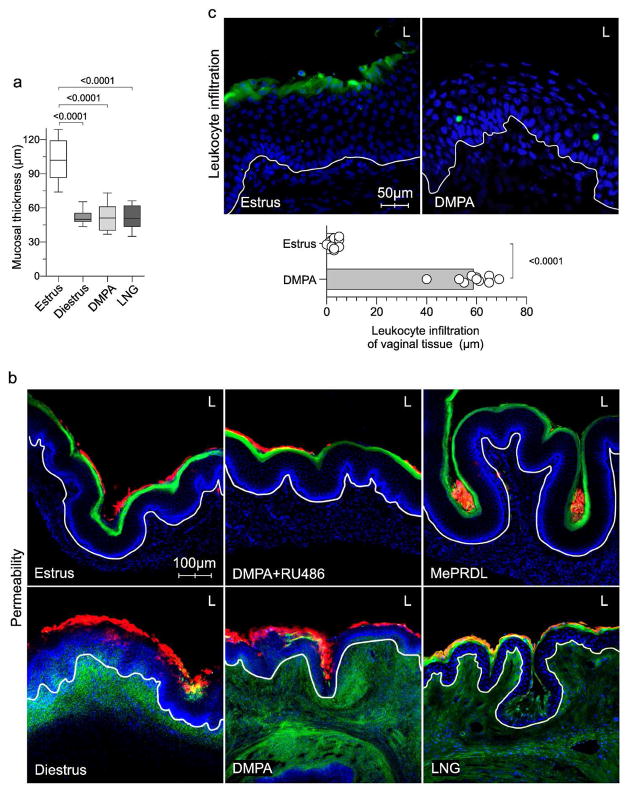
بدلیل آسیب دیدن دستگاه تناسلی خارجی ظرف مدت ۳ روز پس از درمان با DMPA و یا آلوده بودن اندم های تناسلی موشهای تحت درمان با ال ان جی (به عنوان مثال، قبل از تشکیل HSV-خاص ایمنی اکتسابی)، ما بر روی اثرات این پروژستین در ایمنی ذاتی دستگاه تناسلی زنان و به طور خاص مانع مخاطی، تمرکز کردیم. در مطالعات اولیه، احتمال افزایش قابل توجه در مرگ و میر موشهای تحت درمان با پروژسترون در مقایسه با موش های آلوده در دی استروس (۱۰۰٪ در مقابل ۲۵٪، به ترتیب) (شکل ۱C)، به افزایش نازک شدن مخاط ناحیه تناسلی، وجود داشت. با این حال، ما متوجه ضخامت مخاط واژن بین موش های مبتلا به دی استروس و بعد از درمان با پروژسترون (شکل ۲a و شکل S2) شدیم، که این نشان می داد نازک شدن مخاط تنها دلیل مرگ و میر آشکارا و بالاتر در موشهای تحت درمان با پروژسترون است.
بر اساس این نتایج، ما در کنار اثرات پروژسترون به بررسی نفوذ پذیری مخاط تناسلی بطور داخل واژنی از مولکول های فلورسنت ۴۵۷ دالتون و ۷۰ دالتون در مرحله فحلی، مرحله دی استروس و موش های تحت درمان با DMPA- یا موشهای تحت درمان با ال ان جی پرداختیم. چهل و پنج دقیقه بعد، موش ها معدوم شده و دستگاه تناسلی آنها برای ارزیابی نفوذ مولکول های فلورسنت به مخاط واژن با میکروسکوپ کانفوکال برداشته شد. نتایج بدست آمده به طور کامل با بقای موش بعد از عفونت HSV-2 کاملاً سازگار بود (شکل ۱C)، تصاویر نشان داد که نفوذ پذیری به مولکول فلورسنت ۴۵۷ دالتونی در موش در مرحله دی استروس افزایش یافته بود. اما به طور چشمگیری در اثر درمان با DMPA یا LNG افزایش نشان داده بود (شکل ۲B). در مقابل، نفوذ پذیری به این مولکول ها در موش های درمان نشده در دوران فحلی و موش های درمان شده با MePRDL یا هر دوی DMPA و RU486 مشاهده نشد (شکل ۲B). جهت پیگیری این نتایج، ما درمان پروژسترونی را به طور مشابه انجام دادیم و نتیج نشان دهنده تسهیل نفوذ در بافت لکوسیت، سلول های ایمنی درگیر در انتقال HIV و دیگر STI بود. و سازگار با نفوذ افزایش یافته است از وزن مولکولی کم (LMW) مولکول، دیدیم که فلوئورسانس برچسب اسپلنوسیت سینرژیک به آسانی نفوذ بافت مخاط واژن از DMPA تحت درمان با موش موش اما در فحلی (شکل ۲C). این نتایج نشان داد که دومی progestinmediated افزایش نفوذپذیری مخاط دستگاه تناسلی به تسهیل انتشار مولکول LMW در سراسر مانع مخاطی محدود نمی شد، اما توسعه یافته به افزایش دستگاه تناسلی نفوذپذیری سطح اپی تلیال به طور قابل ملاحظه سلول های با اندازه بزرگ است که وارد بافت مخاطی توسط فرآیندهای فعال است.
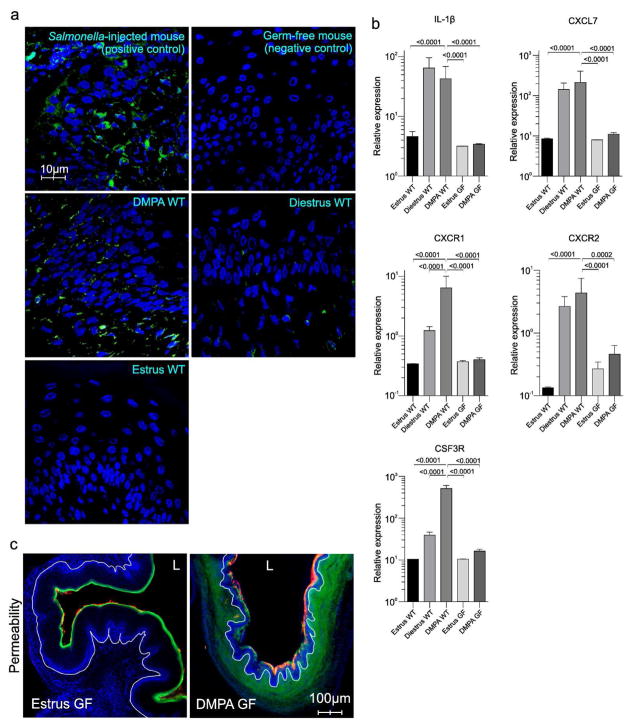
DMPA تسهیل کننده حمله میکروبی واژن درون زا به بافت دستگاه تناسلی
در حالی که مطالعات بالینی متعدد التهاب بافت تناسلی را در زنان تحت درمان با DMPA خبر دادند، اما هیچ توضیحی برای این مشاهدات ارائه نشده است. از آنجا که افزایش نفوذ پذیری عمیق در مخاط ناحیه تناسلی در موشهای تحت درمان با DMPA دیده می شود، ما فرض می کنیم که DMPA سبب ترویج التهاب بافت با تسهیل نفوذ باکتری درون زای واژن می شود. برای آزمایش این فرضیه، ما روش رنگ آمیزی گرم و فلورسانت کردن اسید نوکلئیک و پپتید را با روش هیبریداسیون درجا برای شناسایی باکتری های موجود در بافت های واژن موش سالم در دوران فحلی و یا دی استروس و یا عفونت موشهای تحت درمان با DMPA استفاده کردیم. ما تعداد بیشتری از باکتری های گرم منفی را در بافت زیرمخاطی در مرحله دی استروس و موشهای تحت درمان با DMPA، با مشاهده شدت سیگنال بیشتر، مشاهده کردیم (شکل S4 و شکل ۴A). علاوه بر این، بافت های واژن این موش ها به میزان زیادی بیان ژن های سایتوکاین پیش التهابی اینترلوکین IL-1β، پروتئین اساسی نوتروفیل پلاکت (PPBP) (همچنین به عنوان CXCL7 شناخته می شود)، گیرنده کموکاین CXCR1 و CXCR2 و محرک کلونی گیرنده عامل ۳ (CSF3R) (همچنین به عنوان شناخته شده G-CSF) مشاهده شد (شکل ۴B). ایجاد التهابی تایید کننده عوارض نفوذ درون زا باکتری بود، هیچ گونه افزایش DMPA واسطه ای در التهاب دستگاه تناسلی دیده نشد که نتیجه می شود موش های تحت درمان با DMPA عاری از میکروب (به عنوان مثال، موش بدون میکروبی واژن) قرار گرفتند (شکل ۴B). در مقابل، مولکول LMW به آسانی به مخاط واژن در موش های سالم تحت درمان با DMPA عاری از میکروب (شکل ۴C) نفوذ نشان دادند، که این نشان دهنده اثر افزایشی DMPA در نفوذپذیری مخاط و در نتیجه افزایش التهاب در واژن است. تمامی این مطالعات نشان دهنده اثر تسهیل کنندگی DMPA به حمله میکروبی درون زا به بافت تناسلی و افزایش التهاب دستگاه تناسلی می باشد.
استروژن اگزوژن موشهای نجات یافته تحت درمان با DMPA
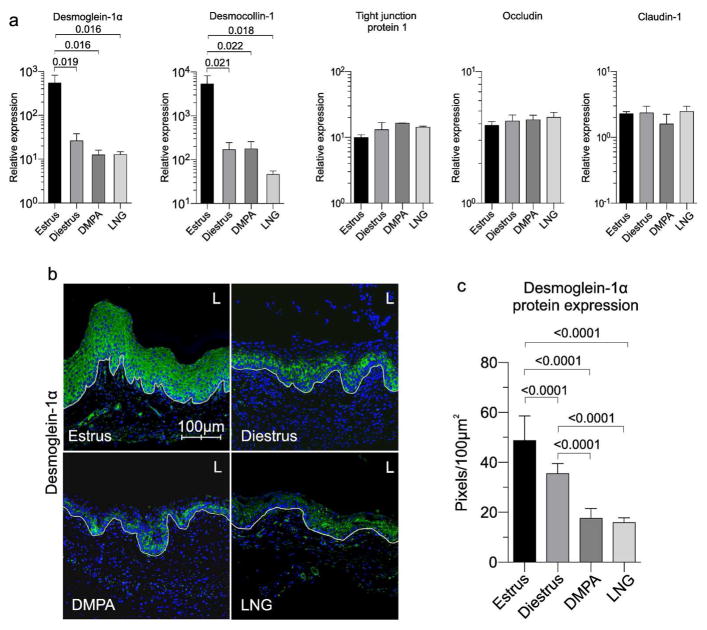
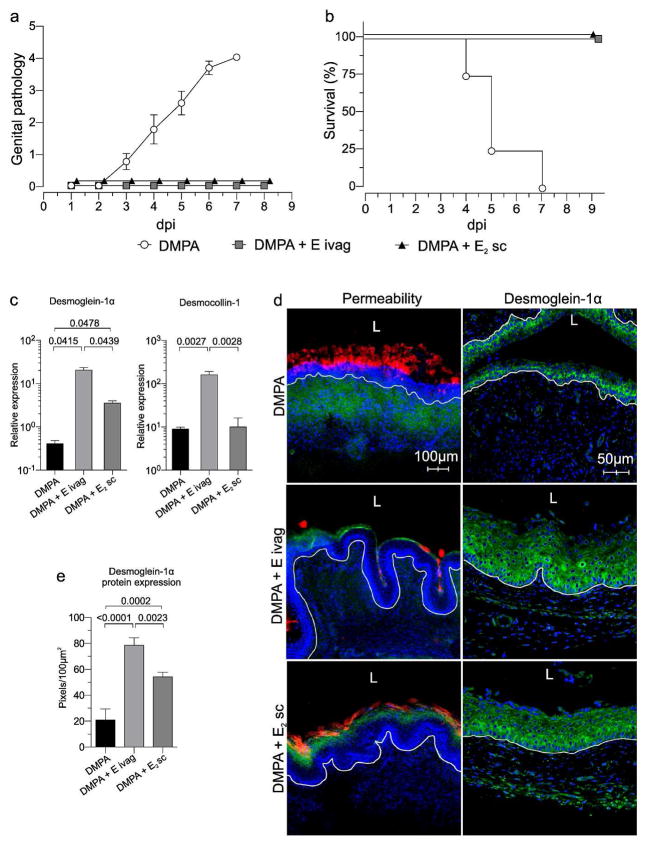
ویروس کشنده عفونت HSV-2 در دوران فحلی (یعنی مرحله سیکل فحلی با اوج سطح استروژن درون زا) موش سبب افزایش بیان ژن DSG1α در بافت شده بود که این امر منجر به حفاظت بیشتر مخاط و imperنفوذناپذیری نسبت به عفونت ivag HSV-2 می باشد. ما موش ها را همزمان با DMPA و کرم واژینال تجاری حاوی استروژن کونژوگه تحت درمان قرار دادیم. و فرضیه ما این بود که ۱۰۰٪ بقا در موش های تحت درمان در مقابل عفونت HSV-2 مشاهده خواهد شد (شکل ۵a و ۵B). میزان مقاومت در برابر عفونت ivag HSV-2 در موش های تحت درمان با DMPA سیستماتیک و ۱۷ β استرادیول (E) مشابه بود (شکل ۵a و ۵B)، این نشان می دهد که افزایش بقای ایجاد شده توسط درمان استروژنی به معنی عدم دسترسی ویروش به مخاط واژن در زمان استفاده از کرم نیست.
نفوذپذیری مخاط واژن نیز در موش های درمان شده با DMPA و هم درمان شده با استریوژن مشاهده شد (۵D شکل). در حالی که کاهش progesteronemediated در اپیتلیوم کراتینیزه واژن به عنوان مکانزیمی که DMPA باعث افزایش حساسیت به عفونت دستگاه تناسلی می شود، در نظر گرفته شده است. کراتینیزه اپیتلیوم واژن تنها در مرحله فحلی موش افزایش نشان داده بود، در حالی که هر دو موش (موش های درمان شده با DMPA و استرویژن) در مرحله فحلی به عفونت HSV-2 (شکل S5) مقاوم بودند. روی هم رفته، نتایج ما نشان می دهد که مانع اپیتلیال نقش مهم تری نسبت به کراتینیزه در حفاظت موش ها در مقابل عفونت ivag HSV-2 ایفا می کند.
درمان DMPA سبب افزایش نفوذپذیری بافت مخاطی ectocervical انسان شد
با طراحی آزمایش مشابه در موش، ما به دنبال ارائه ارتباط بالینی و افزایش نفوذپذیری مخاط ناحیه تناسلی دیده شده در موشهای تحت درمان با DMPA بودیم. برای این مطالعات، ما بافت بیوپسی ectocervical به دست آمده از زنانی که هیچ گونه پیشگیری از بارداری هورمونی را انجام نداده بودند، ۱ ماه پس از درمان با DMPA، مورد ارزیابی قرار دادیم . شایان ذکر است، در مقایسه با بافت بیوپسی جمع آوری شده از زنان ثبت نام کرده، ما مشاهده کردیم که بافت بیوپسی ectocervical جمع آوری شده پس از درمان با DMPA به طور قابل توجهی کاهش داشت. نتایج با افزایش التهاب بافت تناسلی در موش های سالم تشخیص داده و تیمار شده با DMPA همخوانی داشت (شکل ۴B)، بافت ectocervical زنان به طور قابل توجهی دارای مولکول های پیش التهابی متعدد، از جمله IL-1β، CD14 (لیپوپلی ساکارید شرکت گیرنده) و CD177 (در نوتروفیل خاص PECAM-1 لیگاند انسان) بود (شکل ۶B). کاهش بیان DSG1 و افزایش سطح مولکول های پیش التهابی، و افزایش نفوذپذیری قابل توجه مخاط در بافت ectocervical جمع آوری شده از زنان یک ماه پس از تزریق با DMPA (شکل ۶C و ۶D) مشاهده شد. جالب توجه است که این افزایش نفوذپذیری مخاط با سطح سرمی MPA زنان همبستگی مثبت را نشان دادند (شکل ۶E و ۶F). داده های بالینی ما تغییراتی را در التهاب بافت تناسلی، چسبندگی سلول-سلول و افزایش نفوذپذیری مخاط در بافت ectocervical زنان استفاده کننده از DMPA نشان داد که دقیقا با تغییرات موجود در بافت تناسلی موشهای تحت درمان با DMPA مشابه بودند.
 بحث
بحث
STI و مشکلات بارداری ناخواسته بسیار به هم پیوسته هستند و کشورهای با بزرگترین شیوع STI اغلب بالاتر نوزادان و نرخ مرگ و میر مادران و نیاز بیشتری برای پیشگیری از بارداری موثر است. از ۲ دهه پیش، DMPA به عنوان یک عامل خطر برای ابتلا به بیماری STI شناخته شده است، اما این نتیجه همیشه در مطالعات بعدی دیده نمیشد، و این نگرانی مداوم درباره تفسیر داده های مطالعات بالینی وجود داشت و در نتیجه روابط جنسی محافظت نشده در میان زوجین همیشه از جنبه پیشگیری از بارداری هورمونی مبهم بوده است. در حالی که اکثر مطالعات قبلی نجام گرفته بر روی ارتباط استفاده از DMPA و کسب اچ آی وی متمرکز شده بودند، DMPA نیز به تازگی به عنوان یک عامل خطر برای انتقال جنسی HSV-2 از زنان به مردان شناسایی شده است. برای تعریف اثرات واسطه گری DMPA در سیستم دفاعی میزبان و اثرات ضد ویروسی آن در دستگاه تناسلی زن، در اینجا ما یک سیستم تجربی که در آن موشهای تحت درمان با DMPA به طور یکنواخت مستعد ابتلا به عفونت های دستگاه تناسلی HSV-2 بودند، استفاده کردیم. با استفاده از این سیستم، ما کشف کردیم که درمان تا حد زیادی سبب کاهش چسبندگی سلول-سلول در بافت تناسلی شده و به طرز چشمگیری سبب افزایش نفوذپذیری مخاط دستگاه تناسلی به مولکول LMW، ذرات ویروس عفونی، التهابی سلول و باکتری درون زا خواهد شد.
این نقش واسطه ای DMPA در نفوذپذیری مخاط ناحیه تناسلی ممکن است با پاتوژنز ویروسی ارتباط خاصی داشته باشد، به طوریکه کارهای اخیر انجام شده بر روی پستانداران غیرانسانی، نشان دهنده عمق نفوذ ویروس به اپی تلیوم (به عنوان مثال، ectocervix) بوده و با نفوذپذیری مستقیم اپیتلیال متناسب است. در حالی که عفونت HSV-2 سبب مرگ و میر ۱۰۰٪ موشهای تحت درمان با DMPA بودند. اما موش های آلوده شده در مرحله دی استروس فقط کمی بیشتر مستعد ابتلا به عفونت در نقایسه با موش آلوده شده در مرحله فحلی بودند. این یافته های تجربی نشان می دهد که سطوح بالاتری از پروژسترون درون زا سبب افزایش استعداد ابتلا به عوامل بیماری زا تناسلی ویروسی می شود، اما تماس طولانی تر با پروژسترون اگزوژن بدون هیچ گونه مخالفتی نشان دهنده خطر بیشتر برای ابتلا به ویروس می باشد. آنها همچنین مانع بزرگی برای مطالعات بالینی به دنبال تمایز قائل شدن میان خطرات و پروژسترون واسطه اگزوژن برای کسب ویروس در مقابل کسانی که در ارتباط با مراحل چرخه قاعدگی جلب توجه، و برجسته کردن اهمیت مدل های حیوانی دقیقا برای تعریف قدرت ارتباط بین استفاده خاص LARC و STI حساسیت.
علاوه بر تعریف اثرات واسطه گری پروژسترون در نفوذپذیری مخاط دستگاه تناسلی، نجات موشهای تحت درمان با DMPA و کرم موضعی استریوژن نشان دهنده اثر DMPA و استریوژن سبب آزاد شدن استرادیول در دستگاه واژن بوده و ممکن است مبنایی برای استراتژی های پیشگیری از بارداری باشد، و کمتر احتمال دارد که سبب افزایش استعداد ابتلا به عوامل بیماری زای تناسلی شوند. جالب توجه است، یافته های ما متناسب با گزارش های قبلی که نشان دادند استریوژن سبب ترویج نابودی سلول های اپیتلیال بوده و پستانداران غیر انسانی تحت درمان با استریوژن در مقابل عفونت SIV تناسلی مقاوم تر خواهند بود. بنابراین، استفاده از ترکیبی از پروژسترون حاوی پیشگیری از بارداری تزریقی و دستگاه زایمان طبیعی استرادیول ممکن است حاوی یک رویکرد عملگرایانه برای پیشگیری از بارداری هورمونی باشد. در یک سناریوی احتمالی، زنان استفاده کننده از DMPA و حلقه واژن استرادیول آزاد اثرات ضدویروسی قوی را نشان می دهند. در حالی که در حال حاضر به نظر می رسد فقط یک جایگزین فرضی، تعیین ایمنی و اثر بخشی از چنین رویکردی به بررسی های بیشتری نیاز دارد.
مواد و روش ها
بررسی بافت بیوپسی ectocervical انسان قبل و بعد از شروع روش DMPA مطابق با بیانیه هلسینکی توسط دانشگاه ایالتی اوهایو (OSU) پزشکی علوم نهادی انجمن (ClinicalTrials.gov شناسه NCT02011711) نقد و بررسی انجام شده و مورد تایید قرار گرفت. زنان سالم و غیر باردار ۱۸-۲۵ ساله با سابقه گزارش قاعدگی منظم، بدون استفاده از وسایل پیشگیری از بارداری هورمونی طی ۶ ماه قبل، و تصمیم گیری شخصی برای شروع استفاده از DMPA واجد شرایط برای شرکت در آزمون بود. پس از اخذ رضایت کتبی، شرکتکنندگان ثبت نام شدند و برنامه ریزی ها مطابق موافقتنامه اواخر مرحله فولیکولی چرخه قاعدگی شرکت کنندگان انجام شد. در مراحل ثبت نام، ۳ بیوپسی ectocervical 12 ساعته، ۴ ساعته و ۸ ساعته در موقعیت ectocervix به دست آمد. بافت بیوپسی در RNAlater® (فن آوری های نوین، حفره های CA) حمل و نقل قرار داده شد.
محیط های حاوی RPMI-1640) Cellgro، MEDIATECH شرکت مناسس VA) و ۱۰٪ AB سرم انسانی (آتلانتا بیولوگیکال GA)، ۲ میلی متر L- گلوتامین، ۱ میلی متر پیروات سدیم، اسیدهای آمینه غیر ضروری، ۱۰۰ U / میلی لیتر پنی سیلین، ۱۰۰ میکروگرم / میلی لیتر استرپتومایسین، ۵۰ میکروگرم / میلی لیتر جنتامایسین و ۵۰ میکرومولار ۲-ME، همه Cellgro) بودند. برنامه ریزی بصورتی انجام شد که زنان یک تزریق DMPA 150 میلی گرم را در آغاز چرخه قاعدگی بعدی خود دریافت کنند و پس از ۳۰-۴۵ روز از درمان به درمانگاه مراجعه کردند. در این بازدید، ۳ بیوپسی طی زمان های ۲ ساعت، ۶ ساعت و ۱۰ ساعته در موقعیت ectocervix جمع آوری شده و عینا در پرونده هر شخص ثبت و پردازش شد. در طی بازدید بازدیدکنندگان مکان های بیوپسی را قبل از آن مورد بررسی قرار دادند و بدون استثنا این مکان ها طور کامل شفاف بودند. در هر مراجعه، خون محیطی برای به دست آوردن سرم، که برای اندازه گیری غلظت MPA سرم (همانطور که قبلا توضیح داده شد و مورد استفاده قرار گرفت) جمع آوری شده و نمونه های بافت تناسلی جمع آوری شدند که عدم وجود نایسریا گونوره، کلامیدیا تراکوماتیس، تریکوموناس واژینالیس تایید شد و عفونت های واژن از طریق تقویت اسید نوکلئیک و حضور فلور طبیعی واژن توسط ارزیابی لکه ها بررسی شد.
درمان موش با استروئید جنسی اگزوژن
این آزمایشات توسط سازمان کمیته مراقبت و استفاده از حیوانات آزمایشگاهی OSU و موش تایید شده بودند. همانطور که نشان داده شد، pg (Calbiochem، (Jolla CA، LNG، mifepristone یا استرادیول (E) (همه سیگما آلدریچ، سنت لوئیس MO) در یک هموژنیزاسیون شیشه ای برای ایجاد سوسپانسیون در PBS به مدت ۱۵ دقیقه قبل از بررسی in vivo همگن شدند. به همین ترتیب، انتشار پایدار DMPA تزریقی (دپو Provera®)) و MePRDL (®DepoMedrol) (هر دو از شرکت Pharmacia و Upjohn، نیویورک نیویورک خریداری شدند) در PBS قبل از تزریق اتصال کنژوگه شدند. استروژن کرم واژینال (Premarin®) (خریداری شده از شرکت Wyeth (، در ivag تهیه شد. رقیق شد اجرا شد. همانطور که نشان داده شد، زن ۶ -۸ هفته ای نوع وحشی (WT) نژاد موش های C57BL / 6J (جکسون آزمایشگاهی) به صورت زیر جلدی (SC) با ۱ میلی گرم DMPA یا ۲ میلی گرم MePRDL (یعنی دوزی که سرکوب کننده سیستم ایمنی در موش هست) ۵ روز قبل از عفونت و یا در روز عفونت تزریق شدند و در مراحل سیکل فحلی ارزیابی شدند (همانطور که قبلا توضیح داده شد). همچنین نشان داده شد که میزان ۱ میلی گرم در روز s.c. به مدت ۵ روز قبل و ۳ روز بعد از عفونت به موش ها تزریق شد. برای مدیریت LNG، موش ها روزانه و ۵ روز قبل از درمان تا ۳ روز پس از عفونت با ۲.۵ میکروگرم سوسپانسیون LNG در ۱۰ میکرولیتر PBS (برای مدیریت ivag) و یا ۱ میلی گرم ال ان جی در حالت تعلیق در ۱۰۰ میکرولیتر PBS (برای تزریق s.c.) مورد درمان قرار گرفتند. همچنین موشها تحت درمان با DMPA و s.cقرار گرفتند. آنها تحت درمان با ۱ میلی گرم RU486 یا ۱ میلی گرم E به مدت ۵ روز قبل و ۳ روز بعد از عفونت، یا ivag با استروژن کنژوگه کرم واژینال و روزانه به مدت ۵ روز قبل از عفونت تحت درمان قرار گرفتند. همچنین ۶ موش و زن عاری از میکروب C57BL در مرحله سیکل فحلی مورد بررسی قرار گرفتند.
عفونت HSV-1 و HSV-2
موش با ۱۸/۰ میلی گرم زایلازین (لوید آزمایشگاه، شناندو IA) و ۱/۰ میلی گرم کتامین هیدروکلراید (JHP داروها، LLC روچستر MI) تحت درمان قرار گرفتند و ivag با ۱۰ واحد پلاک (PFU) از WT آلوده با HSV-2 333 (ارائه شده توسط دکتر رابرت هندریکس، دانشگاه پیتزبورگ) در ۱۰μL از RPMI تهیه شد. آسیب شناسی تناسلی روزانه با استفاده از مقیاس ۵ نقطه ای (قبلا توضیح داده شد) مورد بررسی قرار گرفت؛ ۰: هیچ آسیب شناسی؛ ۱: اریتم ولو خفیف، ۲: اریتم ولو در حد متوسط؛ ۳: اریتم شدید فرج و از دست دادن خز پرینه؛ ۴: زخم پرینه؛ ۵: گسترش زخم پرینه و از دست دادن خز در بافت اطراف آن. موش های دیگر به طور مشابه تحت درمان بودند و ivag با ۳ × ۱۰ PFU با HSV-1Q-GPF در ۱۰μL از RPMI آلوده، و طی زمان های ۱ ساعت، ۱۲ ساعت، و یا ۲۴ ساعت انجام شد. این ماده تلقیحی عفونی برای فعال کردن انتخاب شد.
رنگ آمیزی ایمونوفلورسانس
همانطور که ذکر شد، واژن در خارج از فرمالدئید و پارافین قرار داده شد و ۱۰μm از مقاطع بافتی بر روی لام ها قرار داده شدند و با غوطه وری سازی متوالی در ۱۰۰٪ زایلن، ۱۰۰٪ اتانول، ۹۶٪ اتانول، و آب استریل تحت درمان با DEPC پارافین زدایی شدند. بازیابی آنتی ژن با استفاده از ۱۰mM سدیم بافر سیترات (با pH 6.0) حاوی ۰.۰۵٪ از Tween 20 (هر دو سیگما آلدریچ) (۲۰ دقیقه در ۹۵ درجه سانتی گراد) انجام شد. پس از ۳ بار شستشو با PBS، یک شب با سرم ۱۰٪ نرمال (Abcam، کمبریج MA) در ۴ درجه سانتیگراد در محیط معتدل انکوبه شدند. بخش ها با DAPI رنگ آمیزی شده و با میکروسکوپ کانفوکال برای بیان نسبی پروتئین DSG1a (تعریف شده توسط محاسبه اعداد پیکسل در هر ۱۰۰ میکرومتر) با استفاده از نرم افزار ImageJ ارزیابی شدند.
نفوذ پذیری دستگاه تناسلی موش، از طریق تزریق ۱۰ میکرولیتر محلول PBS حاوی ۶۲.۵ میکروگرم از دکستران و ۵۰ میکروگرم از لوسیفر زرد، نمک لیتیم ((MW = 457.2 بررسی شد. بعد از ۴۵ دقیقه، موش، معدوم شده و واژن خارج شده، و بافت در فرمالدئید، آگارز تعبیه شدند و با DAPI رنگ آمیزی و توسط میکروسکوپ کانفوکال ارزیابی شدند.
تصاویر میکروسکوپ کانفوکال با اسکن متوالی برای بررسی متقاطع فلورسانس استفاده شذ. در مطالعات دیگر، موش های سینژنیک درمان نشده، معدوم شدند و طحال آنها برداشته و بصورت تک سلولی بررسی شدند. اسپلنوسیت با ۵ میکرومولار استر سوکسینیمیدیل کربوکسی فلورسین ( (CellTrace CFSEو نشاندار شده دوباره در PBS مخلوط شدند. این اسپلنوسیت فلوئورسانس در موش ivag بیهوش (قبلا از شروع درمان) نیز اجرا شد. پس از ۱۲ ساعت، موش ها معدوم شده و واژن آنها همانطور که در بالا اشاره شد ارزیابی گردید. تجزیه و تحلیل تصویر کانونی برای تعیین عمق ارتشاح لکوسیتی به بافت واژن انجام شد. پس از جمع آوری، بافت بیوپسی گردن رحم به صفحات استریل منتقل و ۴۵ دقیقه در ۲۰μL از PBS حاوی LY و DR در غلظت های مورد استفاده در مطالعات موش انکوبه شدند. به همین ترتیب، بیوپسی ثابت و جاسازی شده در آگارز برای بافت موش توصیف می شود. برای بررسی میکروسکوپی، اپیتلیوم مطبق، لامینا، و بافت همبند در هر نمونه ز بافت ectocervical تحت بزرگنمایی ۱۰۰X مشخص شد.
تصاویر در بزرگنمایی ۴۰۰X دست آمدند و به کمیت نفوذ LY به بافت ectocervical ارزیابی شد. برای بررسی میکروسکوپ نوری ثابت، بافت واژن پارافینیکیست موش برش داده شده و برای بررسی هماتوکسیلین پارافین زدایی شده و با ائوزین (H & E) رنگ آمیزی شد. میکروسکوپ نوری برای محاسبه ضخامت اپیتلیال (به استثنای لایه cornified) با ۵ رشته تصادفی (با ۵ اندازه گیری در هر زمینه) با استفاده از نرم افزار CellSens مورد استفاده قرار گرفت.
استخراج RNA
بافت انسانی بیوپسی ectocervical و بافت های واژن موش بلافاصله در ۱ میلی لیتر از RNAlater® غوطه ور شدند، بعد از ۲۴h ذخیره سازی در دمای ۴ درجه سانتی گراد به فریزر -۸۰ ° C منتقل شدند. RNA با استفاده از روش RNeasy لیپید بافت کیت (کیت Qiagen، هیلدن، آلمان) با استفاده از دستورالعمل تولید جدا شد، و دوباره در آب آزاد هسته مخلوط شد. RNA با استفاده از اسپکتروفتومتر نانودراپ (حرارت علمی) اندازه گیری شد (تمامی نمونه ها دارای نسبت۲۶۰/۲۸۰ تا ۱.۸۰ نمایش دادند).
محاسبه مدت زمان واقعی -PCR
برای تعیین بیان ژن نسبی، ۵۰ نانوگرم از RNA با TaqMan® RNA به-CT 1TM-مرحله کیت و پرایمر مناسب در یک حجم نهایی ۱۰μL بر سلول به خوبی و طبق دستورالعمل سازنده مخلوط شدند. qRT-PCR با استفاده از یک سایکلر حرارتی CFX96TM انجام شد و داده ها با استفاده نرم افزار مدیریت CFXTM (شرکت، هرکول CA) مورد آنالیز قرار گرفتند.
آنالیز آماری
تجزیه و تحلیل آماری با استفاده از نرم افزار (Prism 6 (GraphPad انجام شد. برای هر آزمایش، توزیع نرمال توسط آزمون آگوستینو و پیرسون با ارزیابی باقیمانده مورد آزمایش قرار گرفت (زمانی که تعداد نمونه آزمایشی کمتر از ۸ بود). وقتی که مقایسه بین ۲ گروه متفاوت و برای نمونه های جفت با استفاده از آزمون t مزدوج مورد مقایسه قرار گرفتند و نمونه های جفت نشده با استفاده از آزمون t مستقل جفت نشده مقایسه شدند. برای مقایسه چندگانه، از آنالیز واریانس ANOVA یکطرفه با آزمون تعقیبی دانت یا توکی برای توزیع پارامتری استفاده شد و برای توزیع ناپارامتری از آزمون Kruskal-Wallis با آزمون تعقیبی دان مورد استفاده قرار گرفت (به عنوان مثال، بسته به نوع توزیع داده ها). جهت مقایسه نمرات برای توسعه آسیب شناسی تناسلی، سطح زیر منحنی برای هر موش محاسبه و مقایسه گروه ها پس از آن انجام شد، که در بالا نشان داده شد. منحنی Kaplan-Meier و آزمون Log-rank برای مقایسه بروز بقا تجمعی بعد از ivag و عفونت HSV-2 استفاده شد. تجزیه و تحلیل رگرسیون خطی بین غلظت سرمی MPA و عمق نفوذ LY به بافت ectocervical انسانی (مقدار R گزارش شده و باقیمانده ارزیابی می شود) انجام شد. برای همه مقایسه ها p <0.05 بوده و از نظر آماری معنی دار در نظر گرفته شدند.

 بحث
بحث