دانشمندان UCLA با استراتژی جدیدی مؤفق به ایجاد سلولهای بالغ عضلانی از سلولهای بنیادی چندتوان انسانی گشتهاند. سلولهای بنیادی چندتوان میتوانند به انواع سلولهای بدن تمایز یابند. این یافتهها گام مهمی در راستای درمان بیماریهای عضلانی همچون دیستروفی عضلانی دوشن به روش جایگزینی با سلولهای بنیادی محسوب میشود. دیستروفی عضلانی دوشن تقریباً از هر ۵۰۰۰ پسر در ایالات متحده یکی را درگیر میکند. این بیماری از شایعترین بیماریهای ژنتیکی کودکان و نوزادان میباشد.
مطالعهی مذکور توسط April Pyle، دانشیار میکروبیولوژی، ایمونولوژی و ژنتیک مولکولی و عضو مرکز تحقیقات سلولهای بنیادی UCLA، در ژورنال Nature Cell Biology منتشر گردید. در واقع محققان با الهام از فرآیند تکامل طبیعی انسان، راهی برای ایجاد سلولهای عضلانی در آزمایشگاه یافتهاند؛ با این هدف که در نهایت بتوانند به فیبرهای عضلانی دارای قابلیت بازیابی دیستروفین دست یابند. دیستروفین پروتئینی است که در عضلات پسران مبتلا به دوشن وجود ندارد.
عضلات در صورت عدم وجود دیستروفین، تحلیل رفته و به طرز پیشروندهای دچار ضعف میشوند. علائم دوشن معمولاً در اوایل کودکی آغاز میشود؛ بیماران به تدریج تحرک خود را از دست داده و معمولاً در حدود ۲۰ سالگی، در اثر نارسایی قلبی یا تنفسی جان خود را از دست میدهند. دانشمندان سالها در صدد هدایت سلولهای بنیادی چندتوان انسانی به سمت ایجاد سلولهای بنیادی عضلانی بودهاند؛ سلولهایی که میتوانند در عضلهی زنده عملکرد مناسب داشته و فیبرهای عضلانی دارای دیستروفین ایجاد کنند. اگرچه نتیجهی مطالعهی Pyle بر آن بود که روشهای فعلی در این زمینه ناکارآمد بوده و طی آنها فقط سلولهای نابالغی حاصل میشود که برای شبیهسازی دوشن در آزمایشگاه و درمان بیماری مناسب نیستند.
مقالهی مرتبط: اولین دارو برای دیستروفی عضلانی دوشن تأیید شد
به گفتهی Pyle، این تیم طی مطالعه متوجه شد تنها ایجاد سلولی با نشانگرهای عضلانی در آزمایشگاه، به معنای داشتن عملکرد مدّ نظر نیست. برای پیشبرد درمان دوشن با سلولهای بنیادی، ابتدا باید درک کاملی از سلولهای آزمایشگاهی ایجاد شده با منشأ سلولهای بنیادی چندتوان در مقایسه با سلولهای طبیعی عضلانی داشت.
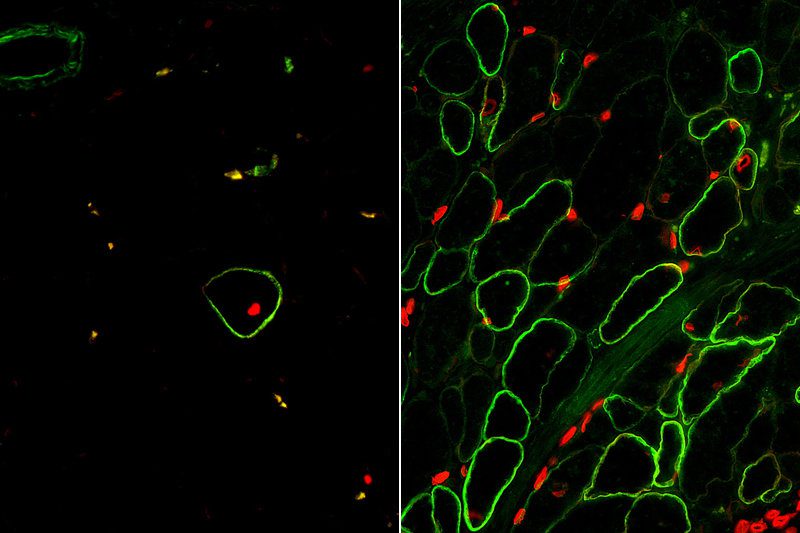
محققان با آنالیز تکامل انسانی، نوعی سلول عضلانی جنینی یافتند که توان تمایززدایی و بازسازی فوقعادی داشت. با تحقیقات بیشتر، دو نشانگر سطح سلولی جدیدی به نام ERBB3 و NGFR بر روی این سلولها شناسایی شد. این امر امکان جداسازی سلولهای عضلانی از بافتهای انسانی و انواع سلولهای ایجادشده از سلولهای بنیادی چندتوان انسانی را محقق ساخت. در پی جداسازی سلولهای عضلانی با استفاده از نشانگرهای تازه کشفشده، تیم تحقیق این سلولها را به منظور ایجاد فیبرهای عضلانی تولیدکنندهی دیستروفین، در آزمایشگاه کشت داد. فیبرهای ساخته شده از سلولهای عضلانی یکنواختی تشکیل یافته بود؛ اما همچنان نسبت به فیبرهای موجود در عضلهی واقعی انسان، اندازهی کوچکتری داشتند. Michael Hicks، سرپرست مطالعه، اذعان داشت:
ما جزء کلیدی دیگری را در نظر نگرفتیم؛ در واقع ما به عضلات بزرگتر و قدرتمندتر با قابلیت انقباض نیاز داریم.
سلولهای عضلانی جدا شده با نشانگرهای سطحی ERBB3 و NGFR در سمت راست که بازیابی دیستروفین انسانی به رنگ سبز را در پی داشته است. نتایج این روش را با روشهای قبلی در سمت چپ مقایسه کنید. امتیاز تصویر: مرکز تحقیقات سلولهای بنیادی UCLA
تیم مذکور برای یافتن پاسخ، بار دیگر مراحل تکامل طبیعی انسان را تحت مطالعه قرار داد. Hicks متوجه شد برای ایجاد فیبرهای عضلانی دارای پروتئینهای انقباضی، باید سلول خاصی که مسیر پیامرسانی TGF Beta را القا میکند، خاموش گردد. در نهایت این روش بر روی نمونهی موش مبتلا به دوشن، آزمایش شد.
به گفتهی Hicks، هدف نهایی این تحقیق، توسعهی نوعی روش درمانی شخصیسازی شده و مبتنی بر جایگزینی سلولی است؛ به این صورت که از سلولهای خود بیمار برای درمان پسران مبتلا به دوشن استفاده شود. از این رو، طی مطالعه همان مراحل اجرا شد. ابتدا سلولهای بیماران دوشن به سلولهای بنیادی چندتوان تبدیل شد. سپس محققان با استفاده از تکنولوژی ویرایش ژن CRISPR-Cas9، جهش ژنی عامل دوشن را حذف کردند. با استفاده از نشانگرهای سطحی ERBB3 و NGFR، سلولهای عضلانی جدا شده و همراه با مهارکنندهی TGF Beta به موش تزریق شد. نتایج دقیقاً طبق انتظار بود.
مقالهی مرتبط: ۱۰ دستارود شگفتانگیز ویرایش ژن CRISPR در طی چند سال گذشته
این مطالعه برای اولین بار نشان میدهد که میتوان سلولهای عضلانی عملکردی را در آزمایشگاه ایجاد کرده و با الهام از فرآیند تکامل انسانی، دیستروفین را در مدلهای حیوانی دوشن بازیابی کرد.