درست مانند این که کسی گزینهی ویرایش سریع را در ژنها فعال کرده باشد. ابزاری دست دانشمندان افتاده که با آن میتوانند DNA را ترمیم کرده و به پیشرفتهایی در درمان و پیشگیری از بیماریها برسند.
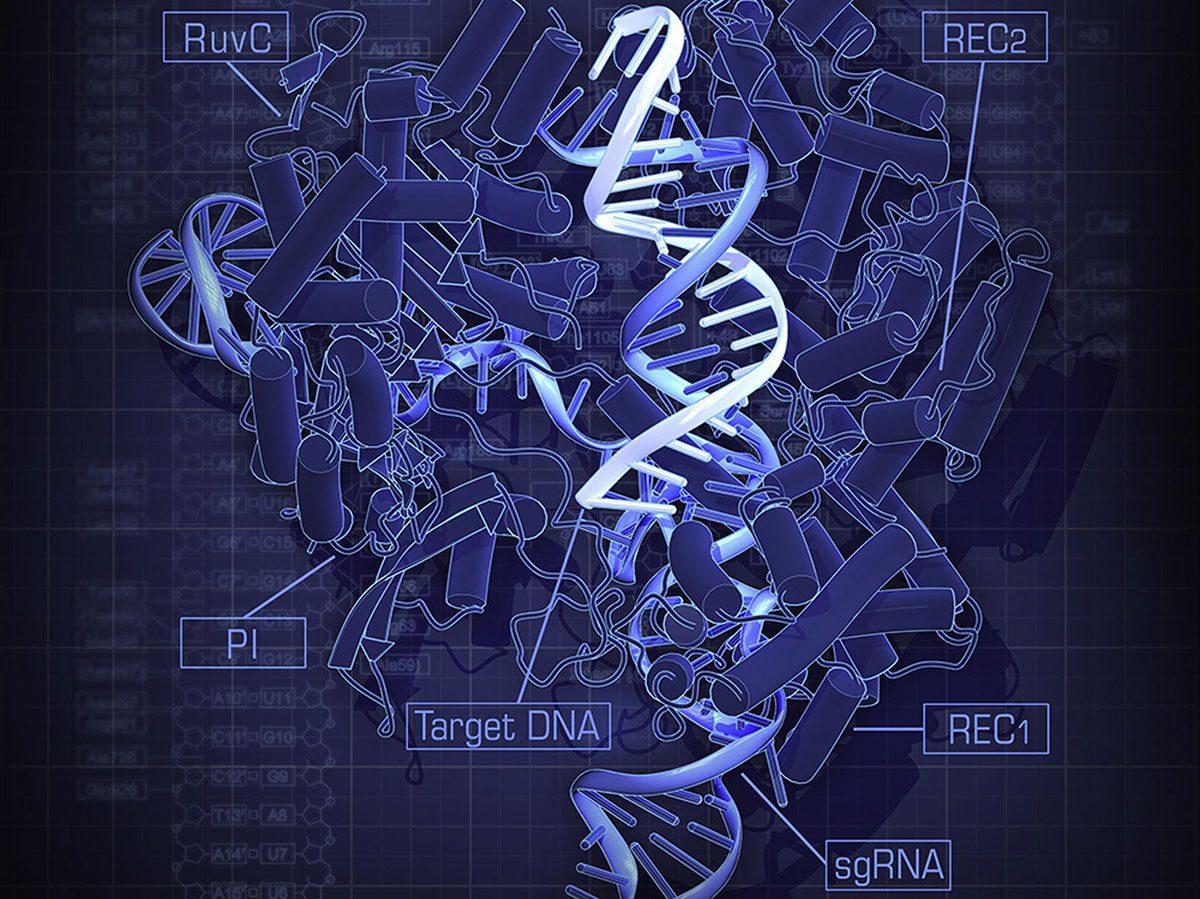
یافتهها یکی پس از دیگری نمایان میشوند. دانشمندان هر روز نتایج مطالعات خود را با استفاده از روشی به نام CRISPR-Cas9 منتشر میکنند. این ابزار با نام مخفف CRISPR برای اولین بار در سال ۲۰۱۱ شناسایی شد و دانشمندان توانایی آن را در برش DNA مشاهده کردند. CRISPR از یک پروتئین و یک RNA تشکیل شده است. دانشمندان از آن برای بریدن رشتههای DNA در محلهای بسیار دقیق استفاده میکنند تا قسمتهای جهشیافته را جدا نمایند.
تنها در سال گذشته، بیش از ده تحقیق در سراسر جهان منتشر شد که نتایج را شرح میدادند؛ برخی امیدوارکننده و برخی هم منتقدانه. آنها DNA را برش داده بودند تا برای سرطان، HIV، نابینایی، درد مزمن، تحلیل عضلانی و بیماری هانتینگتون درمانی پیدا کنند. با این حال چند سال زمان لازم است تا بتوان درمانی بر پایهی CRISPR برای انسانها پیدا کرد. تقریباً روزی را نمیتوان پیدا کرد که یافتهای جدید دربارهی سلامت و ژنتیک انسان منتشر نشود که مزیتهای این کار را نشان دهد.
البته که این ابزار برای استفادهی انسان آفریده نشده. CRISPR در جانوران و گیاهان کارکرد دارد. از ناتوان کردن انگلهایی نظیر مالاریا و لایم گرفته تا بهبود کشتوکار سیبزمینی، مرکبات و گوجهفرنگی از جمله کارهایی است که در ادامه بیشتر راجع به آنها حرف خواهیم زد. این ابزار به طرز باورناپذیری قدرتمند است. هماکنون شاهد انقلابی هستیم که CRISPR در لابراتوارها ایجاد کرده.
میتوان امیدوار بود که این ابزار در دههی آینده از آزمایشگاهها بیرون بیاید و به درمانهای کلینیکی تبدیل شود. در ادامه به ۱۰ بیماری اشاره خواهیم کرد که ظرفیتهای CRISPR را به نمایش میگذارد و مشتی است نمونهی خروارهای آینده.
سرطان
علاج سرطان نوع بشر را از زمان باستان به خود مشفول کرده است، از زمان بقراط که بین سالهای ۴۶۰ تا ۳۷۰ پیش از میلاد میزیست تا همین امروز. اون نام کارکینوس (karkinos) را برای این بیماری انتخاب کرد به معنای خرچنگی غولپیکر! چون سرطان اساساً بیماریای ژنتیکی است پس میتوان درمانهایی با CRISPR برای آن تدارک دید که سرعت گسترش تومور را کند و یا حتی آن را برعکس کند.
برخی کارها هماکنون در چین در حال انجام است؛ چون قوانین ویرایش ژنی روی انسان در این کشور به سفتوسختی این قوانین در ایالات متحده نیست. در اکتبر ۲۰۱۶، ژورنال Nature گزارش کرد که بیماری چینی با سرطان ریه اولین فردی از ۱۰ نفر کنونی است که تزریقی از سلولهای تغییریافته با CRISPR دریافت کرده. محققان به سرپرستی دکتر لو یو سلولهای ایمنی خود بیمار را طوری تغییر داده بودند تا پروتئینی (PD-1) را که پاسخ ایمنی سلول را تضعیف میکند و به سلولهای سرطانی اجازهی تکثیر میدهد، دیگر نسازند.
مقالهی مرتبط: روش اصلاح ژنی CRISPR–Cas9 برای اولین بار روی انسان آزمایش شد
تیم محققان آمریکایی هم بیکار ننشستهاند. دکتر Carl June از دانشگاه پنسیلوانیا و همکارانش ژوئن سال گذشته مجوز مؤسسهی ملی سلامت این کشور را برای شروع کارآزمایی بالینی روی ۱۸ بیمار مرحلهی نهایی با بیماریهای ملانوما (نوعی سرطان پوست)، سارکوما (سرطان بافت نرم) و میلومای چندگانه (سرطان مغر استخوان) گرفتند. برای این کارآزمایی دانشمندان از CRISPR برای ویرایش ۳ ژن در سلولهای ایمنی استفاده خواهند کرد و امیدوارند تا این سلولها بتوانند سلولهای سرطانی را نابود کنند.
HIV
ریشهکنی HIV، ویروس عامل نقص ایمنی اکتسابی انسان یا همان ایدز، به مبارزهای دشوار بدل شده. نه تنها این ویروس سلولی را در بدن هدف قرار میدهد که کارش هدف قرار دادن ویروسهاست، بلکه این ویروس جهشگر ماهری نیز میباشد! پس از سلولربایی (!) این ویروس طوری خودش را تغییر میدهد که هدف قرار دادنش بسیار سخت میشود و مقاومت دارویی پدید میآید. این مقاومت مشکلی عظیم در درمان بیماران مبتلا به HIV میباشد.
شاید CRISPR بتواند از پس HIV برآید. در می ۲۰۱۷، محققان دانشگاههای تمپل و پیتزبورگ با استفاده از این روش ویروسهایی که سلولها را آلوده کرده بودند، برش داده و توانایی آنها را برای همانندسازی گرفتند. این روش که در سه مدل جانوری آزمایش شده اولین موردی است که عفونت HIV را از درون سلولها پاکسازی میکند. نتایج این مطالعه در ژورنال Molecular Therapy منتشر شد.
بیماری هانتینگتون
تقریباً ۳۰۰۰۰ نفر در ایالات متحده نوعی عارضهی ارثی به نام بیماری هانتینگتون دارند که به تخریب اعصاب در طول زمان انجامیده و موجب مرگ میشود. نشانههای آن شامل تغییرات شخصیتی، نوسانات خلق و خو، راه رفتن غیرپایدار و تکلم نامفهوم و بدون کنترل است.
مقالهی مرتبط: بیماری هانتینگتون
این عارضه در نتیجهی ژنی معیوب که میزان بیش از حد پروتئینی به نام همین بیماری را میسازد، به وجود میآید. پروتئین هانتینگتون سپس به قطعات کوچک و سمی تقسیم شده و درون نورونها انباشته میشود. این تجمع عملکرد سلولهای عصبی را مختل خواهد کرد.
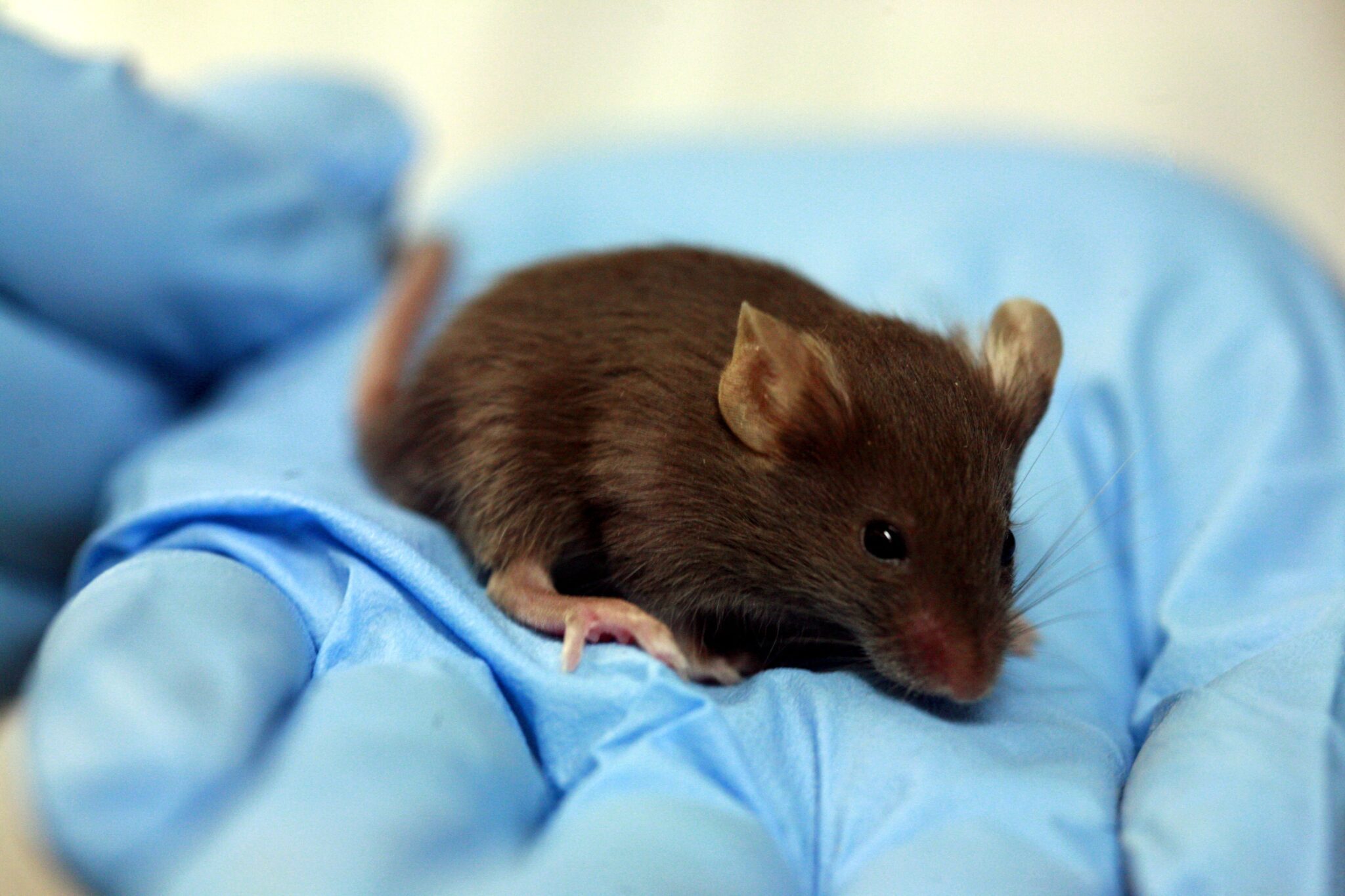
ژوئن ۲۰۱۷، دانشمندان در The Journal of Clinical Investigation اعلام کردند که توانستهاند این بیماری را در موشهای آزمایشگاهی معکوس کنند. این موشها با مهندسی ژنتیک به جای ژن هانتینگون خود، ژن هانتینگتون معیوب انسانی را داشتند. آنها با استفاده از CRISPR قسمتی از ژن معیوب را که قطعات سمی تولید میکند برش دادند.
پس از انجام این کار، شمار قطعات سمی در مغز موشها کاهش پیدا کرد و ترمیم نورونها شروع شد. موشهای بیمار برخی از تواناییهای کنترل عضلانی، تعادل و گرفتن اشیای خود را بازیافتند. با این که عملکرد آنها در برخی مهارتها به خوبی موشهای سالم نبود، نتایج پتانسیل این ابزار را برای درمان هانتینگتون اثبات کرد. در بیانیهای، دانشمندان اعلام کردند که قبل از ایجاد روشی درمانی برای انسانها به مطالعاتی دقیق نیازمند اند.
دستروفی عضلانی دوشن
این ناتوانی عضلانی بر اثر جهش ژنی واحد به نام دیستروفین که یکی از بلندترین ژنهای بدن است اتفاق میافتد. بخاطر جهش در ژن دیستروفین، بدن نمیتوان پروتئین دیستروفین دارای عملکرد بسازد که برای سلامت فیبر عضلانی ضروری است. در طول زمان به دلیل نبود این پروتئین، دژنراسیون پیشروندهی عضلانی و ضعف پیش میآید.
در آوریل ۲۰۱۷، مقالهای در ژورنال Science Advances منتشر شد که در آن توضیح داده میشد چگونه محققان با ابزار متفاوتی از CRISPR به نام CRISPR-Cpf1 این بیماری را تصحیح کردهاند. آنها این ژن را در سلولهای انسانی رشد یافته در آزمایشگاه و موشها ترمیم نموده بودند.
CRISPR-Cpf1 نیز در نوار ابزار ویرایش ژن گزینهی دیگری است. تفاوت این سیستم با CRISPR-Cas9 در اندازهی کوچک آن است که قدرت ورود به سلولهای عضلانی را به آن میدهد. همچنین این ابزار توالی دیگری از DNA را نیز میشناسد که ویراش ژن طولانی دیستروفین را امکانپذیر مینماید.
پیشگیری از نابینایی
یکی از شایعترین دلایل نابینایی در کودکی عارضهای به نام Leber congenital amaurosis است که ۲ یا ۳ نفر از هر ۱۰۰۰۰۰ کودک تازهمتولد را مبتلا میکند. این عارضه ارثی است و بر اثر جهش در ۱۴ ژن مسئول دید اتفاق میافتد.
شرکت Editas، بیوتک ماساچوست، کمبریج روی درمانی بر پایهی CRISPR کار میکند تا نوعی از این بیماری را درمان نماید. این شرکت قصد دارد هماهنگیهای لازم را با سازمان غذا و دارو انجام دهد تا مقدمات کارآزمایی بالینی روی انسان را تدارک ببیند.
شرکت Editas با همکاری فنگ ژانگ بنیانگذاری شده است؛ او پروفسور مهندسی ژنتیک در MIT و کسی است که نشان داد میتوان از CRISPR-Cas9 در سلولهای انسانی استفاده کرد. جنیفر دودنا از دانشگاه کالیفرنیا، برکلی و امانوئل چارپنتیر از دانشگاه وین نیز چنین ادعایی کرده و پتنت این تکنولوژی را در ۲۰۱۲ ثبت نمودند. مؤسسهی Broad که جزوی است MIT است پتنت خود را در آوریل ۲۰۱۴ ارسال کرد و با پیگیری سریع نهایتاً آن را گرفت. پتنت مؤسسهی Broad بالاخره پس از آن که دانشگاه کالیفرنیا، برکلی در دادگاه به نفع دودنا طرح دعوی کرد، در فوریهی ۲۰۱۷ تأیید شد.
درد مزمن
درد مزمن بیماری ژنتیکی ارثی نیست ولی دانشمندان در صددند تا با روش CRISPR درد مفصلی را با تغییر در ژنها و کاهش التهاب برگردانند. در شرایط معمولی التهاب راهی است تا با آن سیستم ایمنی متوجه مشکل شده و آن را حل کند ولی در التهاب مزمن این فرآیند مضر شده و نهایتاً به دردی ناتوانکننده میانجامد.
در مارس ۲۰۱۷، تیمی از محققان به رهبری استادیار مهندسی ژنتیک، Robby Bowles از دانشگاه یوتا گزارش کردند که با استفاده از CRISPR توانستهاند از تولید مولکولهایی که برای تجزیهی بافت و التهاب هستند پیشگیری کنند. این تکنیک میتواند برای به تأخیر انداختن تخریب بافتی پس از جراحی به عنوان نمونه مورد استفاده قرار گیرد. این پیشرفت به تسریع التیام و کاهش نیاز به جراحیهای اضافی به منظور ترمیم آسیب بافتی کمک میکند.
بیماری لایم
Kevin Esvelt، زیستشناس تکاملی MIT، میخواهد آثاری از بیماری لایم نماند. این بیماری با باکتریهای کنهزادی که میتوانند پخش شوند به وجود میآید. اگر بدون درمان رها شود، التهاب مفصل، درد عصبی، ضربان قلب، فلج صورت و دیگر مشکلات اجتنابناپذیر خواهد بود.
مقالهی مرتبط: بیماری لایم
با این که باکتری عامل لایم توسط کنه به انسان منتقل میشود ولی این کنهها از اول که باکتری را ندارند. کنههای جوان هنگام تغذیه آلوده میشوند؛ اغلب وقتی روی تن موشهای پا سفید هستند این اتفاق میافتد. Esvelt در نظر دارد با ایمن کردن این موشها از بدو تولد نسبت به باکتری از انتقال آن به کنهها جلوگیری نماید. در ژوئن ۲۰۱۶، Esvelt راهحل خود را به دو جزیره که آمار این بیماری در آنها بالاست عرضه کرد و قرار است این کار را آنجاها انجام دهد ولی این کار قطعاً به چند سال زمان نیاز دارد.
مالاریا
مالاریا هر ساله صدها هزار نفر را به کام مرگ میبرد. در سال ۲۰۱۵، آخرین سالی که سازمان جهانی بهداشت آمارگیری انجام داد، ۲۱۲ میلیون مورد ابتلا به مالاریا و تقریباً ۴۲۹۰۰۰ مرگ بر اثر آن وجود داشت.
برای حمله به قلب معضل، تیم تحقیقی در کالج سلطنتی لندن در صدد کاهش جمعیت پشههای انتقالدهندهی بیماری هستند. برنامه کلی این است: تغییر پشههای نر به صورتی که بیشتر باعث به وجود آمدن پشههای همجنس خود شوند و تغییر در پشههای ماده برای کاهش باروری آنها.
در ماه پایانی ۲۰۱۵، گزارش این محققان در ژورنال Nature منتشر شد؛ آنها ۳ ژن در رابطه با کاهش باروری پشههای ماده یافته بودند. همچنین آنها توانسته بودند یکی از این ۳ ژن را با CRISPR هدف قرار دهند.
محصولات
درست مانند کاری که CRISPR میتواند روی حیوانات انجام داده و ژنوم آنها را تغییر دهد، این کار روی گیاهان هم انجامشدنی است. محققان روی قابلیت این ابزار برای مهار بیماریها در گیاهان کار میکنند.
برای مثال میتوان استفاده از این تکنیک برای حذف ژنهای بیماریزا از برخی سیبزمینی و گندمها را مثال زد. همچنین گوجهفرنگیهایی پرورش داده شده که شاخههای آنها قدرت کافی را برای نگه داشتن گوجههای رسیده داشته باشند. در کالیفرنیا نیز چندین آزمایشگاه در پی از بین بردن باکتری عامل سبز شدن مرکبات هستند.
ویرایش رویان انسان
سرعت رشد این تکنیک عجیب و غریب است. آزمایشهایی که قبلاً ماهها زمان میبرد الان در عرض چند هفته تمام میشود. این سرعت، علیالخصوص وقتی به بحث آزمایش CRISPR روی انسان میرسیم برای سیاستگذاران کمی نگرانکننده است.
در فوریهی ۲۰۱۷، دانشمندان National Academies of Sciences, Engineering and Medicine اظهارنظری دربارهی ویرایش ژنهای انسان ارائه دادند؛ ویرایش ژنهای انسان فقط تحت برخی شرایط قابل قبول است. تغییر سلولها در رویان، تخم یا اسپرم ار لحاظ اخلاقی فقط زمانی مجوز دارد که برای تصحیح بیماری یا معلولیت باشد، نه برای بهبود ظاهر فیزیکی یا تواناییهای ظاهری.
مقالهی مرتبط: اصلاح بحثبرانگیز ژنهای جنین انسان؛ نکاتی که باید بدانید
هیچ محققی در ایالات متحده از CRISPR برای تغییر رویان انسان زندهماندنی استفاده نکرده ولی خبرهایی از چین رسیده است. دانشمندان این کشور با استفاده از روش CRISPR-Cas9 جهشهای بیماریزا را از رویان انسان خارج کردهاند. این مطالعه برای اثبات امکانپذیر بودن چنین عملی روی رویان انسان انجام شده و رویان مورد نظر رشد داده نشده است.
برای اطلاع بیشتر و جزئیتر دربارهی تکنیک ویرایش ژنی CRISPR-Cas9 میتوانید مقالهی کامل این روش را در دکتر مجازی بخوانید.