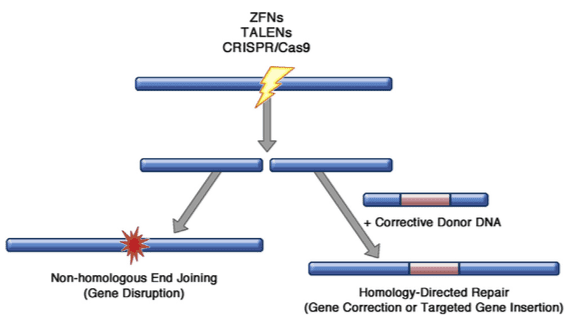
بازشناسی پدیدههای اصلاح ژن با ایجاد برشی دقیق در DNA کروموزومی در نزدیکی پایگاه اصلاح ژن، میتواند تا حد زیادی افزایش یابد. اندونوکلئاز طراحی شدهی جانشین جایگاه مخصوص، تولید شده است، که شامل هدفیاب اندونوکلئازها(homing)، zink finger nucleases (ZFN) ، افكتور نوكلئازهای شبه فعال کننده رونویسی (TALENها) و مهمتر از همه CRISPER/Cas9 است. هرکدام از این سیستمها میتوانند مهندسی شوند تا محل شکاف DNA را در یک پایگاه ذاتی خارج از کل ژنوم تشخیص داده و تولید کنند. اگر شکاف DNA باقی بماند تا توسط خود سلول حل شود، اغلب اوقات از طریق فرایندی به نام اتصال پایانی غیر همولوگ انجام میگیرد. این کار اغلب با اضافه کردن یا برداشتن چند جفت پایه در پایگاه شکست است که منجر به قطع در چارچوب خواندن و خاموشی ژن میشود. با این حال، اگر سلول همزمان با کپیهای توالی هدف بصورت DNA تک رشتهای یا دو رشتهای که حامل توالی اصلاح کننده DNAاند، تامین شود، ممکن است از اطلاعات تولید شده استفاده کند تا شکست را با ترمیم مستقیم همولوگ، حذف توالی اصلاح کننده و بازسازی جهش پاتوژنیک جبران کند. این پروسه ترمیم مستقیم همولوگ حتی میتواند برای تولید کاستهای ژن جدیددر پایگاه دقیق هدف استفاده شود؛ مانند یک کپی کامل و نرمال از ژن معیوب دقیقا در پایینتر از توالی پروموتور برای نگهداری الگوی بیان نرمال ژن.
اصلاح ژن با استفاده از اندونوکلئاز جایگاه خاص.
این روشهای ویرایش ژن بصورت بالینی اثبات شدهاند، در اولین مطالعه ZFN برای از بین بردن کورسپتور HIV CCR5 در Tcell خونی محیطی در بیمار آلوده به HIV، سلولهاس مشابه مقاوم به آلودکی HIV ارائه شد. سایر مطالعات نزدیک به آزمایشات بالینی به دنبال حذف ژن CCR5 در HSC بیماران آلوده به HIV و یا حذف ژن کد کنندهی یک پروتئیناند. سرکوب بیان گلوبولین جنینی برای تبدیل به هموگلوبین جنینی به عنوان راهی برای درمان تالاسمی b و بیماری سلول داسی شکل است. اصلاح ژن در HSCها برای بیماریهای PID در مطالعات پیش بالینی برای X-SCID، ADA-SCID، X-CGD ، X-HIM و…نشان داده شده است.این روشها در حال رسیدن به مراحل بهینهگی و غیرسمی بودن برای HSCها هستند که منجر به اثربخشی بالینی است. فرایندهای اصلاح ژن ممکن است امکان درمان طیف گستردهای از PIDها را با ژن درمانی و پیوند اتولوگ فراهم کند؛ از جمله : X-linked agammaglobulinemia (XLA)، X-HIM، IPEX، CVID و…
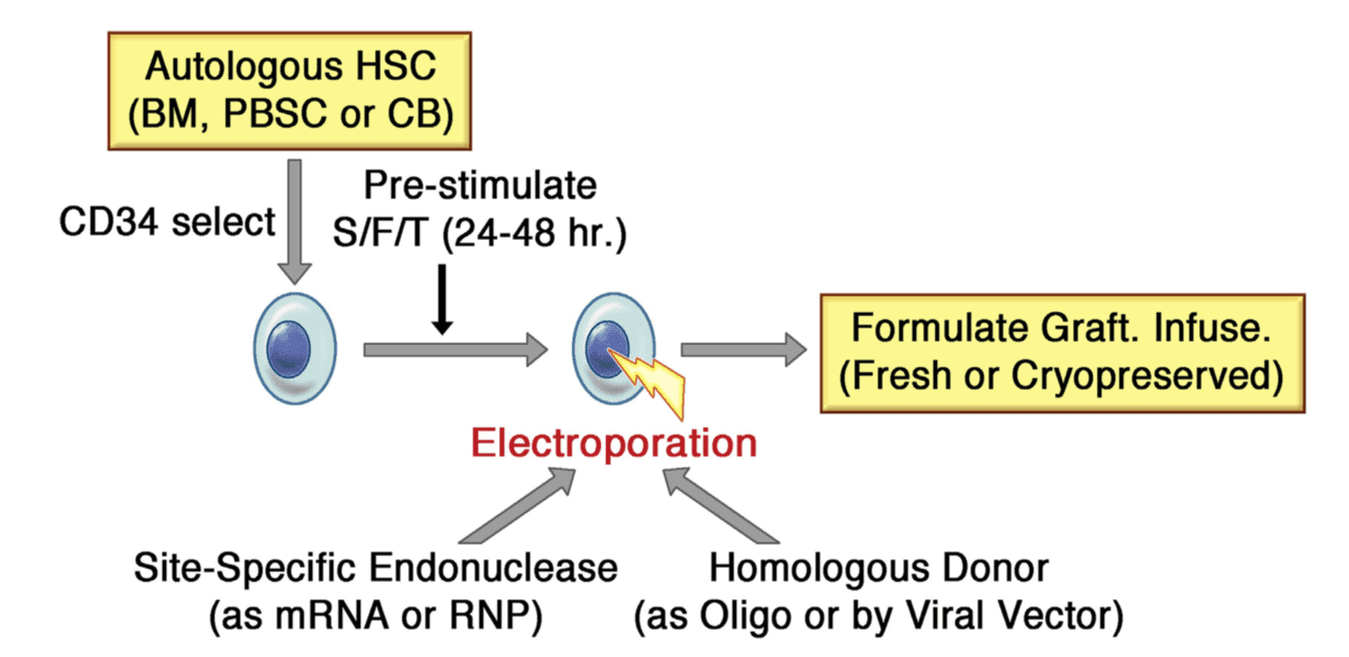
ویرایش محل اختصاصی ژن در HSC اتولوگ برای ژن درمانی PIDها. HSCهای اتولوگ میتوانند از مغز استخوان جدا شوند، سلولهای خونی بنیادی در محیط (PVSC) و با خون بند ناف (CB) را تجهیز کنند. معمولا HSCها در انتخاب ایمنی CD34ها غنی میشوند. HSCها از پیش تحریک میشوند تا تغییر ژن را بهبود ببخشند به این معنی که ۲۴-۴۸ ساعت در محیط کشت آزمایشگاه با ترکیبی از فاکتورهای رشد نوترکیب، مثل c-Kit ligand/Flt-3 ligand و ترومبوپوئیتین (S/F/T). سپس سلولها به elec-troporation با اندونوکلئاز جایگاه مخصوص درمان میشوند. سپس سلولها با الکتروپوریشن و با اندونوکلئاز مخصوص جایگاه (ZFN، homing endonuclease, TALEN و یا CRISPR) برای ایجاد یک شکست دو رشتهای در ژن هدف و همچنین انتقال به شکل mRNA رونویسی شده در آزمایشگاه یا ریبونوکلئوپروتئین از قبل شکل گرفته (RNP) درمان میشوند. (ریبونوکلئوپروتئین حاوی پروتئین Cas9و RNA short-guide برای فرایندهای CRISPR است) همولوگ اعطایی شامل توالی اصلاح کننده میتواند به شکل الیگونوکلئوتید (Oligo) که با اندونوکلئاز کوالکتروپوریت شده و یا در غالب یک وکتور ویروسی باشد. ( به عنوان مثال؛ ویروس وابسته به آدنو یا وکتور لنتیویروس معیوب در ادغام) بعد از الکتروپوریشن، HSC اصلاح شدهی ژنی برای نمایش داخل وریدی فرموله شده و همچنین میتواند بصورت تازه یا به بیمار تزریق
علاوه بر تمام PIDهای مبتنی بر سلول مه بالا بحث شد، PID های دیگری نیز در اثر نقص پروتئینهای خونی اتفاق میافتد، مانند: angiodema. مطالعهای اخیرا تحقیقاتی درباره angioedema ارثی در مدل موشی را توصیف کرد که در آن وکتور ویروسی متفاوتی، ویروس وابسته به آدنو، استفاده شده بود تا ژن SERPING1 کدکنندهی، مهارکننده C1 را در سلول کبد تولید کند، که پس از میتواند مانند یک کارخانه عمل کرده تا پروتئین تولید کند و آن را به جریان خون بریزد. این فرایند کارخانه پروتئین برای ADA-SCID نیز موثر دیده شده است. در مدل موشی یک LV حامل ژن نرمال ADA انسانی بصورت داخل وریدی تزریق شده بود، که هدف آن کبد بود و به عنوان یک منبع ADA کافی برای تامین بقا و تصحیح ایمنی است. فرایندهای مشابه تحت مطالعه فعال برای بیماریهای پروتئینی غیر PIDاند، مثل: هموفیلی، نقص مهارکننده آنتی تریپسین و…
مقالات مرتبط: رویکردهای آینده و دورنمای ژن درمانی PID
ژن درمانی بیماریهای نقص ایمنی
چالشهای باقی مانده ژن درمانی PID
مسلما چالشهایی وجود دارد که کاملا برطرف نشدهاند. تولید وکتورهای افزاینده ژن و یا معرفهای اصلاح ژن مقیاس نسبتا کوچکی برای مطالعات پایلوتاند و برای روشهای تولید دارویی در مقیاس کافی برای درمان بیماران نیاز به پیشرفت دارند. افزودن ژن با SIN LVها و اصلاح ژن با اندونوکلئازهای گوناگون اگر ژنهای مهم را با افزودن ژن هدف یا برش آن مختل کنند، کماکان ریسک سمیت ژنتیکی دارند.
رژیمهای تهویه که تا به امروز استفاده شدهاند براساس رزیمهای شیمی درمانی بودهاند. با اینکه آنها در زمان اندک سمیتی نشان ندادهاند، اما حتی در دوزهای کم هم میتوانند عوارض بعدی داشته باشد. بار دیگر، پیشرفت در این زمینه ضروری با روش «ایجاد فضا» برای پیوند ژن اصلاح شدهی HSC با استفاده از mABها روی پروتئینهای HSC، مثل c-Kit یا CD45، صورت گرفته است. اگر این عوامل تهویه جدید موثر باشند میتوانند تا حد زیادی امنیت را افزایش دهند و امکان انجام اعمال ژندرمانی برای PIDهای خفیفتر چون XLA را ایجاد میکنند.
با اینکه روشهای فعلی افزودن ژن و اصلاح ژن بصورت ex vivo با مغز استخوان خارج شده و یا سلولهای بنیادی تجهیز شده صورت گرفتهاند، زمانیکه امکان انتقال ژنهای مورد نیاز یا ریجنتسهای اصلاح ژن به درون ارگانیسم زنده امکان پذیر شود، HSC ها در مكان اصلی خود ترمیم میشوند. نهایتا، استفاده از سلولهای بنیادی پرتوان القایی مثل سلولهای بنیادی پرتوان تحریک شده ممکن است به سلولهای اتولوگ پیوندزده شده اجازه تولید، اصلاح ژن، گسترش و استفاده در پیوند را با منبع بیشتر از سلولهای بنیادی تامین کننده بازسازی ایمنی بهتر بدهد.
این فرصتی هیجان انگیز برای علم و فرصتی خوب برای بیماران است زیرا این درمانهای جدید استفاده شده در ژن درمانی میتوانند روشهای با امنیت بیشتر و موثرتر ایجاد کند که از عوارض HSCT آلوژنیک اجتناب میکند. البته چندین سال برای تعیین بهترین روش آنالیزهای مقایسهای نیازمند است، اما وجود درمانهای گوناگون برای بیماریهایی که اغلب مرگبار بوده است، واقعا لذت بخش است.