پس از ذکر مقدمه و تاریخچه مختصر درباره اپتوژنتیک، در این بخش اپسین ها را مورد بررسی قرار خواهیم داد. البته از اپسینهای مورد استفاده در اپتوژنتیک، کمی فراتر خواهیم رفت.
مقاله مرتبط: مقدمه ای بر اپتوژنتیک؛ بازی نور و ژنتیک
مقاله مرتبط: مروری مختصر بر تاریخچه اپتوژنتیک
مکانیسمهای ظریف و متنوعی بمنظور توانا ساختن ارگانیسمهای مختلف در جذب نور، تکامل یافتهاند که اهداف عملکردی متفاوتی را محقق میسازند؛ از این اهداف میتوان به تولید انرژی و تشخیص موقعیت مناسب اشاره کرد. دسته بزرگی از پروتئینهای حساس به نور، از رودوپسینهایی که توالی آمینواسیدی آنها هفت بار از غشا عبور میکند (۷-transmembrane(TM) rhodopsins)، تشکیل شدهاست. این رودوپسینها در اعضای تمامی قلمروهای حیات یافت شده و در ایجاد عملکردهای مختلفی دخیل هستند. بسیاری از پروکاریوتها از این پروتئینها بمنظور کنترل شیب پروتونی، ثبات پتانسیل غشا و هومئوستاز یونی بهره میبرند. بسیاری از میکروارگانیسمهای متحرک نیز از فوتورسپتورهایی بر پایه اپسین برای تنظیم حرکت تاژک یا چرخش آن و هدایت فوتوتاکسی (phototaxis) به سمت شدتهای بهینه نور برای فتوسنتز، استفاده میکنند.
بدلیل ساختار غیر پیچیده و عملکرد سریع اپسین های میکروبی، این پروتئینها میتوانند بعنوان اجزای حساس به نور که دقیق و قابل تنظیم هستند، به سلولهای غیر حساس به نور بمنظور اعمال کنترل سریع نوری بر فرآیندهای خاص سلولی، وارد شوند. در سالیان اخیر با تکامل ابزارهای دستکاری سلولی که بر پایه این پروتئینها و دیگر پروتئینهای حساس به نور استوار هستند، تکنولوژی به نام اپتوژنتیک ظاهر شدهاست که به ادغام ژنتیک و کنترل نوری بر عملکردهای سلولی اشاره دارد.
استفاده از اپتوژنتیک در مطالعات تجربی باعث ارتقای کیفیت بررسیهای گسترده ژنومی و بکارگیری مهندسی مولکولی وسیع بمنظور دستیابی به ابزارهای مطالعاتی و ایجاد سطوح جدید عملکردی شدهاست؛ تمامی این رخدادها در نهایت باعث تسریع روند بررسیها دربارهی پروتئینهای میکروبی همچون چنلردوپسینها (ChRs) شد.
هر پروتئین اپسین نیازمند همراهی رتینال، یک کوفاکتور ارگانیک که بر پایه ویتامین A بوده و فوتون جذب میکند، بمنظور کسب ویژگی حساسیت به نور است. ترکیب اپسین-رتینال، تحت عنوان رودوپسین شناخته میشود. مولکول رتینال با پیوند کووالانسی به ناحیهای در میان هلیکسهای ۷-TM متصل میشود که تشکیل یک پایه رتینال پروتونه (RSBH+) و یک توالی متشکل از آمینواسید لایزین (Lys) بر روی هلیکس هفتم (TM7) را در پی دارد.
ژنهای اپسین به دو ابرخانواده مجزا تقسیم بندی میشوند: اپسینهای میکروبی (نوع ۱) و اپسینهای حیوانی (نوع ۲). با اینکه هر دو خانواده اپسین، ساختارهای هفت بار عبوره از غشا را کد گذاری میکنند، هومولوژی در توالی آنها عملا وجود ندارد؛ با این حال، هومولوژی در میان اجزای هر یک از این دو خانواده، بالا است (۲۵ تا ۸۰ درصد تشابه توالی).
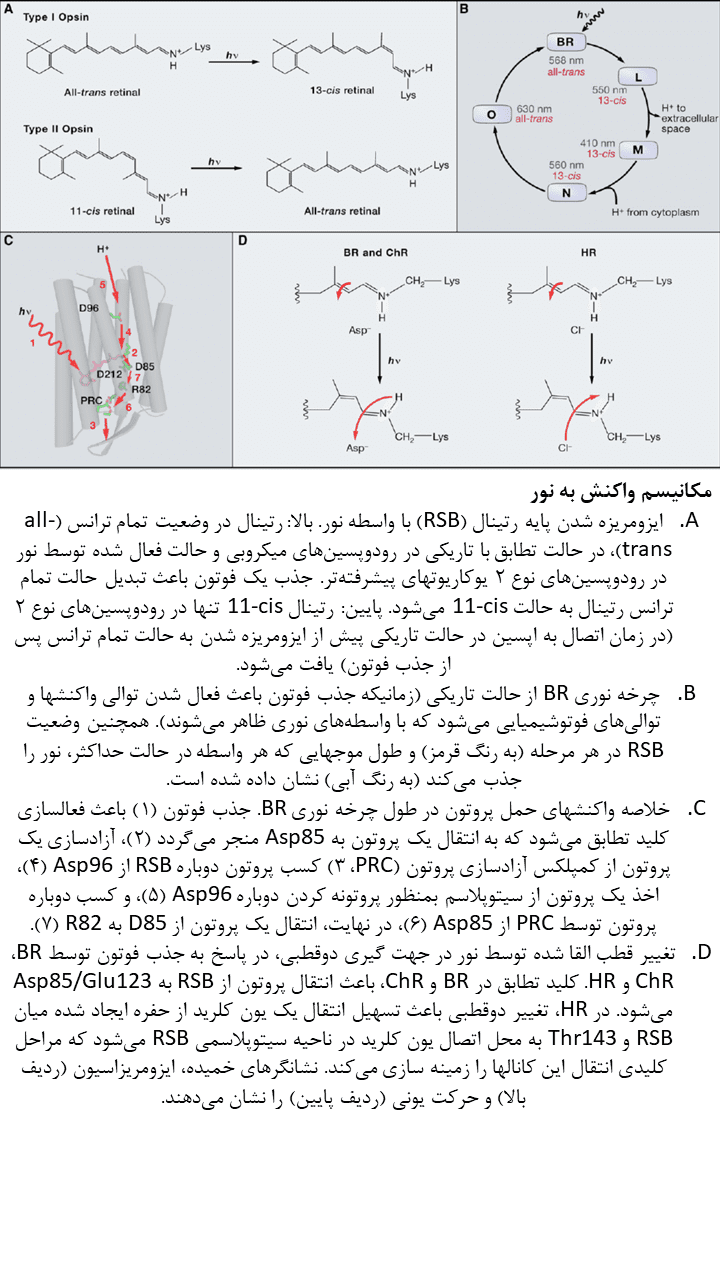
ژنهای اپسین نوع ۱ در پروکاریوتها، جلبک و قارچ یافت شده و عملکردهای متنوعی از جمله فوتوتاکسی، ذخیره انرژی، تکامل و بیوسنتز رتینال را کنترل میکند. اپسینهای نوع ۱، از ایزومر تمام ترانس (all-trans) رتینال بهره میبرند. این ترکیب با جذب فوتون، به حالت ۱۳-cis ایزومریزه میشود. مولکول رتینال فعال شده در رودوپسینهای نوع ۱، با جزء پروتئینی اپسین خود مرتبط باقی مانده و با حفظ پیوند کووالانسی، در معرض حرارت به حالت تمام ترانس بازمیگردد. این واکنش برگشت پذیر بصورت سریع رخ میدهد و برای قادر ساختن رودوپسین میکروبی بمنظور تنظیم فعالیت عصبی در فرکانس بالا بهنگام استفاده از آن بعنوان ابزار اپتوژنتیکی، ضروری است.
بصورت تصادفی، مغز پستانداران و در واقع بافتهای مهرهداران، حاوی سطوح کافی رتینال است؛ پس رتینال اضافی برای کسب کنترل اپتیکی بر این بافتها، مورد نیاز نیست.
اپسینهای نوع ۲
در مقابل، ژنهای اپسین نوع ۲ تنها در یوکاریوتهای پیشرفته یافت میشود و اساسا مسئول بینایی هستند. دسته کوچکی از اپسینهای نوع ۲ در ریتم سیرکادین و تنظیم رنگدانهای، نقش ایفا میکند. اپسینهای نوع ۲ در اصل بعنوان رسپتورهای مرتبط با پروتئین G (GPCRs) عمل میکنند و بنظر میرسد تمامی اعضای این گروه، از ایزومر ۱۱-cis رتینال یا مشتقات آن برای جذب فوتون بهره میبرند. بهنگام تابش نور، رتینال ۱۱-cis به حالت تمام ترانس ایزومریزه شده و واکنشهای پروتئین-پروتئین را به جای تبادل یونی، آغاز میکند. این واکنشهای پروتئین-پروتئین باعث آغاز آبشار مرتبط با پیام رسان ثانویه بینایی در انتقال نور میگردد. بر خلاف رخدادها در رودوپسینهای نوع ۱، رتینال پس از ایزومریزه شدن از شریک اپسین خود جدا شده و به حالت تمام ترانس درمیآید و در این موقعیت، مولکول رتینال ۱۱-cis جدیدی باید جایگزین شود. بدلیل واکنشهای دورهای کروموفور و نیازمندی به اجزای بیوشیمیایی دیگر در انتقال سیگنال، تاثیر اپسینهای نوع ۲ در مقایسه با اپسینهای نوع ۱، با سرعت کمتری اعمال میشود.
اپسینهای نوع ۲ از نظر فیلوژنیک، به چهار گروه تقسیم میشوند: اپسینهای C یا اپسینهای ciliary، اپسینهای کیسه تنان یا cnidarian opsins، اپسینهای R یا rhabdomeric opsins، و اپسینهای Go/RGR (نام دیگر این اپسینها، RGR/Go یا اپسینهای گروه ۴ است).
نکته قابل توجه اینکه اپسینهای C، اپسینهای R و اپسینهای Go/RGR تنها در «دوسوئیان» (Bilateria) یافت میشود.
اپسینهای بینایی نوع ۲ بصورت مرسوم بعنوان ciliary یا rhabdomeric دسته بندی میشوند.
اپسینهای C
اپسین های ciliary در مهره داران و کیسه تنان یافت شده و به ساختارهای ciliary مانند سلولهای استوانهای و سلولهای مخروطی متصل میشوند. این اپسینهای در سلولهای گیرندهی نوری ciliary بیان شده و شامل اپسینهای بینایی مهره داران و انسفالوپسینها میگردند. آنها نور را از طریق کانالهای یونی که توسط نوکلئوتیدهای حلقوی باز و بسته میشوند، به ایمپالسهای عصبی تبدیل میکنند.
- اپسینهای بینایی مهره داران:
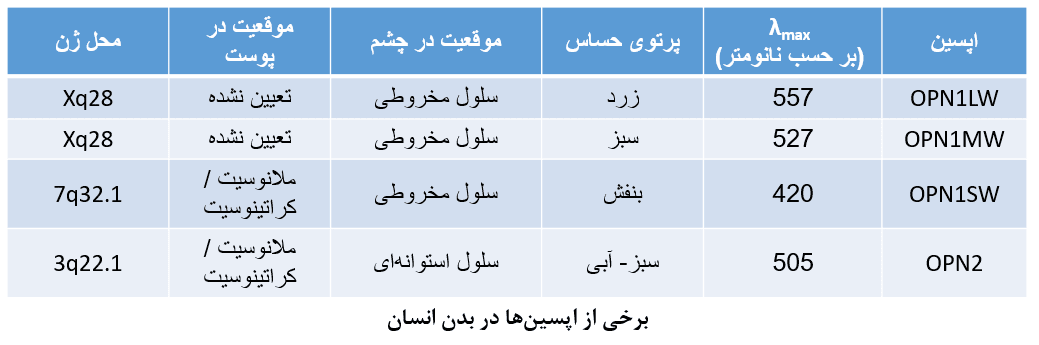
این اپسین ها، زیر مجموعهای از اپسینهای C هستند. آنها در شبکیه مهره داران بیان شده و بعنوان واسطه بینایی فعالیت میکنند. آنها میتوانند به اپسینهای استوانهای (rod opsins) و اپسینهای مخروطی (cone opsins) تقسیم بندی شوند. اپسینهای استوانهای (به اختصار Rh بیان میشوند)، وظیفه بینایی در نور اندک را برعهده داشته و از نظر دمایی پایدار هستند. اپسینهای مخروطی نیز مسئول بینایی رنگی بوده و پایداری کمتری دارند. اپسینهای مخروطی بر اساس حداکثر طول موج جذبی در ۴ دسته مختلف قرار میگیرند.
انسانها، دارای پروتئینهای گیرنده نوری به شرح زیر هستند:
*رودوپسینها (Rh1، OPN2، RHO)؛ که در سلولهای استوانهای بیان میشوند
*سه اپسین مخروطی (تحت عنوان فوتوپسینها شناخته میشوند)، که در سلولهای مخروطی بیان میشوند:
۱. اپسین حساس به طول موج بالا (OPN1LW)
۲. اپسین حساس به طول موج متوسط (OPN1MW)
۳. اپسین حساس به طول موج کوتاه (OPN1SW)
- پینوپسینها:
اولین اپسین پینهآل (پینوپسین) در غده پینهآل مرغ یافت شد. این اپسین به نور آبی (λmax= ۴۷۰ نانومتر) حساس است. همچنین این اپسینها در نقاط گستردهای از مغز از جمله ناحیه پینهآل بیان میشود.
- اپسینهای کهن مهره داران (VA):
اپسینهای کهن مهره داران به سه نوع VA کوتاه (VAS)، VA متوسط (VAM) و VA بلند (VAL) تقسیم میشود. این اپسینها در شبکیه داخلی و در سلولهای افقی و آماکرین همانند ناحیه پینهآل و ناحیه habenular مغز بیان میشود. این اپسینها به طول موج نزدیک به ۵۰۰ نانومتر حساس بوده و در بسیاری از انواع مهره داران یافت میشوند. این اپسینها در پستانداران یافت نمیشوند.
- پاراپینوپسینها:
اولین پاراپینوپسین در ناحیه پاراپینهآل گربه ماهی یافت شد. پاراپینوپسین مارماهی یک اپسین حساس به فرا بنفش (λmax= ۳۷۰ نانومتر) است. ماهیهای استخوانی دارای دو گروه از پاراپینوپسینها هستند، یکی حساس به فرا بنفش (λmax= ۳۶۰-۳۷۰ نانومتر)؛ و دیگری حساس به نور آبی (λmax= ۴۶۰-۴۸۰ نانومتر).
- پاریتوپسینها (Parietopsins):
اولین پاریتوپوسین در سلولهای گیرنده نوری در چشم آهیانهای مارمولک یافت شد. پاریتوپسین مارمولک به نور سبز (λmax= ۵۲۲ نانومتر) حساس بوده و با اینکه یک اپسین C است، همانند اپسینهای بینایی مهره داران باعث القای دپلاریزاسیون میگردد.
- انسفالوپسین یا پانوپسین (OPN3):
پانوپسینها در بسیاری از بافتها از جمله پوست، مغز، قلب و شبکیه یافت میشود. این اپسینها ابتدا در مغز انسان و مغز موش یافت شدند و بهمین خاطر “انسفالوپسین” نام گرفتند. پانوپسینها در مغز برخی حشرات نیز بیان میشوند.
* پانوپسین مغز ماهی استخوانی با نام اپسین Teleost multiple tissue (TMT) شناخته میشود.
- اپسین TMT:
اپسینهای ماهی استخوانی در بسیاری از بافتها بیان میشود. این اپسینها شامل سه گروه هستند. اپسینهای TMT، توالیهای اینترونی مشابهی با پانوپسینهای موجود در دیگر حیوانات دارند.
اپسینهای کیسه تنان (Cnidarian)
کیسه تنان شامل عروس دریایی و مرجانها بوده و از پایهای ترین موجودات دارای چشم پیچیده محسوب میشوند. اپسین های کیسه تنان در یک گروه شناسایی شده و بهمین خاطر، تحت عنوان cnidops نام گذاری شدهاند؛ با این حال، برخی از این اپسینها در گروههای دیگر مانند اپسینهای C و اپسینهای R نیز میتوانند قرار گیرند.
اپسینهای R
این اپسین ها با نام اپسینهای Gq نیز شناخته میشوند، زیرا آنها با پروتئینهای Gq جفت هستند. اپسینهای R توسط حلزونها و بندپایان تولید میشوند. همچنین ملانوپسین (یکی از اعضای خانواده اپسینهای R) در مهره داران نیز بیان میشود و در تنظیم ریتمهای سیرکادین و رفلکس پاپیلاری دخالت دارد.
ملانوپسین OPN4: این اپسین در ریتمهای سیرکادین، رفلکس پاپیلاری و تصحیح رنگ در موقعیتهای با روشنایی بالا دخیل است.
اپسینهای Go/RGR
اپسین های Go/RGR شامل اپسینهای Go، اپسینهای RGR، نوروپسینها (neuropsins) و پروپسینها (peropsins) هستند.
اپسین های Go: این اپسینها در مهره داران پیشرفته بیان نمیشوند. آنها برای اولین بار در سلولهای گیرنده نوری چشمِ گوش ماهی و طنابداران یافت شدند.
اپسینهای RGR: نام کامل آنها، Retinal G protein coupled receptor بوده و در اپی تلیوم رنگدانهای شبیکه و سلولهای مولر بیان میشوند. آنها در تاریکی بجای رتینال ۱۱-cis، به رتینال تمام ترانس متصل میشوند. این اپسینها، روند تولید و مصرف رتینوئید را کنترل میکنند. RGR گاوی، بر اساس pH دارای حداکثر طول موجهای جذبی متفاوت است. مثلا در بیشترین pH، نور آبی را به طور حداکثر جذب میکند و در پایینترین pH، فرابنفش دارای بیشترین جذب است.
پروپسینها: این پروتئینها، گیرندههای بینایی شبه رنگدانهای هستند که توسط ژن RRH در انسان کد گذاری میشوند.
نوروپسینها: این اپسینها معمولا به طول موج ۳۸۰ نانومتر و پرتوهای فرابنفش A حساس هستند. نوروپسینها در مغز، بیضه و شبکیه انسان و جوندگان همانند مغز و شبکیه پرندگان بیان میشوند. این اپسینها با پروتئینهای Gi جفت میشوند و در انسان، ژن OPN5 مسئول کد گذاری آن است. وظیفه این اپسین در شبکیه انسان، ناشناخته است.
اپسینهای طبقه بندی نشده
این اپسین های پینهآل، در Actinopterygii یافت شده و بنظر میرسد در اثر دوپلیکاسیون ژن Rh1 تولید میشوند. این اپسینها احتمالا عملکردی همانند پینوپسینهای پرندگان و خزندگان دارند.
قدرت اپسینهای میکروبی در تنظیم فعالیت الکتریکی سلولها، باعث ایجاد علاقه قوی به استفاده از نور در کنترل رخدادهای بیوشیمیایی سلول شدهاست. شایان ذکر است که رویکردهای مطالعاتی در رابطه با اپسینهای نوع ۲ در مهرهداران باعث معرفی اپسینهای صناعی بمنظور کنترل وقایع سلولی در پستانداران آزادزی گردیدهاست.
همچنان اشاره به این نکته خالی از لطف نیست که گروههای متعددی از محققان، کنترل سیگنالینگ درون سلولی را با مهندسی پروتئینهای غیر وابسته به اپسین که با نور کنترل میشوند، گسترش دادهاند؛ این پیشرفتها، تنظیم فرآیندهایی را که پیام رسانهای ثانویهای مانند cAMP و cGMP در آنها دخیل هستند، ممکن ساخته است. برای مثال، آدنیلیل سیکلازهای فعال شونده توسط نور (PACs) را ایجاد کردهاند که میتوانند از FAD که تقریبا در تمامی سلولها یافت میشود، استفاده کنند.
PAC، تولید آنزیم در اثر تابش نور آبی را عهدهدار است. یکی از نمونههای استفاده از این پروتئینها در تحقیقات، کشت سلولهای گرانولی دندانهدار (dentate granule cells) است که ژن PAC را در ژنوم خود دارند. در حین رشد، با بیان این پروتئینها و نهایتا افزایش سطح cAMP سلول، تعداد جوانههای آکسونی سلول افزایش مییابد.
اخیرا، گروه کوچکی از PAC با سطح فعالیت پایینتر در تاریکی، از باکتری خاکی Beggiatoa در نورونها بیان شدهاست. همچنین نوع خاصی از PAC که در Drosophila یافت شدهاست، بمنظور تغییر جریانهای غشایی و تاثیر گذاری بر رفتار مورد استفاده قرار گرفتهاست.
بطور خلاصه، ویژگیهای مثال زدنی اپسینهای میکروبی را میتوان بدین گونه بیان کرد:
- کد گذاری یکپارچه حساسیت به نور و عملگر نهایی توسط یک ژن منفرد
- عدم فعالیت در تاریکی (بصورت قراردادی درنظر گرفته میشود)
- پاسخ به طول موجهای مشخص در مقیاس میلیثانیه
این ویژگیها باعث ارتقای انگیزه محققان بمنظور انجام بررسیهای بیشتر و مهندسی این پروتئینها شدهاست.
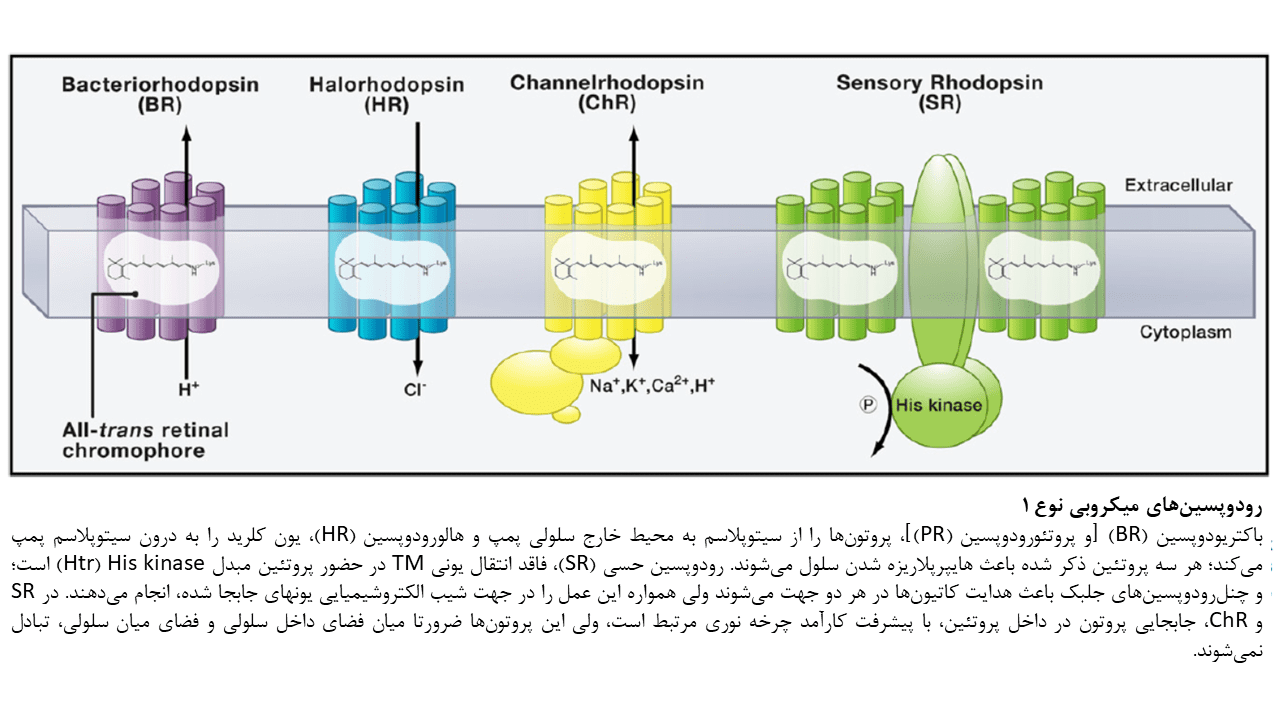
پمپهای یونی فعال شونده توسط نور: باکتریورودوپسین، پروتئورودوپسین، و هالورودوپسین
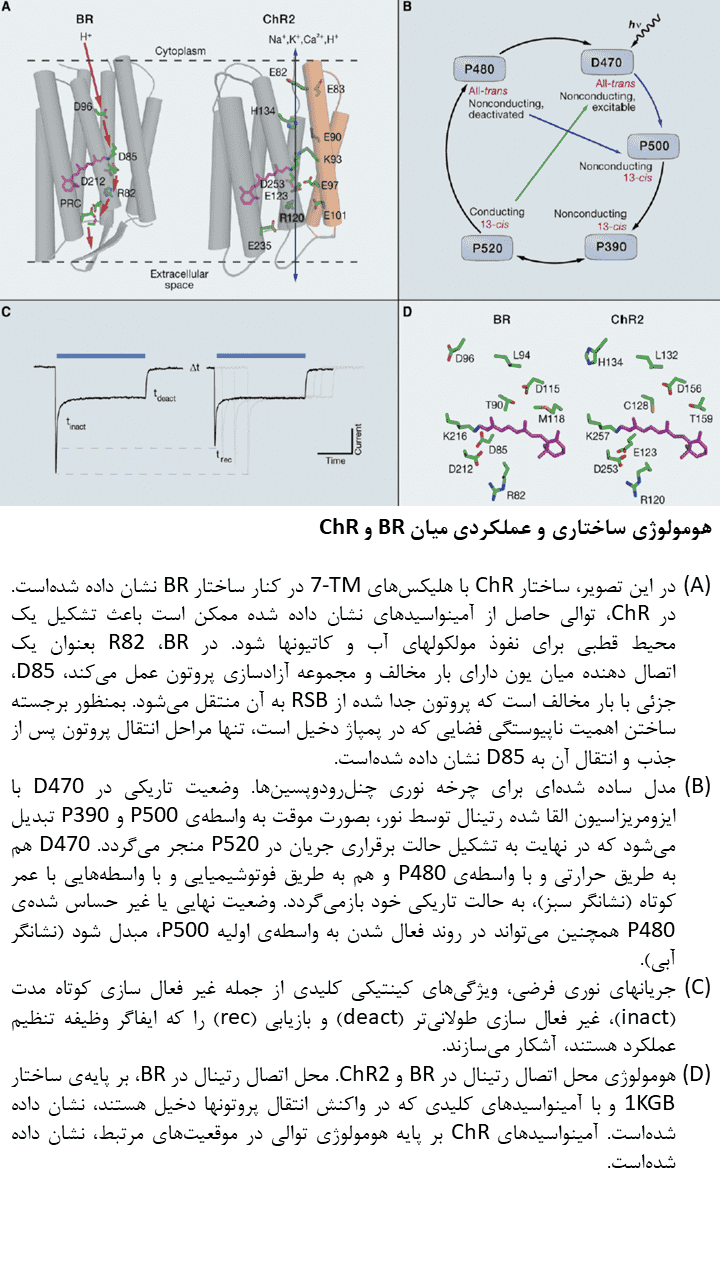
باکتریورودوپسین (BR) ابتدا بعنوان یک پروتئین TM تک جزئی که قادر به جابجایی پروتونها از فضای درون سلولی به فضای خارج سلولی بود، معرفی گردید. Haloarchaea (گروهی از Euryarchaeota که در آبهای اشباع یا نزدیک به اشباع با نمک یافت میشود) BR را در سطوح بالایی بمنظور ثابت نگه داشتن شیب پروتونی در غشا برای سنتز ATP، در شرایط فشار اکسیژن کم بیان میکند. در طول روند جابجایی پروتونها، BR، آبشاری از حالتهای واسطهی نوری را تجربه کرده و هر حالت میتواند با یک علامت طیفی متمایز شناسایی شود. جذب نور توسط BR باعث ایزومریزاسیون رتینال متصل به آن از حالت تمام ترانس به حالت ۱۳-cis میشود. این رخداد باعث آغاز مجموعهای از واکنشهای جابجایی پروتون میگردد. این فرآیند جابجایی پروتون همانند فرآیند جابجایی یون کلرید در هالورودوپسینها، بصورت ظریفی از نظر فضایی ناپیوسته است تا از انتشار بازگشتی غیر فعال یونها در جهت شیب یونی، جلوگیری کند. جابجایی درونی پروتون زمانی آغار میشود که ایزومریزاسیون رتینال باعث ایجاد تغییرات ساختاری در پروتئین و جابجایی دوقطبی RSBH+ گردد. این جابجایی دوقطبی، pKa مربوط به RSB را افزایش داده و منجر به آزادسازی پروتون به پذیرنده D85 مجاور میگردد. حرکت پروتون باعث ایجاد تغییرات اضافی در پروتئین میشود. در پمپ BR، پروتون از یک منطقه آزادسازی پروتون به فضای خارج سلولی آزاد میشود. این منطقه آزادسازی پروتون توسط ۲ آمینواسید گلوتامات (Glu) سطحی شناسایی میشود. سپس RSB بصورت غیر مستقیم، پروتون دوم را از سیتوپلاسم جذب میکند که این چرخه نوری میتواند توسط جذب یک فوتون دیگر، ادامه یابد. در رودوپسینهای حسی (SRs)، جابجایی داخلی پروتون و تغییرات ساختاری متعاقب آن باعث تغییر سازمانبندی مولکول مبدل (Htr) میشود. مولکول مبدل با رودوپسین تعامل دارد. برخی از جوانب جابجایی داخلی پروتون در بسیاری از اپسینهای نوع ۱ مطالعه شدهاست؛ برای مثال، محل پایه کربوکسیلات در پذیرنده پروتون و دهنده آن بر روی TM سوم هلیکس، در تمامی پمپهای پروتونی نوع ۱ مورد مطالعه و بررسی قرار گرفتهاست.
اپسینهای پمپ کننده پروتون که مشابه BR هستند، در قلمروهای دیگر حیات نیز یافت شدهاست؛ برای مثال، پروتئورودوپسینها (PRs) با چرخههای نوری مشابه BR در پروتئوباکتری دریایی یافت شدهاند. بدلیل اینکه پروتئورودوپسینهای دریایی درجه بالایی از شباهت ساختاری را در میان گونههای مختلف نشان داده و دارای طیف عملکردی متناسب با عمق و عرض جغرافیایی اقیانوس هستند، بررسیهای ژنومی بسیاری بمنظور آشنایی با طیف عملکردی اپسینها و تنظیم آن صورت گرفتهاست. نکته جالب اینکه تفاوت جذبی میان طول موجهای آبی و سبز میتواند بر پایهی تفاوت یک آمینواسید استوار باشد. ولی تلاشها برای ایجاد جهشها با هدف اختلال تنظیم طیفی PR، نسبت به دیگر اپسینهای میکروبی با محدودیتهایی مواجه بودهاست.
Archaerhodopsin-3 که ابتدا توسط Ihara و همکارانش شناسایی شد، یک پمپ پروتونی مشابه BR است. این پمپ پروتونی در نورونها بمنظور شناسایی ولتاژهای گذرای ناشی از سیگنال نوری (که توسط نوسانات ولتاژی فرستنده کنترل میشوند)، مورد استفاده قرار گرفتهاست. با اینکه هنوز توانایی عملکردی این پروتئینها در بررسیها بر روی موجودات زنده به اثبات نرسیدهاست، علاقه به این دسته از اپسینهای میکروبی در پژوهشهای علوم عصبی، بسیار بالا است. Archaerhodopsin-3 همچنین توانایی ایجاد جریان هایپرپلاریزه کننده را دارد که میتواند بمنظور مهار فعالیت عصبی مورد استفاده قرار گیرد. با این حال، خروج پروتونها از سلول که توسط تمامی این پمپهای پروتونی انجام میشود، در نهایت به کاهش pH خارج سلولی میانجامد.
هالورودوپسینها (halorhdopsins / HRs) گروه متمایزی از اپسینهای archaeal هستند که جریانی از یونهای کلرید ایجاد میکنند. هالورودوپسینها، شیب خلال غشایی را با انتقال یونهای کلرید از فضای خارج سلولی به درون سلول کنترل میکنند. چرخه نوری اولیه در هالورودوپسینها با اینکه مشابهتهای کیفی با چرخه نوری BR دارد ولی از دست دادن پروتون توسط RSBH+ در چرخه نوری هالورودوپسینها بدلیل جایگزینی یک آمینواسید از پذیرنده آسپارتیک اسید با ترئونین، وجود ندارد. بهمین دلیل پس از ایزومریزاسیون رتینال که توسط نور آغاز میشود و جابجایی دوقطبی RSBH+، پروتون بدلیل عدم وجود پذیرنده مناسب نمیتواند آزاد شود. در عوض، یون کلرید که از ابتدا در پروتئین HR حاضر است، از سمت خارجی کروموفور RSBH+ به سمت داخلی جابجا شده و متعاقبا به فضای درون سلولی آزاد میشود.
در یکی از مطالعاتی که بر روی شناخته شدهترین HR (که از Halobacterium salinarum بدست آمده است) صورت پذیرفتهاست، ناتوانی این پروتئین در پایدار ساختن جریان نوری به هنگام بیان هترولوگ، آشکار گردید؛ در حالیکه در همان مطالعه، هالورودوپسینهای بدست آمده از Egyptian Natronomonas pharaonis یا NpHR که در آبهایی با غلظت کمتر نمک زندگی میکند، قادر به مهار ساختن رفتار C. elegans توسط هایپرپلاریزه کردن نورونها با ایجاد جریانهای یون کلرید بودند. غیر حساس کردن پمپ، روشی متعادل و نسبتا ساده است که برقراری جریانهای پایدار را در پاسخ به تابش مداوم نور زرد ممکن میسازد، ولی بدلیل انتقال تنها یک یون در هر چرخه نوری، سطح بالای بیان و چرخههای نوری سریع مورد نیاز است. با افزودن سیگنالهای عبوری از پروتئینهای غشایی پستانداران میتوان به بیان هترولوگ غشایی این پروتئینها دست یافت؛ و این یافته، اولین مهار اپتوژنتیکی رفتار در پستانداران را ممکن ساخت. بعلاوه، با افزایش قابل توجه تعداد مولکولهای HR بر روی غشای نورونی، نورونهای بیان کننده NpHR میتوانند حتی توسط طول موج ۶۸۰ نانومتر نیز مهار شوند که از طیف عملکردی آن بسیار فاصله دارد.
پروتئینهای متصل شونده به رتینال دیگری نیز از Halobacterium salinarum استخراج شدهاست که از نظر عملکرد، مشابه گیرندههای نوری عمل میکنند. مانند رودوپسینهای حسی SR1 و SR2 (که ابتدا phoborhodopsin نام گرفت) یا P480. چرخه نوری رودوپسینهای حسی در جابجایی داخلی پروتون به چرخه نوری BR شباهت دارد؛ ولی در این پروتئینها، تغییرات ساختاری اپسین (که توسط نور القا میشود) بمنظور فعالسازی مولکول مبدل Htr که در ارتباط نزدیکی با آن قرار دارد، مورد استفاده قرار میگیرد. زمانیکه Htr فعال شد، آبشار فسفوریلاسیون را رقم میزند که کنترل جهت حرکت موتور فلاژلی را برعهده داشته و فوتوتاکسی را به سمت نور زرد و سبز هدایت میکند (حداکثر جذب SR1 در ۵۸۷ نانومتر و حداکثر جذب SR2 در ۴۸۷ نانومتر رخ میدهد). بدلیل اینکه آبشارهای کینازی پروکاریوتها اساسا با پیامرسانهای ثانویه یوکاریوتی تفاوت دارند، کسب عملکرد SR در سیستمهای هترولوگ، پیچیدهتر از پمپهای یونی است و نیازمند طراحی دوباره تمامی اجزای آبشار هدایت سیگنال است.
کانالهای یونی که توسط نور باز و بسته میشوند
چنلرودوپسینها، پروتئینهای ۷-TM هستند که توانایی هدایت جریانهای غیر انتخابی کاتیونها را در خلال غشا به هنگام تابش نور دارند. این پروتئینها همچنین سیگنالینگ داخل سلولی را با یک توالی طولانی در انتهای کربوکسیلی خود، ممکن میسازند. در کاربردهای اپتوژنتیکی، تنها ناحیه ۷-TM از چنلرودوپسینها مورد استفاده قرار میگیرد؛ ولی در حالت طبیعی، سیگنالینگ داخل سلولی باعث فعال شدن تعداد محدودی از کانالهای یونی ثانویه میشود که بعنوان جریانهای نوری در شدت پایین نور دیده میشوند. در مقابل، در شدتهای بالا، جریانهای داخلی که بعنوان جریانهایی با تاخیر اندک دیده میشوند، شایع بوده و نزدیک به ۸۰ درصد جریان کلی را تشکیل میدهند. سازمان بندی قسمت ۷-TM در تصویر زیر آورده شدهاست. به قطعات قطبی که ممکن است در تشکیل سوراخ هدایتی شرکت کنند، توجه کنید. در ChR1 که اخیرا از Mesostigma viride استخراج شد، ۲ قطعه از ۵ قطعه آنیونی در این گروه وجود ندارد که ممکن است توضیحی برای جریانهای کوچک حاصل از این ChR در سلولهای کلیوی رویانی انسان باشد.
اولین چنلرودوپسین …
اولین چنلرودوپسینی که کشف و معرفی گردید، چنلرودوپسین-۱ (ChR1) بود. این چنلرودوپسین، یک کانال یونی در Chlamydomonas reinhardtii (جلبک سبز تک سلولی که در آبهایی با دمای معتدل زندگی میکند) است که توسط نور کنترل میشود. ابتدا باور بر این بود که این چنلرودوپسین تنها باعث انتقال پروتون میشود ولی با انجام مطالعات بیشتر، دانشمندان به این نتیجه رسیدند که این کانال یونی طیف وسیعی از کاتیونها، از جمله یونهای سدیم، پتاسیم و حتی کلسیم را میتواند منتقل کند.
دومین چنلرودوپسین که باز هم در Chlamydomonas reinhardtii یافت شد، چنلرودوپسین-۲ (ChR2) بود که همانند ChR1، جابجایی کاتیونها را بر عهده دارد. ChR2 همانند ChR1، سرعت پاسخ دهی به نور بالایی دارد.
چنلرودوپسینها به نور آبی پاسخ میدهند و در صورتی که آنها را بتوان در نورونها بیان کرد، وظیفه تغییر پتانسیل غشا را میتوانند عهدهدار شوند.
ChR2 در مقایسه با ChR1، به میزان بالاتری در بدن پستانداران بیان میشود. شایان ذکر است یک پروتئین کایمر از ChR1 با یک ChR از دیگر گونهی جلبک به نام (Volvox carteri (VChR1 وجود دارد که فاقد توالیهای ChR2 بوده و جریانهای ناشی از نور بسیار قویتری در مقایسه با ChR2 ایجاد میکند.
ChR1 و ChR2، شباهتهایی با باکتریورودوپسین و دیگر اپسینهای نوع ۱ در توالی نشان میدهند. همچنین، هومولوژی قوی میان نواحی مسئول اتصال به رتینال و هدایت پروتون در میان اپسینهای نوع ۱ وجود دارد که ممکن است توجیهی برای اشتراک نسبی مکانیسمهای هدایت یونی با دیگر اپسینهای میکروبی باشد.
حقیقتا، پمپهای یونی فعال شونده توسط نور، مهندسی مولکولی و استراتژیهای ژنومی در کنار یکدیگر، ارتقای عملکرد کانالهای یونی فعال شونده توسط نور و فهم تفاوتهای مکانیسمی میان رودوپسینهایی که بعنوان پمپهای فعال و پمپهای غیر فعال فعالیت میکنند را آغاز کردهاند. مهندسی مولکولی بطور وسیعی بر پایه مدلهای مولکولی که ساختارهای سه بعدی دیگر رودوپسینهای میکروبی مانند BR، HR و SRII را نمایانگر هستند، استوار است.
برخی ویژگیهای چنلرودوپسین
TM3 موجود در چنلرودوپسینها، حاوی توالیهایی است که برای کنترل عبور مواد از کانال و مدت زمان هدایت یونی ضروری میباشد.
اساسیترین ویژگیهای بیوفیزیکی که عملکرد اپسینها در سطح تک مولکولی را تحت تاثیر قرار میدهند، عبارتند از: کارآمد بودن جذب نور (εmax معمولا در بازه ۵۰,۰۰۰ تا ۷۰,۰۰۰ M-۱cm-۱ قرار دارد)، کارآمدی کوانتوم (φ معمولا در بازه ۰.۳ و ۰.۷ قرار میگیرد)، و مدت زمان چرخه نوری.
در اکثر پمپهای یونی که توسط نور کنترل میشوند (BR و HR)، مدت زمان چرخه نوری چیزی در حدود ۱۰ تا ۲۰ میلی ثانیه است، بهمین دلیل دقت زمانی را در حد میلی ثانیه برای مقاصد مختلف از جمله مقاصد مطالعاتی فراهم میآورد. دیگر پمپهای اپسین مانند پروتئورودوپسینهای آبی، مدت زمان بیشتری (۸۰ تا ۱۰۰ میلی ثانیه) را صرف چرخه نوری میکند و بهمین ترتیب، محدودیتهایی برای استفاده از این قبیل اپسینها در بررسیهای علوم اعصاب وجود دارد.
نکته مهم این است که در بسیاری از حاملهای یونی، این مقادیر در پتانسیل خنثی غشا (صفر میلیولت) تعریف میشوند، ولی مدت زمان چرخه نوری میتواند بطور قابل توجهی در حالت هایپرپلاریزه غشا، آهستهتر باشد (از ۱۰-۲۰ میلی ثانیه تا ۱۰۰-۴۰۰ میلی ثانیه). بهمین دلیل، کاهش پتانسیل غشا باعث آهستهتر شدن عملکرد پمپ شده و نور بیشتری برای دست یابی به مقدار مشابه هایپرپلاریزاسیون، مورد نیاز خواهد بود.
بطور عمومی، جهت پمپاژ یونی تحت تمامی شرایط فیزیولوژیک، ثابت میماند؛ ولی پدیدهای تحت عنوان “pump inversion” یا معکوسسازی پمپاژ در PR مشاهده میشود که دلیل رخداد آن، نشت پمپ تحت ولتاژهای بسیار منفی و شیب pH قوی است.
عوامل موثر بر فعالیت چنلرودوپسینها
برخلاف پمپهای حاصل از اپسینها، پارامترهای مربوط به سینتیک چنلرودوپسینها به میزان کارایی جذب نور توسط این پروتئینها و مدت زمان برقراری جریان یونها بستگی دارد. قسمت TM3 چنلرودوپسینها حاوی توالیهای آمینواسیدی کلیدی است که عملکرد دریچهای کانال و مدت زمان برقراری جریان یونها را کنترل میکند.
علاوه بر فاکتورهای مولکولی و داخلی، تعداد این کانالهای یونی و فاکتورهای خارجی نیز بر عملکرد اپسینهای میکروبی تاثیر گذار هستند. حقیقتا بمنظور دستیابی به سطوح بالاتر عملکرد رودوپسینها در مصارف تحقیقاتی، عواملی مانند رونویسی از ژن این پروتئینها، ترجمه رونوشت حاصل، انتقال پروتئین حاصل به غشا و هدفگیری آنها در غشا بایستی بهینه شوند. همچنین ادغام هلیکسهای TM نیز موثر واقع میشود؛ بطوریکه ChR کایمری که حاوی ترکیبی از TMهای ChR1 و ChR2 یا به اختصار C1C2 است، کمتر غیر فعال شده و میزان بیان بالاتری در سلولهای پستانداران دارد.
در برخی موارد، بروز جهش در توالی ژنی این پروتئینها نیز باعث بروز تغییراتی در عملکرد آنها میشود. برای مثال، نوع طبیعی ChR2 در زمانی حدود ۱۰ میلی ثانیه پس از قطع جریان نور، غیر فعال میشود و بهمین ترتیب باعث تحریک نورون با فرکانسی در حدود ۴۰ تا ۵۰ هرتز میگردد؛ با این حال، دستیابی به فرکانسهای بالاتر در فعالیت نورونی، نیازمند تشکیل سریع این پروتئینها و پایداری وضعیت انتقال یونها در خلال غشا است. حذف احتمالی پذیرنده پروتون در ناحیه E123 (جهش “ChETA” که بصورت E123A یا E123T است)، به بسته شدن سریعتر کانال و کنترل فوق سریع نوری بر تحریک نورونی میانجامد. جریان نوری که توسط ChETA در مقایسه با نوع طبیعی ChR2 ایجاد میشود، زمان کوتاهتری دارد، ولی این مورد میتواند با تابشهای شدیدتر یا طولانیتر نور جبران شود. جهش در ناحیه E123A نشان میدهد این ناحیه که معمولا بعنوان پذیرنده پروتون درنظر گرفته میشود، برای جریان پروتونها یا جریانهای یونی دیگر ضروری نیست که یکی از جنبههای قابل توجه در عملکرد ChR را بازگو میسازد.
بطور خلاصه، ویژگیهای منحصربفرد ChETA را میتوان به شرح زیر بیان کرد:
- دقت و اختصاصیت بالا در ایجاد تحریک بهنگام تابش نور
- ایجاد پتانسیلهای کفهدار و چندگانه به میزان کمتر
- کسب سریع توانایی فعالیت پس از غیر فعال شدن
- هماهنگی ارتقا یافته میان عملکرد و تابش نور
توالییابی ژنومی و مهندسی مولکولی
با بهره گیری از آنالیزهای ژنی در سال ۲۰۰۸، دانشمندان ۲ مورد چنلرودوپسین جدید در جلبک کلنی Volvox carteri کشف کردند. یکی از این چنلرودوپسینها (VChR1) طول موجهایی از نور را که به طول موج نور قرمز نزدیکتر هستند، بطور قابل توجهی جذب میکند (λmax برابر است با ۵۴۰ نانومتر؛ البته تحریک این کانالها در نورونهای هیپوکامپی میتواند حتی در طول موج ۵۸۹ نانومتر نیز صورت گیرد). سطوح بیان VChR1 نیز در مقایسه با ChR2 بطور قابل توجهی پایینتر است، هر چند تاخیر جزئی در برقراری حالت باز این کانال باعث جبران سطوح پایین بیان این پروتئین میگردد. با انجام تحقیقات بیشتر بر روی این دو چنلرودوپسین جدید، پیشرفتهایی همچون ترکیب کردن دومینهای TM، بهبود هدایت یونی در غشا و ارتقای خانواده C1V1 حاصل شد. اعضای خانواده C1V1 هیچ توالی از ChR2 را در خود جای نمیدهند ولی جریانهای نوری قابل توجهی در مقایسه با ChR2 طبیعی ایجاد کرده و کنترل تحریک سلولی را توسط نور قرمز ممکن میسازند؛ حتی از این خانواده در ایجاد تحریکهای ترکیبی در پستانداران پیشرفتهتر نیز استفاده شدهاست.
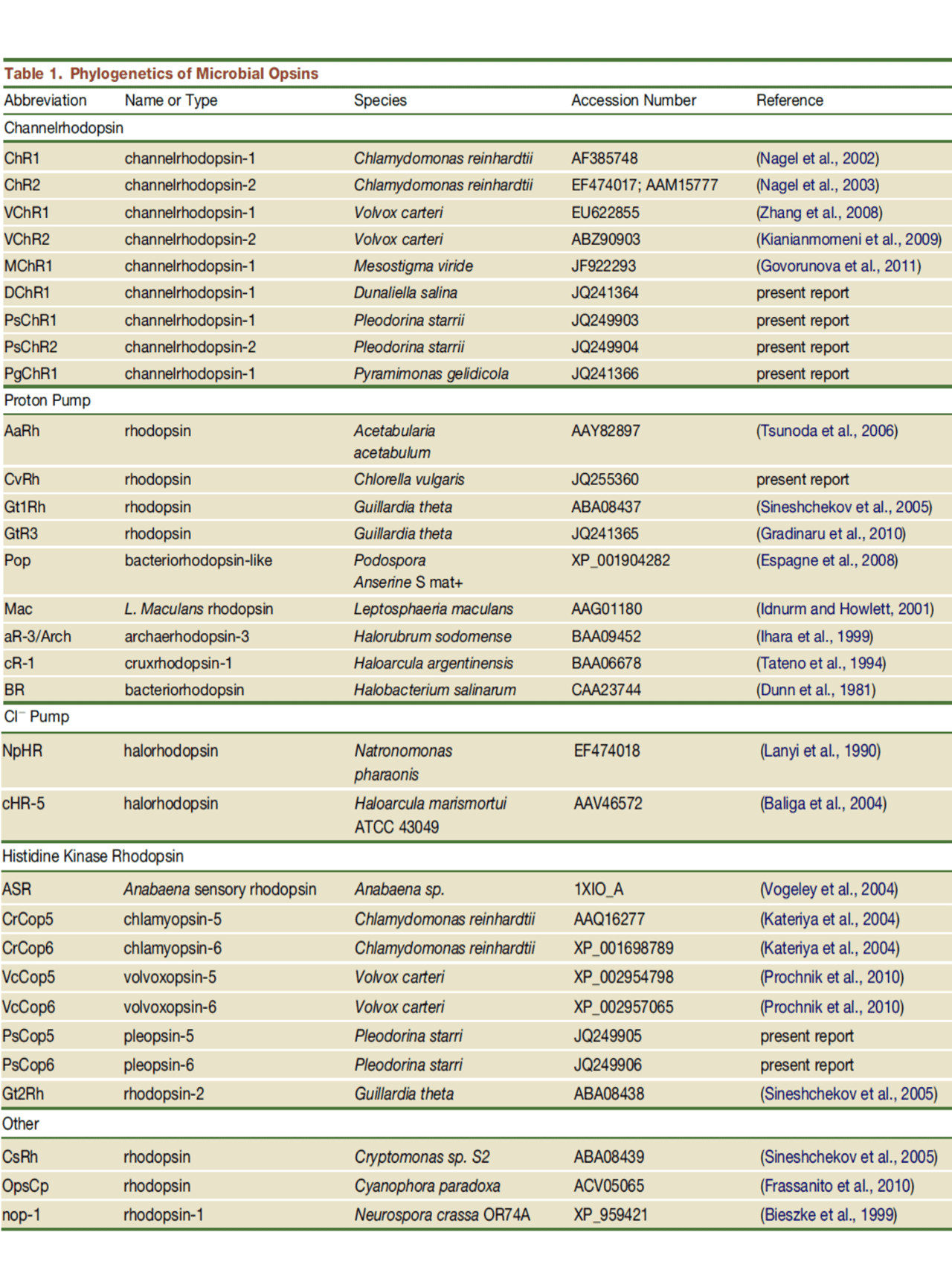
دشواریهایی که در مسیر مهندسی مولکولی قرار دارد، ارزش اطلاعات کریستالی- ساختاری را بمنظور ایجاد دستکاریهای دقیق در ویژگیهای اپسینها، برجسته میسازد. همچنین این دشواریها باعث ارزش نهادن به روشهای ژنومیک در این روند میشود. رویکردهای ژنومی مانند جستجوهای ژنومی که نقشی اساسی در شناسایی اعضای جدید ChR در Volvox carteri داشتند، میتوانند در شناسایی کلاسهای جدید اپسین، کارگشا واقع شوند. بعلاوه، آنالیز تطبیقی اپسینها در سایه تفاوتهای اکولوژیکی میتواند مسیر را در شناسایی مکانیسمهای دخیل در اختصاصی بودن کانالها به یونها، تطابق با یک طیف نوری خاص و دینامیک چرخههای نوری هموار سازد. یکی از نمونههای شایان ذکر از این مورد، شناسایی تعدادی چنلردوپسین جدید (که تنها پروتون را منتقل میسازند) از ژنوم گونههای جلبک Pleodorina stamii، Pyramimonas gelidicola و Dunaliella salina میباشد.
عضو جدید خانواده اپسینها با ویژگیهای متمایز
جلبک سبز تک سلولی با نام Dunaliella salina در آبهای بسیار شور زندگی میکند. این جلبک علیرغم قرار گرفتن در رده جلبکهای Chlamydomonas reinhardtii و Volvox carteri، بدلیل تجمع سطوح بالایی از مولکولهای کاروتنوئید به رنگ قرمز دیده میشود. این جلبک دارای نوع خاصی از ژن چنلرودوپسین بنام DChR1 است که ویژگیهای قابل ذکر بسیاری دارد. جریانهای نوری که توسط این مولکول ایجاد میشود، در مقایسه با دیگر چنلرودوپسینها حاصل انتقال اختصاصی پروتونها در خلال غشا است. همچنین تغییرات تجمع کاتیونها در فضای خارج سلولی بر جریان نوری حاصل از این پروتئینها، بی تاثیر است. در مقابل، تغییرات pH بر این جریان موثر واقع میشود؛ بطوریکه pH بالا باعث توقف این جریان میگردد. مطالعات ژنتیکی بر روی DChR1 نشان دادهاند این پروتئین در مقایسه با دیگر چنلرودوپسینها از ویژگی انتخابی یونهای متفاوتی برخوردار است.
با برقراری شیب الکتروشیمیایی در طرفین این کانال، جریان یونی در خلاف جهت جریان ایجاد شده توسط BR تشکیل میشود؛ بهمین دلیل، DChR1 و BR میتوانند در شرایطی مانند برقراری کنترل دوطرفه بر pH در دستکاری pH اجزاء داخل سلولی از جمله میتوکندری کارگشا باشند. با ذکر این ویژگیها، DChR1، زیرمجموعه جدیدی از اپسینهای میکروبی است.
تمامی این یافتهها نشان دهنده تنوع عملکردی در طیف وسیع اپسینهای میکروبی است.
در جدول زیر، فیلوژنی اپسینهای میکروبی آورده شده است.
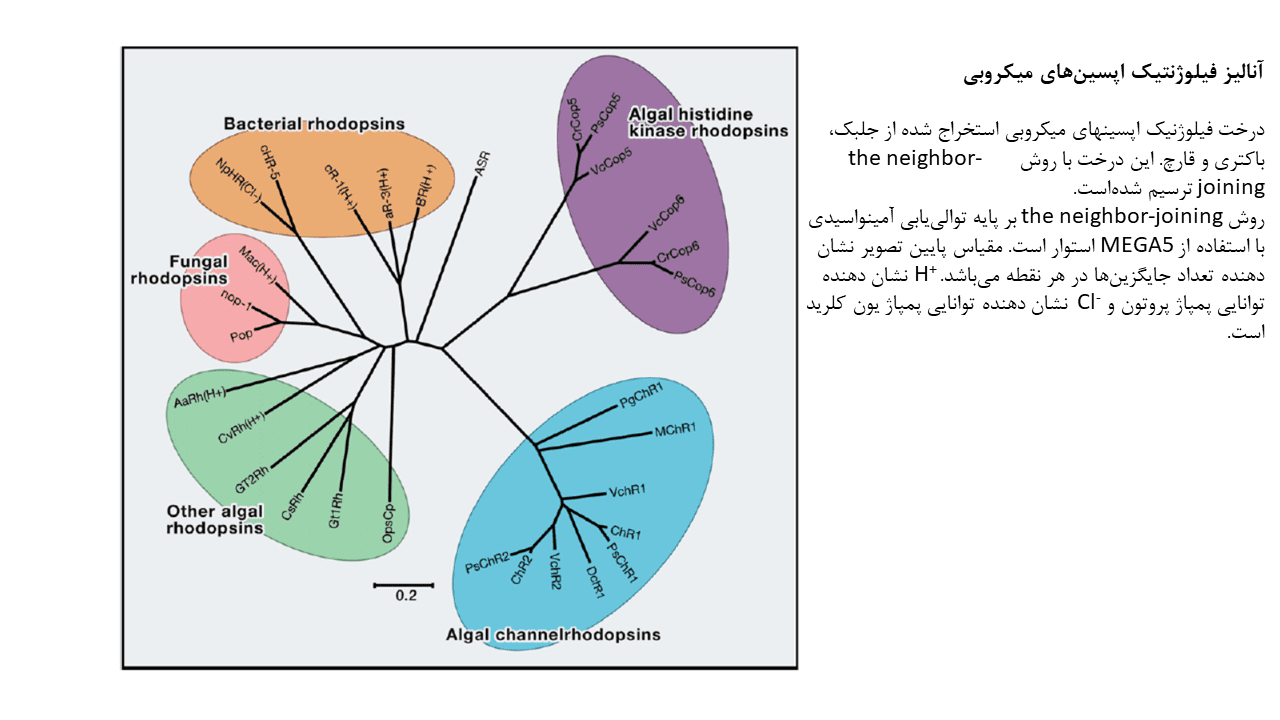
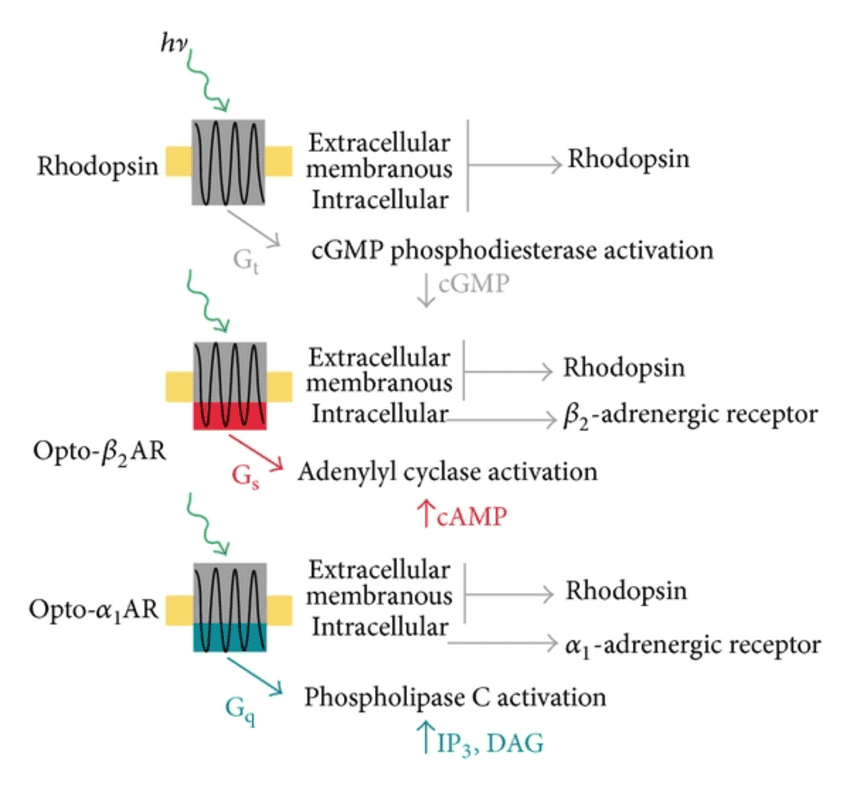
اپسینهای صناعی
با جایگزین ساختن حلقه درون سلولی رودوپسین گاوی با حلقه درون سلولی GPCRs، خانواده در حال گسترشی از رودوپسینهای صناعی تحت عنوان optoXRs، دانشمندان را در کنترل پیام رسانی Gs، Gq و Gi سلولها، توانا ساختهاست. پروتئینهای optoXR، تحت تابش نور با طول موج ۵۰۰ نانومتر فعال میشوند.
همانطور که انتظار میرود، ژنوم میکروبی در مسیر رو به جلوی اپتوژنتیک، ابزارهای اساسی و تواناییهای جدیدی به این تکنیک اعطا خواهد کرد. بررسیهای ادامه دار در ژنوم میکروبی و فیلوژنی عملکردی اپسینهای میکروبی، ما را قادر خواهد ساخت تا انواع جدیدی از این کانالها را با قابلیت عملکرد در طیف نوری گستردهتر و انتخاب یونی متنوع، کشف و مهندسی کنیم. گسترش سریع جعبه ابزار اپتوژنتیک نیز به نوبه خود باعث ارتقای یافتهها در مورد ارتباط ساختار-عملکرد و مکانیسمهای قدیمی و قدرتمند این ماشینهای مولکولی خواهد شد.