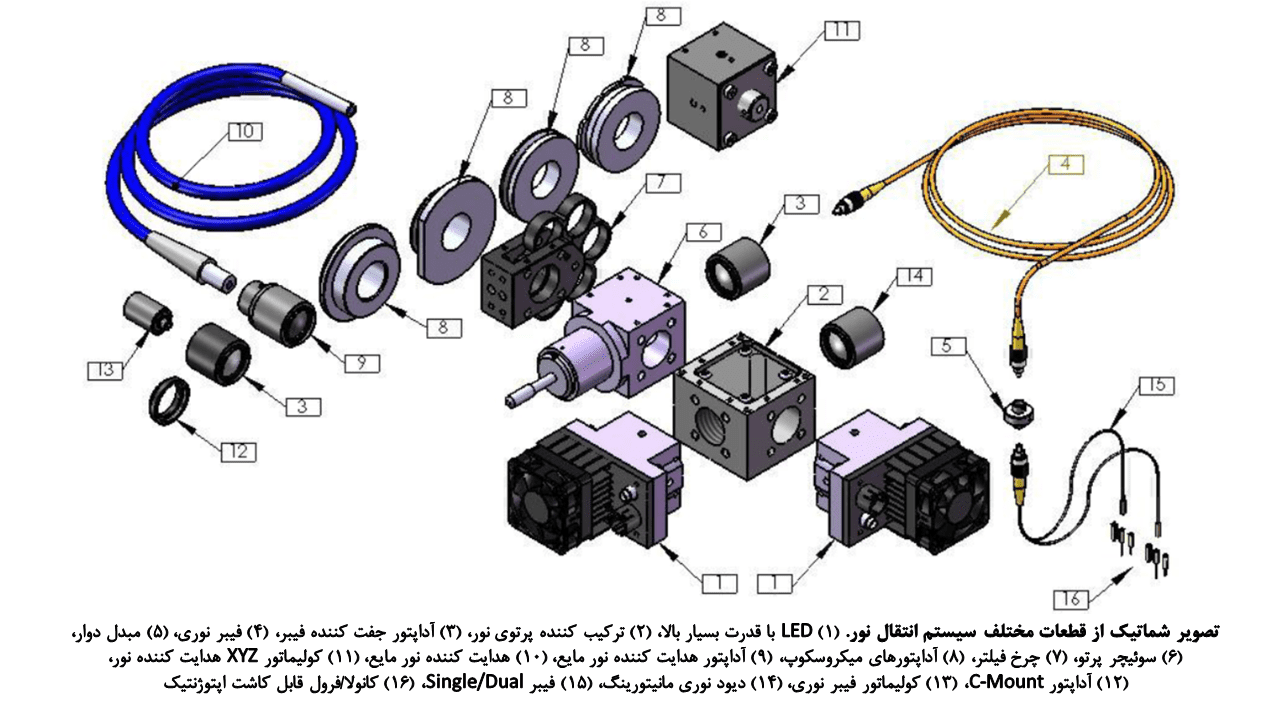
گام بعدی پس از وارد کردن ابزارهای اپتوژنتیکی به سلولهای نمونه مورد نظر، طراحی یک سطح تعاملی نوری-سلولی برای حمل نور به ساختارهای بافتی عمیق (in vivo) یا قطعات بافتی تهیه شده (in vitro) است. (قسمت عمدهی این بخش، بر مطالعات اپتوژنتیکی در حیطه علوم اعصاب متمرکز شدهاست.)
مقاله مرتبط: مقدمه ای بر اپتوژنتیک؛ بازی نور و ژنتیک
مقاله مرتبط: مروری مختصر بر تاریخچه اپتوژنتیک
مقاله مرتبط: اپسین؛ جزء جدایی ناپذیر اپتوژنتیک
مقاله مرتبط: انتقال ژن به سلول توسط وکتورهای ویروسی در اپتوژنتیک
ثبت فعالیت سلولی in vitro معمولا برای شناسایی عملکرد زیستی اپسینها مورد استفاده قرار میگیرد. در این رویکرد، منبع نوری میتواند به عدسی شئای میکروسکوپ متصل شده و توسط محرک الکتروفیزیولوژی یا ژنراتور TTL ادغام شده کنترل شود. همچنین در میکروسکوپی دو فوتونی بمنظور مطالعه فیزیولوژی سیناپسی با دقت بالا، باریکه لیزری با قطر کوچک میتواند به محل اعمال شود.
نگهدارندههای نوری که در محل مطالعه کاشت میشوند، در تصویرسازی تحریک نوری سه بعدی in vivo، امیدوار کننده ظاهر شدهاند.
همانند تحریک الکتریکی عمقی مغز که از الکترودهای فلزی برای تحریک غیر انتخابی سلولها در ساختارهای مغزی بهره میبرد، مطالعات اپتوژنتیکی نیز به فیبرهای نوری بمنظور انتقال نور کافی به اهداف بافتی سطحی یا عمقی نیازمند هستند.
۵ نکته اساسی که باید برای بهینه کردن مطالعه و حداکثر بازده آن در نظر گرفت:
۱) انتخاب بهترین اپسین: هر منبع نوری ایدهآلی به پروتئین حساس به نور مناسبی نیاز دارد. این پروتئین با قرار گرفتن در معرض نور، عملکرد مورد انتظار مطالعه را منجر میشود. نوع این اپسین توسط نیازهای مطالعه و هدف آن تعیین میشود. همچنین سطح بیان بالای این اپسین در سلول برای کسب نتیجه ایدهآل، اساسی و ضروری است.
۲) زمینه و وسعت تابش نور: فعالسازی پروتئینهای حساس به نور در مطالعات in vitro، معمولا از طریق مسیر نوری میکروسکوپ انجام میگیرد. نیازهای مشخص مطالعه، عامل اصلی در تعیین وسعت تابش نور و فعالسازی پروتئینها است. تابش نور بصورت نقطهای، دقت هدف گیری مکانی بالایی را فراهم آورده و از در معرض نور قرار گرفتن سلولهای خارج از محدوده، جلوگیری بعمل میآورد. همچنین با هدف گیری نقطهای، دسترسی به میزان فعالسازی کافی، آسانتر و کم خطاتر است.
۳) عمق تابش نور: برای فعالسازی پروتئینهای حساس به نور در بافتهای مختلف، در نظر گرفتن عمق و حجمی از بافت که باید در معرض نور قرار بگیرد، امری ضروری است. شدت نور تابش یافته به بافتهای مختلف با افزایش عمق، کاهش محسوسی مییابد. بافتهای مختلف از درجه پراکنده ساختن متفاوت نوری برخوردار هستند. همچنین نورهای با طول موجهای مختلف، درجه پراکندگی متفاوتی از خود نشان میدهند، بطوریکه در طول موجهای بالا، عمق نفوذ افزایش مییابد.
۴) شدت نوری مورد نیاز: مقیاس پاسخ اپسین و جریان حاصل از آن، مستقیما به شدت نوری که به این پروتئینها تابش میکند، بستگی دارد. در مقایسه سیستمهای حمل نور، قدرت نوری بازای واحد سطح نمونه (mW/mm2) نسبت به قدرت خروجی کل (در mW) از اهمیت بیشتری برخوردار است. کنترل دقیق شدت نور میتواند در جلوگیری بروز فوتوتوکسیسیتی، مفید و کاربردی باشد.
۵) تابش پالسی و یکپارچگی نور: تابش پالسی نور به طریقی که بهترین کینتیک پروتئینهای هدف مورد بهره برداری قرار گیرد، برای دست یابی به نتایج مورد انتظار در نمونه، با اهمیت است. انعطاف پذیری در این زمینه مهم است؛ زیرا کاهش دادن پهنای پالس بمنظور دست یابی به فعالسازی کافی پروتئینها، مورد نیاز است. بسیاری از اپسینها پاسخی آنی به نور تابشی نشان میدهند، پس منبع نوری باید از دقت و پاسخ گویی لحظهای به تغییرات اعمال شده برخوردار باشد.
سیستم حمل نور به ساختارهای عمقی بافتی بر پایهی فیبر نوری
منابع نوری معمول عبارتند از: لیزرهای فاز جامد پمپی دیودی با توان بالا (DPSSLs) و دیودهای تابنده نور (LEDs). این منابع توسط یک ژنراتور موج مانند کنترل شده و از نظر اقتصادی نیز به صرفه هستند.
فیبرهای نوری شیشهای یا پلاستیکی برای اتصال منابع نوری به ساختارهای in vivo مورد نیاز هستند. فیبرهای نوری غیر تهاجمی یا LEDs میتوانند با انجام کاشت فیبر یا ایجاد منافذ جمجمهای، در تحریک نوری شبکههای عصبی در لایههای سطحی قشر و حتی اهداف عمقی مورد استفاده قرار گیرند. اهداف عمقی نیاز به کاشت فیبر نوری دارند؛ این کاشت ممکن است بصورت طولانی مدت بوده و برای استراتژیهای مطالعاتی طولی انجام شود.
در مطالعات اپتوژنتیکی in vivo از فیبرهای چند منظوره استفاده میشود. این فیبرها در مقایسه با فیبرهای تک منظوره، اندازه بزرگتر و خروجیهای عددی بیشتری داشته و از ظرفیت “تجمیع نوری” بالاتری برخوردار هستند.
ایمپالسهای نوری در طول فیبر با بازتاب داخلی کامل حرکت کرده و با کمترین میزان اتلاف انرژی، به انتهای فیبر میرسند.
با این حال، ذکر این نکته ضروری است که اهداف مطالعاتی، تعداد، شکل، طول و قطر فیبرها را تعیین میکند. بعلاوه، استفاده از پوشش سیاه یا پوششهای opaque در مطالعات الزامی است؛ زیرا کوچکترین مقادیر انکسار نور نیز میتواند باعث تحریک سلولی در طول مطالعه خصوصا در محیطهای تاریک شود.
فاکتورهایی که باید در زمان انتقال نور به ساختارهای بافتی مورد توجه قرار گیرد:
– استفاده از طول موج مناسب برای فعالسازی اپسین
– ضرورت استفاده از یک یا چندین فیبر نوری کاشت شده بمنظور بهینه سازی انتقال نور به کل ناحیه مورد نظر
– ایجاد توان کافی نوری با بهره گیری از لیزرهای با توان بالا یا LEDs
– استفاده اتصالات و تجهیزات انعطاف پذیر برای حرکت آزادانه موجود زنده مورد مطالعه (در مطالعات in vivo)
کاشت کانولای نوری
۱- دو تا سه هفته پس از تزریق وکتورها، نمونه مورد نظر را برای کاشت کانولای نوری آماده کنید.
۲- برشی به طول ۳.۵ سانتیمتر در میانهی اسکالپ ایجاد کنید تا کالواریا مشخص شود. همچنین عضله تمپورالیس را نیز برای آشکار شدن دو طرف جمجمه، برش دهید.
۳- جمجمه را با محلول هیدروژن پراکسید شستشو داده و خشک نمایید. برای پایان دادن به هر نوع خونریزی طولانی مدت میتوانید از کوتر الکتریکی استفاده کنید.
۴- همانند روند تزریق وکتور، مختصات bregma و lambda را مشخص کنید.
۵- محل قرارگیری کانولا را محاسبه و اندازهگیری کنید. (بهتر است کانولا را دقیقا بر روی محل تزریق وکتور قرار ندهید. زیرا ممکن است کانولا در زمان تصویر برداری، اختلال ایجاد کند.)
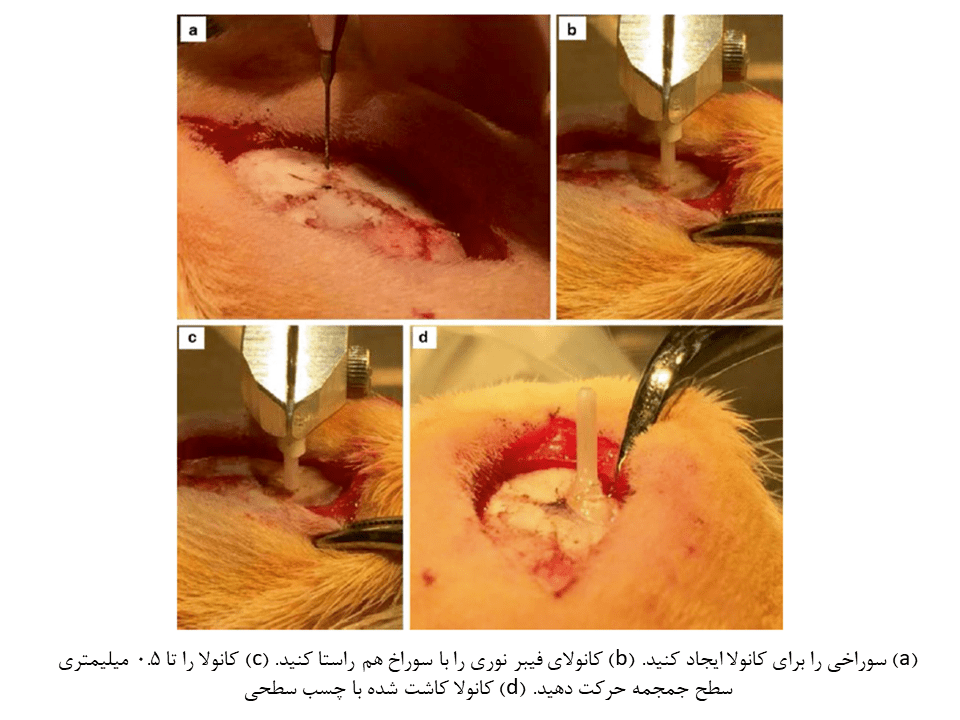
۶- سوراخ کوچکی به قطر ۰.۳ میلیمتر برای قرارگیری کانولا ایجاد کنید. سپس سخت شامه را با نوک میکرودریل یا سوزن زیرپوستی استریل سوراخ کنید.
۷- کانولا را به یک بازوی مکانیکی متصل کرده و در بالای محل کاشت قرار دهید.
۸- کانولا را به محل کاشت نزدیکتر کنید و فاصلهای نزدیک به ۰.۵ میلیمتر میان قاعده کانولا و سطح جمجمه باقی بگذارید. چسب Loctite را به اندازهی یک نقطه در این محل قرار داده و دوباره کانولا را تا تماس با جمجمه، پایین بیاورید. به چسب اجازه دهید تا خشک شود. (اضافه کردن یک قطره از سیمان دندانپزشکی Ortho-jet BCA به محل چسب Loctile، باعث افزایش سرعت خشک شدن آن میشود که زمان این پروسه بسیار کاهش خواهد داد.)
۹- طرفین کالواریا را با محلول پراکسید شستشو داده و خشک کنید.
۱۰- با استفاده از یک دریل دستی کوچکتر، سوراخی را در سطح جانبی کالواریا ایجاد کنید.
۱۱- مساحت لبه خارجی سوراخ را توسط دریل بزرگتر، افزایش دهید. از کورت کوچک استخوان برای صاف کردن لبههای این سوراخ استفاده کنید.
۱۲- پیچ نایلونی را تا طول ۰.۵-۱ میلیمتر کوتاه کنید.
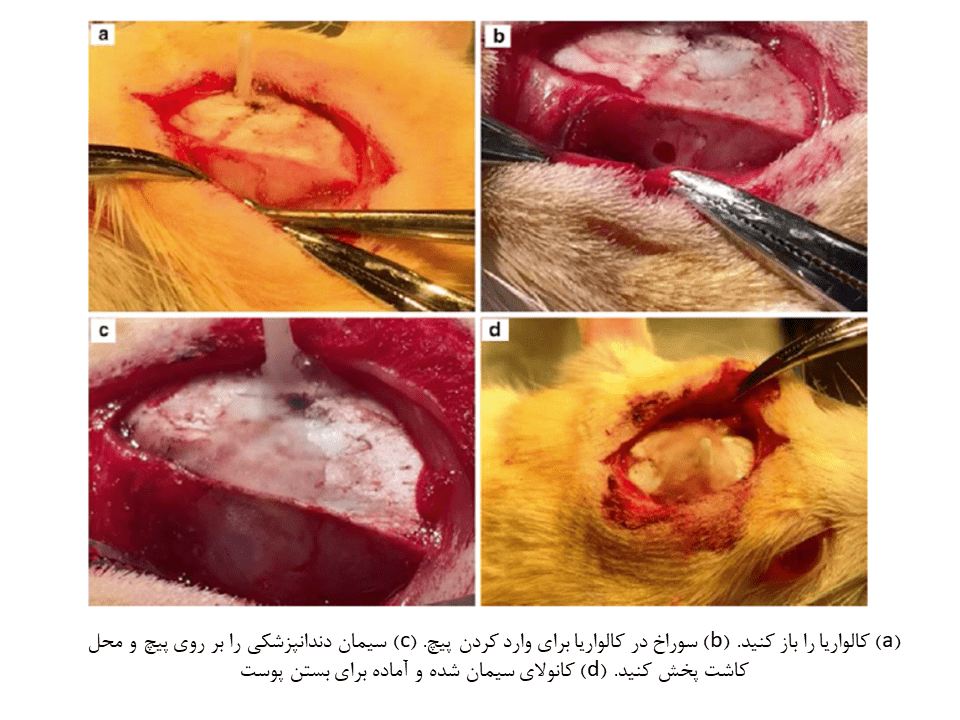
۱۳- پیچ نایلونی را با دقت در محل سوراخ قرار داده و آن را بطور کامل در سوراخ بپیچانید. اطراف پیچ را با تکهای گاز یا پارچه پنبهای، خشک کنید.
۱۴- یک قطره از چسب Loctite را بر روی جمجمه و پیچ قرار داده و اجازه دهید تا خشک شود.
۱۵- سیمان دندانپزشکی را با قوام بالا مخلوط کرده و در اطراف پیچ قرار دهید تا کاملا اطراف آن را بپوشاند. سپس اجازه دهید تا محکمتر شود. در صورت نیاز، سیمان بیشتری را حتی برای پوشاندن پیچ استفاده کنید. همچنین مقداری سیمان را برای کانولا در بالای کالواریا قرار دهید.
۱۶- مراحل ۹ تا ۱۵ را برای طرف دیگر جمجمه تکرار کنید.
۱۷- سیمان دندانپزشکی بیشتری به بالای کالواریا اضافه کنید تا اطراف آن کمی برجستهتر شود. فضای کافی برای نصب اتصال دهنده و کابل فیبر اپتیک باقی بگذارید. به سیمان اجازه دهید تا محکمتر شود.
۱۸- پوست را بخیه زده و محلی برای بیرون ماندن کانولا باقی بگذارید.