متدهایی که با تولید سیگنالهای real-time، جهشهای با فراوانی اندک را در DNA ژنومی شناسایی میکنند، ابزارهای قدرتمندی به منظور تشخیص زودرس و پیشآگهی سرطان در معاینات بالینی هستند. به عنوان مثال، جهشهای رخ داده در کدون ۱۲ از انکوژن KRAS، به فراوانی در انواع مختلفی از سرطانهای انسانی یافت میشوند. وجود این جهش، بازتابکننده مقاومت به مهارکنندههای تیروزین کیناز در سرطان ریه و مقاومت به داروهایی مانند cetuximab در سرطان کولون میباشد. FLAG یکی از تکنولوژیهای جدید real-time PCR است که میتواند به منظور آنالیز چنین جهشهایی به کار رود.
مقالات مرتبط:
متدهای دیگری نیز به منظور تشخیص جهشهای شناختهشده استفاده میشوند، از جمله PCR-RFLP، allele-specific PCR، oligonucleotide ligation و… . این متدها اما نیاز به مرحلهای اضافی به منظور تشخیص نهایی دارند. متدهای دیگری نیز وجود دارند که در آنها پردازش نمونه تنها در یک مرحله انجام میگیرد و برخی از آنها عبارتند از: nick-translation PCR، fluorogenic allele-specific PCR، universal TaqMan probes. با این حال، این تکنیکها نیز نمیتوانند وجود مقادیر اندک توالیهای هدف جهشیافته را در حضور مقادیر بالای DNA وایلدتایپ شناسایی کنند. وجود DNA وایلدتایپ در مقادیر بالا سیگنالهای مربوط به الل جهشیافته را میپوشاند و این شرایطی است که بر بسیاری از نمونههای بالینی حاکم است. به علاوه بسیاری از متدها امکان تشخیص وجود جهش را فراهم میکنند، اما نمیتوانند خصوصیات دقیق نوکلئوتید تغییریافته را مشخص نمایند و توالی یابی به عنوان گامی دیگر و برای تعیین ژنوتیپ باید مورد استفاده قرار گیرد.
FLAG یکی از تکنولوژیهای جدید real-time PCR بوده و مخفف Fluorescent Amplicon Generation می باشد. طی این تکنیک، به صورت همزمان، ۱) توالی جهشیافته به صورت انتخابی و درمیان انبوهی از DNA وایلدتایپ ، تکثیر میشود، ۲) واکنش تکثیر به صورت real-time مانیتور میگردد و ۳) توالی دقیق تغییریافته تعیین میشود، در نتیجه نیاز به انجام توالی یابی به صورت مرحلهای جداگانه از میان میرود.
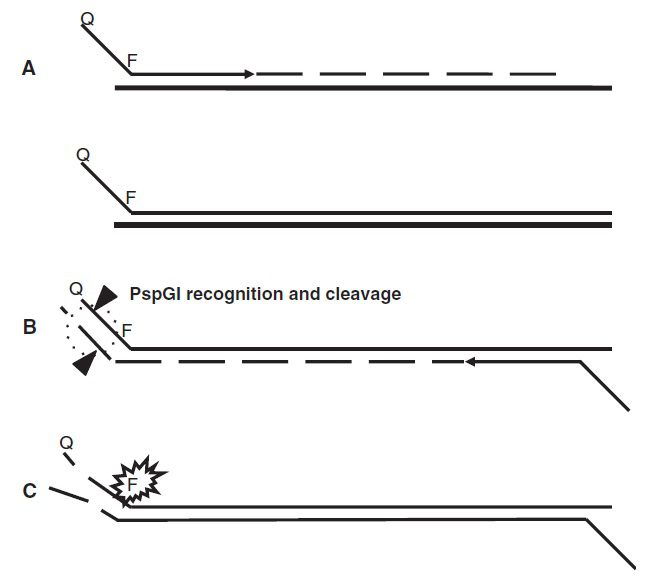
FLAG از اندونوکلئازهای مقاوم به حرارت به منظور تولید سیگنال real-time استفاده میکند. استراتژی تولید سیگنال به این صورت است که ناحیه مورد نظر با استفاده از جفت پرایمرهای مخصوصی که دارای تگی در انتهای ۵’ خود هستند، تکثیر میشود. این تگ، حاوی جایگاه تشخیص آنزیم محدود کننده مقاوم به حرارت است. پرایمر فوروارد، دارای لیبلهای دیگری در ناحیه تگ است که شامل quencher و فلوروفور هستند و به ترتیب در انتهای ۵’ و ۳’ قرار گرفتهاند.
حین گسترش توالی توسط پلیمراز، ناحیه تگ دورشتهای شده و جایگاه تشخیص آنزیم محدودکننده پدید میآید. اندونوکلئاز مورد استفاده، با ایجاد برش، باعث جدایی فلوروفور از quencher موجود در انتهای ۵’ محصولات PCR شده و در نتیجه تولید سیگنال فلورسنت میکند. PspGI اندونوکلئاز محدودکنندهای است که به طور غیرعادی مقاوم به حرارت بوده و طی چرخه حرارتی، در مقابل غیرفعال شدن مقاومت نشان میدهد.
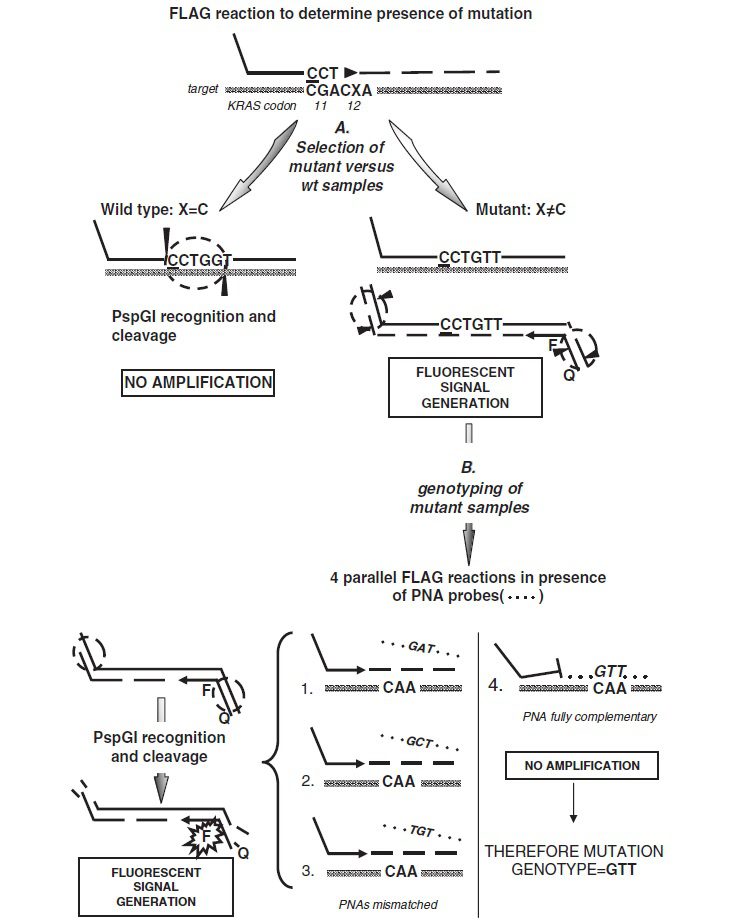
در نتیجه، در کل دوره واکنش PCR تولید سیگنال فلورسنت به طور پیوستهای انجام میشود و تولید نمایی محصولات PCR به صورت real-time پیوسته مانیتور میگردد. در مورد PspGI، که برای تشخیص جهشهای رخ داده در کدون ۱۲ از انکوژن KRAS به کار میرود، تگ افزودهشده توسط پرایمر تنها در صورتی ایجاد جایگاه تشخیص میکند که کدون ۱۲ وایلدتایپ باشد. PspGI در طول واکنش فعال است و امپلیکونهای تشکیلشده را شکسته و تکثیر آنها را مهار میکند. از سویی دیگر، اللهای جهشیافته حین PCR به صورت نمایی تکثیر میگردند. در نهایت با انجام این کار، تکثیر انتخابی جهش نسبت به الل وایلدتایپ صورت میگیرد.
به منظور تعیین ژنوتیپ جهش در این متد، از پروبهای PNA استفاده میکنند. اهمیت تعیین ژنوتیپ جهش در جهشهایی مانند جهش کدون ۱۲ در KRAS، پی بردن به پیشآگهی بیماری و افتراق خوشخیمی از بدخیمی است. پروبهای PNA به گونهای تهیه میشوند که تغییرات نوکلئوتیدی خاصی را در مجموعهای از واکنشهای real-time FLAG بررسی نمایند.
PNAها الیگونوکلئوتیدهای غیرقابل گسترشی هستند که در آنها اسکلت ریبوز-فسفات توسط واحدهای (۲-aminoethyl)-glycine ای که توسط پیوندهای آمیدی به همدیگر متصل شده اند، جایگزین شده است. این الیگومرهای سنتیک، هیبریدهایPNA/DNA ای با مقاومت حرارتی بالا میسازند که در صورت وجود تنها یک mismatch بسیار ناپایدار میگردد. در صورتی که پروب PNA کاملا مکمل یک توالی خاص، مثلا کدون ۱۲ جهشیافته KRAS باشد، از اتصال و گسترش پرایمر forward جلوگیری به عمل آمده و تکثیر مهار میگردد. در صورتیکه تنها یک mismatch وجود داشته باشد، PNA هیبریداسیون پرایمر را مهار نمیکند و این منجر به تکثیر و تولید سیگنال فلورسنت میگردد. با استفاده از PNA در کنار FLAG میتوان تعیین ژنوتیپ تغییرات نوکلئوتیدی خاص را انجام داد و به این نحو، نیاز به توالییابی را از میان برد.
این کار میتواند در دو مرحله و یا یک مرحله انجام شود. در صورت دو مرحلهای بودن، ابتدا واکنش FLAG به منظور تعیین جهش انجام میشود و اگر وجود جهش تایید شود، واکنشهای موازی تعیین ژنوتیپ صورت میگیرد. هر کدام از این چهار واکنش، حاوی پروب PNA متفاوتی هستند که به عنوان مثال در آنالیز KRAS، اختصاصی ۴ مورد از شایعترین جهشهای کدون ۱۲ (GTT, GAT, GCT, TGT) میباشند. با مشاهده شدت نسبی سیگنال از هر کدام از واکنشها، هویت توالی جهشیافته مشخص میشود، به این نحو که در صورت ضعیف یا غیرقابل سنجش بودن سیگنال، توالی موردبررسی کاملا مکمل پروب PNA مورد استفاده میباشد.
در صورت تکمرحلهای بودن نیز، پنج واکنش real-time PCR به صورت موازی انجام میگیرد و اطلاعات مربوط به جهش و ژنوتیپ به صورت همزمان به دست میآید. رویکرد نخست، به علت عدم انجام پردازش روی نمونههای وایلدتایپ، تعداد کل واکنشهای انجامشده را کاهش میدهد. رویکرد دوم، مزیت سرعت بالا و closed-tube بودن را دارد. closed-tube بودن باعث میشود که ریسک آلودگی که در تکنولوژیهای جایگزین به علت چندمرحلهای بودن بالاست، کاهش یابد.
FLAG به علت قرار داشتن فلوروفورها روی پرایمرهای PCR، نیازی به استفاده از پروبهای فلوروژنیک مانند Taqman یا بیکونهای مولکولی ندارد. از این رو، این تکنیک پلتفرم جایگزینی را برای multiplex کردن واکنشهای real-time PCR ارائه میدهد. همچنین به علت فعال ماندن PspGI در حین واکنش PCR، فلورسنت دائما تولید شده و سیگنالهای قویتری حاصل میشود. از محدودیتهای FLAG آن است که ناحیه تکثیرشده نباید حاوی جایگاه PspGI دیگری به جز جایگاه واقع در انتهای ۵’ پرایمر دارد. از آنجایی که امپلیکونها معمولا کوتاه هستند، این محدودیت مشکل خاصی ایجاد نخواهد کرد.
این روش اختصاصیت و قدرت انتخابی بالایی دارد که در نمونههای مربوط به تومورها (بیوپسی یا جراحی) میتواند مفید واقع شود. این ویژگی FLAG را برای شناسایی و تعیین ژنوتیپ جهشهایی که با فراوانی اندک در نمونههای پلاسما و یا آسپیراسیون حضور دارند، مناسبتر میکند. در افراد سالم، DNA در گردش، در مقادیری در حد نانوگرم در پلاسما وجود دارد و این مقدار در بیماران سرطانی افزایش مییابد. تشخیص وجود DNA جهشیافته در پلاسما میتواند گامی فراتر از روشهای عادی تشخیص سرطان باشد و به توسعه روشهای غیرتهاجمی تشخیص بدخیمیها و نیز بررسی عود آنها بینجامد. FLAG میتواند در real-time PCR و ژنوتایپینگی که در ویروسشناسی و روی نمونههای مربوط به بیماریهای عفونی انجام میشود هم، میتواند به کار رود.
