با گذر زمان تجمعات پروتئینی دخیل در بیماری پارکینسون، از دستگاه گوارش به مغز منتقل میشوند.
آخرین مطالعۀ محققان بر روی موشها نشان میدهند که تودههای پروتئینی (Protein Clumps) دخیل در بیماری پارکینسون (Parkinson’s Disease)، در طول ماهها میتوانند از دستگاه گوارش (معده و روده) به مغز منتقل شوند.
نتایج این مطالعه که ۱۴ام نوامبر (همین هفتۀ اخیر) در نشست انجمن علوم عصبی (Society of Neuroscience) ارائه شد، نشان میدهد که استارت بیماری پارکینسون ممکن است در دستگاه گوارش زده شود. این مطالعۀ جدید به وضوح نشان میدهد که سلامت دستگاه گوارش تا چه حد در سلامت مغز میتواند تأثیر داشته باشد.
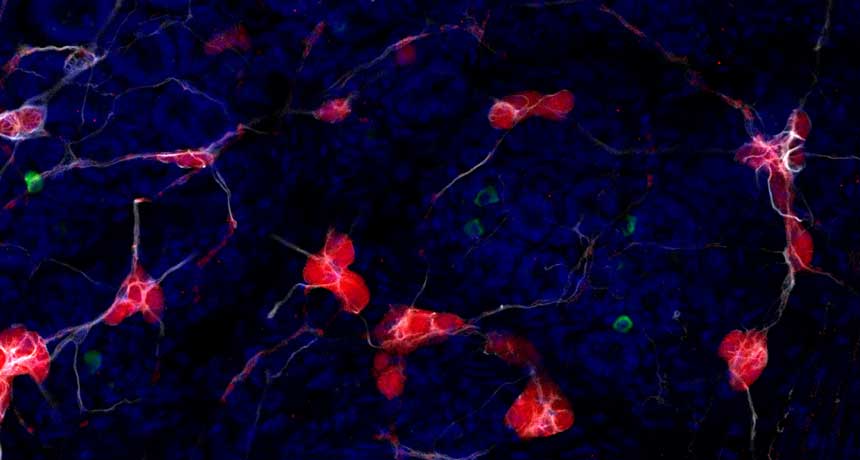
در این مطالعه، کالین چلیس (Collin Challis) و همکارانش از انستیتو فناوری کالیفرنیا (California Institute of Technology) نوعی پروتئین سنتتیک (Synthetic، ساخته شده در آزمایشگاه) به نام آلفا-سینوکلئین (Alpha-Synuclein) – که طی بیماری پارکینسون در بافت مغزی انباشته میشود – را به معده و رودۀ موشها تزریق نمودند. محققان سپس آلفا-سینوکلئین را از طریق روشی موسوم به CLARITY ردیابی کردند (در این روش بخشی از بدن جانور که مادۀ مورد مطالعه در آن حضور دارد خاصیت گذردهی نور (Transparency) پیدا میکند).
محققان ۷ روز پس از انجام تزریق، تجمعات آلفا-سینوکلئینی را در دستگاه گوارش موشها مشاهده کردند. سطح این تجمعات پروتئینی ۲۱ روز پس از تزریق به اوج خود رسید. با این حال این تجمعات تماماً از آلفا-سینوکلئین تزریقی حاصل نشده بودند. بررسیها نشان داد که تودههای آلفا-سینوکلئینی جدید در حقیقت پروتئینهای طبیعی بودند، نه سنتتیک. به عقیدۀ محققان سنتز آلفا-سینوکلئین طبیعی در بدن تحت تأثیر حضور نوع مصنوعی آن تحریک و منجر به انباشه شدن نوع طبیعی این پروتئین در دستگاه گوارش جانور شده بود.
به علاوه، پس از گذشت همین مدت زمان (سه هفته)، محققان متوجه شدند که بخشی از تجمعات آلفا-سینوکلئین از طریق عصب واگ (Vagus Nerve) – که مسئولیت عصبدهی پاراسمپاتیکی قسمت عمدۀ دستگاه گوارش را بر عهده دارد – به ساقۀ مغز گسترش یافته بود. ۶۰ روز پس از مرحلۀ تزریق، مشخص شد که آلفا-سینوکلئین به مغز میانی منتقل و انباشه شده بود؛ بخشی از مغز که حاوی تعداد فراوانی از سلولهای عصبی سازندۀ دوپامین (Dopamine، نوعی انتقالدهندۀ عصبی) میباشد. سلولهای سازندۀ دوپامین طی بیماری پارکینسون – که نوعی اختلال مغزی پیشرونده است – تخریب میشوند.
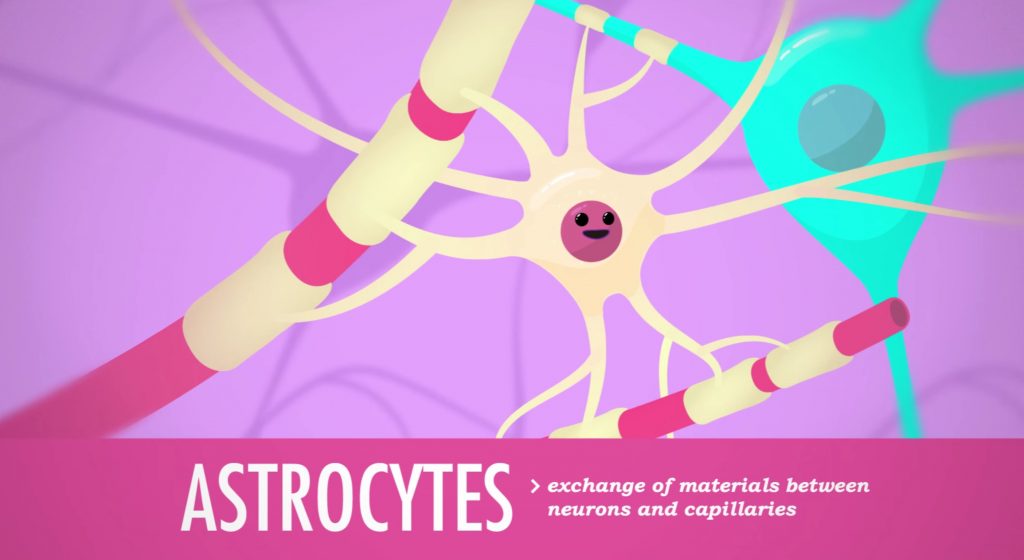
آلفا-سینوکلئین پس از رسیدن به مغز از طریق آستروسیتها (Astrocyte، نوع ویژهای از سلولهای پشتیبان دستگاه عصبی مرکزی که وظیفۀ تغذیۀ سایر سلولهای عصبی را برعهده داشته و در تشکیل سد خونی-مغزی دخالت میکنند) در بافت مغز منتشر میشود. نتایج مطالعه بر روی سلولهای آستروسیت کشت شده در آزمایشگاه نشان داده است که این سلولها قادر به برداشت، ذخیرهسازی و همچنین انتقال آلفا-سینوکلئین به سایر سلولهای عصبی هستند. این مطالعه نیز از سوی جینار رستمی (Jinar Rostami) از دانشگاه آپسالا (Uppsala University) در همین نشست ۱۴ام نوامبر ارائه شد.
گسترش و انباشتگی تدریجی آلفا-سینوکلئین برای موشها مشکلاتی را بهوجود آورد. با شروع انتشار تدریجی آلفا-سینوکلئین در بافت مغزی، موشها کمکم مشکلاتی را در زمینۀ دستگاه گوارش و به خصوص “حرکت” تجربه کردند. ۷ روز پس از تزریق، حجم مدفوع موشها افزایش پیدا کرده بود. ۶۰ و ۹۰ روز پس از تزریق (زمانی که آلفا-سینوکلئین به مغز رسیده و مستقر شده بود) کارایی موشها در برخی از تستهای حرکتی افت کرد. این موشها در بسیاری از جوانب وضعیتی همانند سایر موشهای مبتلا به پارکینسون (ناشی از جهش ژنتیکی) داشتند.
ایدۀ انتشار آلفا-سینوکلئین از دستگاه گوارش به مغز بسیار جدید است. این نتایج و نتایج سایر مطالعات مشابه، دانشمندان را در جستوجوی ریشۀ این بیماری به خارج از مرزهای دستگاه عصبی مرکزی رانده است. شواهد نیز نشان میدهد که دستگاه گوارش مکان مناسبی جهت تحقیق و بررسی است چرا که بیماران مبتلا به پارکینسون مشکلات گوارشی نظیر یبوست را نیز تجربه میکنند. در سال ۲۰۱۵ نیز محققان گزارش کردند که احتمال بروز پارکینسون در گروهی از بیماران دانمارکی – که عصب واگشان از طریق عمل جراحی قطع شده بود – کمتر از افراد نرمال بود. این منطقی به نظر میرسد؛ اگر مسیر انتقال آلفا-سینوکلئین از دستگاه گوارش به مغز را قطع کنیم، احتمال بروز بیماری نیز کمتر خواهد بود.
هنوز مشخص نیست که چرا اصلاً آلفا-سینوکلئین از همان ابتدا در دستگاه گوارش انباشته میشود. تئوریهای عدیدهای در این زمینه مطرح شده است. یکی از تئوریها معتقد است ترشح ترکیباتی موسوم به کرلی (Curli) از سوی باکتریهای دستگاه گوارش، تجمع آلفا-سینوکلئین را تحریک میکند. آفتکشها (Pesticides)، بازگشت اسید (Acid Reflux) و التهاب، از دیگر عوامل تحریک کنندۀ رسوب آلفا-سینوکلئین میباشند.
