در سرطان که یکی از علل اصلی مرگومیر در سراسر جهان است، سلولها به طور سرسامآور و خارج از کنترلی تقسیم میشوند. آیا ژنهای سرکوبکننده تومور و پروتوانکوژنها میتوانند راهی را به سمت توقف این فرایند بگشایند.
سالانه چندین هزار نفر بر اثر سرطان جان خود را از دست میدهند. در سال ۲۰۰۵، سرطان بعد از بیماریهای قلبی، عامل اصلی مرگومیر در ایالات متحده بود و ۲۲.۸٪ کل مرگومیر را تشکیل میداد. بهعلاوه، علیرغم کاهش چشمگیر در مرگومیر ناشی از سایر انواع بیماریهای مزمن مانند بیماریهای قلبی عروقی در سالهای ۱۹۵۰ تا ۲۰۰۵، مرگومیر ناشی از سرطان تنها کاهشی اندک داشته است. آمار حاکی از آن است که یک نفر از هر دو مرد و یک نفر از هر سه زن، در طول زندگی خود به سرطان مبتلا خواهند شد. درنتیجه، از سال ۱۹۷۱ که رئیسجمهور نیکسون علیه سرطان اعلان جنگ کرد، هدف بسیاری از پژوهشگران بر تشخیص زودهنگام، پیشگیری و درمان هدفمند این بیماری شایع و ناتوانکننده قرار گرفته است.

تصویر ۱. تایملاین؛ لندمارکهای ژنتیکی در تشخیص سرطان.
امروزه دانشمندان با مجموعه جدیدی از سلاحهای مبارزه با سرطان مجهز هستند: کل ژنوم انسان توالییابی شده و دسته بزرگی از ژنهای موثر در سرطان شناسایی شدهاند. تکنولوژیهای فراوانی نیز به منظور کشف ژنهای جدید مرتبط با سرطان در حال توسعه میباشند. تستهای ژنتیکی میتوانند برای تعیین خطر ابتلا به سرطانهای ارثی و یا تهیه اثرانگشت ژنتیکی تومور به کار گرفته شوند. در آینده، تعداد روزافزونی از درمانهای سرطان طبق ژنوم فرد طراحی شده و برای هدفگیری موثر و اختصاصی سلولهای سرطانی به کار گرفته خواهد شد. به منظور درک اساس این درمانها نخست باید مکانیسمهای ژنتیکی کلی ایجاد سرطان را بشناسیم.
سرطان فرایندی چندمرحلهای است
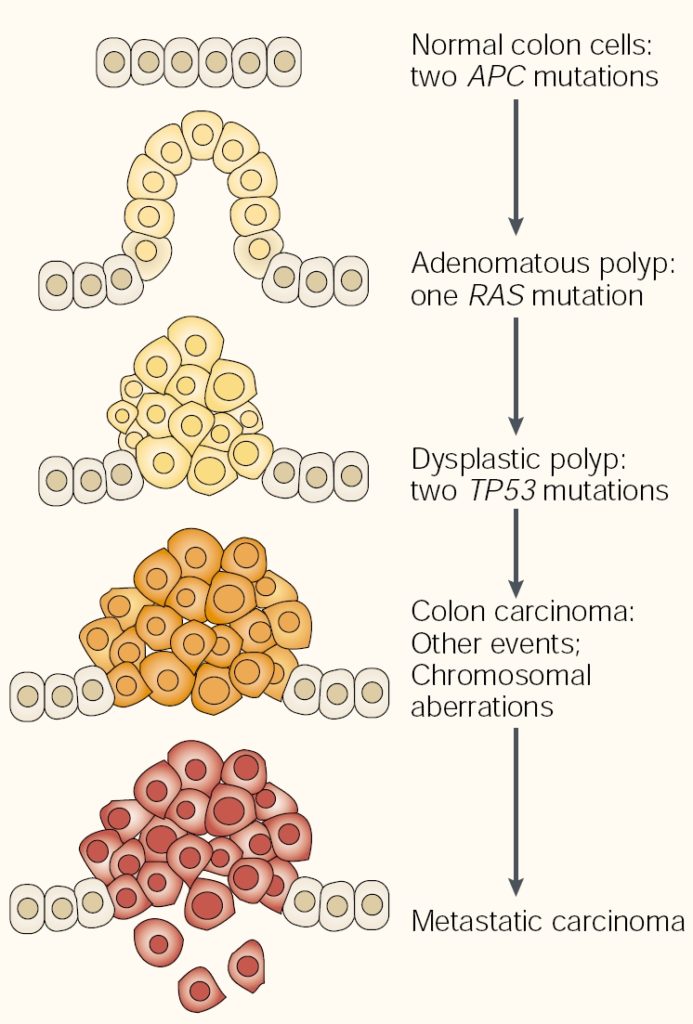
تصویر ۲. سناریو پنجمرحلهای ابتلا به سرطان کولورکتال؛ این سناریو رویدادهای جهشی مرتبط با هر مرحله را در آدنوکارسینوما نشان میدهد.
سرطان به گروهی از بیماریها اطلاق میگردد که فنوتیپ کلی مشترکی را دارا هستند: رشد و تکثیر سلولی خارج از کنترل. سرطان فرایندی چندمرحلهای است که طی آن سلولها مجموعهای از جهشها را کسب میکنند. این فرایند درنهایت منجر به رشد بیشازحد رشد سلولی، مهار تمایز و فرار از مرگ سلولی خواهد شد. با رشد اندازه تومورهای سرطانی، فرایند آنژیوژنزتحریک شده و طی آن تومورها منبع جدیدی از عروق خونی و درنتیجه غذا و اکسیژن را به دست می آورند. در نهایت، سلولهای توموری بافتهای اطراف را هدف قرار میدهند که متاستاز نامیده میشود.
سرطان یک بیماری ژنتیکی است که در اصل به صورت یک کلون میباشد. بیماری زمانی آغاز میگردد که سلولی واحد تعدادی جهش کسب میکنند. این جهشها در مجموع سلولی را که زمانی نرمال بوده، به سلولی سرطانی تبدیل میکنند که به طرز غیر قابل کنترلی تکثیر میشود و در نهایت ممکن است در سراسر بدن پراکنده گردد. جهشهای ژنی مرتبط با سرطان میتوانند از طریق لایه زایا از والدین به فرزندان منتقل شوند و یا فرد آنها را از طریق جهشهای سوماتیک اکتساب کند. زمان زیادی برای تجمع جهشها در سلول و سرطانیشدن آن موردنیاز است. از این رو، ریسک سرطان با افزایش سن، بالاتر میرود.
پیشروی سلول به سمت سرطان، در صورت به ارث رسیدن جهشهای مرتبط با سرطان از سلولهای زایا افزایش مییابد. در واقع، سلولهای این فرد از همان ابتدا یک گام به سرطان نزدیکتر خواهند بود.
ژنهایی که منجر به سرطان می شوند: ژنهای سرکوبکننده تومور و پروتو انکوژنها
جهشهای ایجادشده در دو نوع از ژنها منجر به سرطان خواهند شد: ژنهای سرکوبکننده تومور که مانند ترمز عمل کرده و رشد و تقسیم سلولی را مهار میکنند؛ و پروتوانکوژنها که مانند پدال گاز عمل کرده و رشد و تقسیم سلولی را تسهیل مینمایند. جهشهایی که فعالیت ژنهای سرکوبکننده تومور را مهار میکنند و یا موجب فعالیت بیش از اندازه پروتوانکوژنها میگردند، میتوانند سلول را به سمت سرطان هدایت نمایند. در هر دو مورد، سلولها ترمز خود را از دست میدهند، پدال گاز در آنها بیشتر فشرده میشود و به صورتی غیرقابل کنترل هدایتشان به سمت سرطانی شدن، افزایش مییابد.
ژنهای سرکوبکننده تومور برای نخستین بار در سال ۱۹۷۱ توسط Alfred Knudson و حین مطالعاتش بر روی وراثت رتینوبلاستوما (نوعی از سرطان رتین که در کودکان رخ میدهد) شناسایی شدند. جهشهایی که ژنهای سرکوبکننده تومور را غیرفعال میکنند (جهشهای loss-of-function)، ممکن است در اثر موارد زیر ایجاد شوند: حذف ژن سرکوبکننده تومور، جهشی نقطهای که منجر به از دست رفتن عملکرد پروتئین کدشده توسط ژن سرکوبکننده تومور شود و یا جهشی که در ناحیه پروموتر ژن سرکوبکننده تومور اختلال ایجاد کرده و باعث از دست رفتن و یا کاهش بیان آن شود. در بسیاری از موارد، جهشهای loss-of-function ژنهای سرکوبکننده تومور مغلوب هستند؛ به این معنی که هر دو نسخه ژن باید جهشیافته باشد تا سرطان ایجاد گردد.
جهشی که در ژن HRAS ایجاد شده و مرتبط با سرطان مثانه است، نخستین جهش سوماتیکی است که در یک پروتوانکوژن شناسایی شد و قادر است گلایسین جایگاه ۱۲ را به والین تبدیل کرده و در نهایت ایجاد سرطان کند. جهشهای ایجادشده در پروتوانکوژنها، آنها را به انکوژنها تبدیل کرده و میتوانند در اثر این موارد ایجاد گردند: تغییر تنها یک جفتباز و ایجاد فرم هایپراکتیو پروتوانکوژن، amplification ژن در داخل ژنوم که منجر به تولید تعداد زیادی از نسخههای زیادی از آن انکوژن در داخل ژنوم و افزایش سطح بیان آن میگردد، و یا ایجاد جهش در ناحیه پروموتر پروتوانکوژن که باعث افزایش بیان ژن میشود. این جهشها در داخل سلول الگوی بیان غالب دارند، به این معنی که تغییر تنها یک الل منجر به تکثیر خارج از کنترل سلول خواهد شد.
مطالعات نشان دادهاند که برخی از انواع سرطان با جهشهایی در پروتوانکوژنها و یا جفت پروتوانکوژنهایی خاص مرتبط هستند. در یکی از این مطالعات که در سال ۲۰۰۷ انجام شده است، محققان ۱۰۰۰ نمونه مختلف توموری را که نشانگر ۱۷ نوع مختلف سرطان بودند، بررسی کردند. نمونهها شامل نمونههای توموری بیماران، ردیفهای سلولی سرطانی، primary tumor specimens، کشتهای short-term نمونههای توموری و زنوگرافتهای مشتق از ردیفهای سلولی تومورال بودند. محققان ۲۳۸ جهش انکوژنی شناختهشده را در ۱۷ پروتوانکوژن مختلف شناسایی کردند. از بین این ۱۷ ژن، ۱۴ مورد در حداقل یک نمونه جهشیافته بودند و ۳۴ درصد از ۲۳۸ جهش انکوژنی موردبررسی شناسایی شدند. ۳۰ درصد نمونههای توموری حاوی حداقل یک جهش انکوژنی بودند.
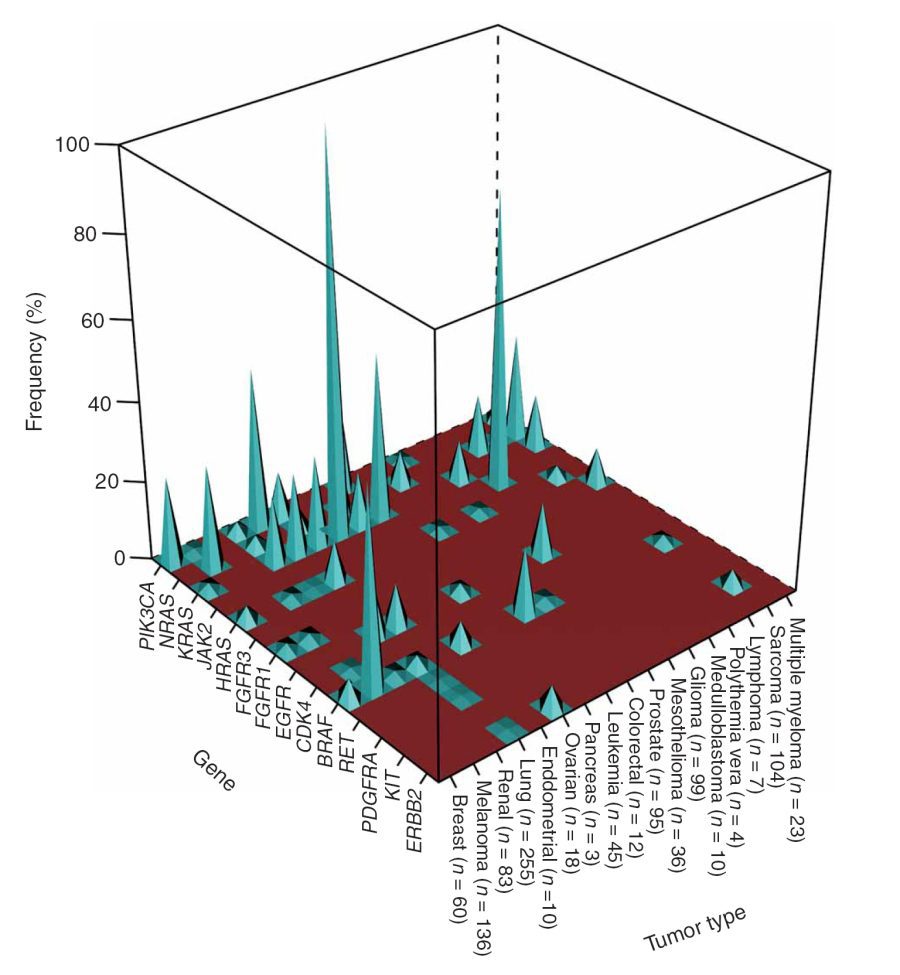
تصویر ۳. فراوانی جهشهای انکوژنی در انواع مختلف تومورهای انسانی؛ فراوانی (محور y) درصدی از سلولهای توموری (محور x) مربوط به انواع گفتهشده که حامل جهش انکوژنی معینی بودند (محور z)، با تعداد کلی نمونههای آن تومور بهخصوص مقایسه شدهاند.
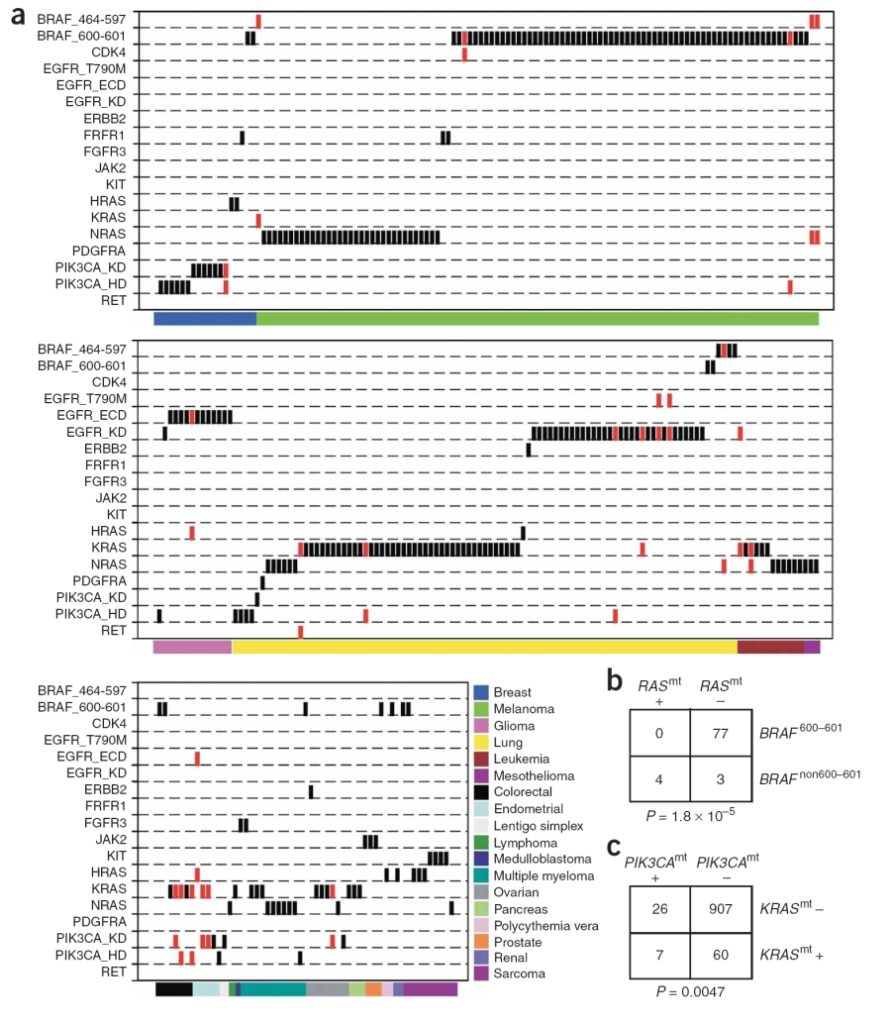
تصویر ۴. جهشهای انکوژنی فراگیر و co-ocurring ایجادشده در سرطانهای انسانی؛ a) جهشهای انکوژنی که در یک ژن و یا یک دومین عملکردی از پروتئین ممکن بود رخ بدهند، در یک گروه دستهبندی شدند (به عنوان مثال در مورد اول، KRAS برای تمامی جهشهایی که در KRAS رخ میدهند و در مورد دوم، PIK3CA_KD برای تمام جهشهای دومین کیناز PIK3CA). زمانی که فنوتیپی متمایز با جهشی مرتبط میشد، آن جهش در گروه جداگانهای قرار میگرفت (به عنوان مثال، EGFR_T790M برای جهش T790M از EGFR با مقاومت نسبت به مهارکنندههای EGFR شناخته شده است). نمونههای جهشیافته (بارهای مشکی) بر اساس گروههای جهشی انکوژنی و نوع تومور مرتب شدهاند. بارهای قرمز، نشان از جهشهای co-occurring دارند. EGFR_ECD، جهش دومین خارجسلولی EGFR؛ EGFR_KD، جهش دومین کیناز EGFR؛ PIK3CA_KD، جهش دومین کیناز PIK3CA؛ PIK3CA_HD، جهش دومین هلیکال PIK3CA. (b) شیوع جهشهای BRAF و جهشهای co-occuring در همه ژنهای RAS. (c) وقوع همزمان جهشهای KRAS و PIK3CA.
تصویر ۳ نشانگر ارتباط میان انواع خاصی از سرطان با جهشهای خاص انکوژنی است. تصویر ۴a ارتباط متقابل میان جهشهای انکوژنی مختلف با انواع مختلف تومورهای بررسیشده است. بارهای سیاه، وقوع جهشهای انکوژنی و بارهای قرمز وقوع همزمان جهشهای انکوژنیک را نشان میدهد. محققان دریافتند که ۳۰ درصد تمام جهشهای PIK3CA همزمان با جهش انکوژنی دوم (معمولا در KRAS) و جهشهای انکوژنی در ژن BRAF غالبا در ترکیب با جهشی در ژن HRAS رخ میدهند (تصاویر ۴b و ۴c به ترتیب). محققان همزمان با غربالگری ۱۷ جهش شناختهشده در ۱۷ پروتوانکوژن مختلف، تعداد فراوانی از انکوژنهایی را که پیشتر ناشناخته بودند را نیز شناسایی کردند. نتایج این مطالعه نشان میدهند که جهشهای واقع در این مجموعه متشکل از ۱۷ پرتوانکوژن با احتمال بیشتری منجر به سرطان میگردند و اینکه مسیرهای فراوانی میتوانند به سرطان ختم شوند.
پیشبینیهای اولیه Boveri

تصویر ۵. پیشبینیهای بووری؛ بووری پیشبینیهای متعددی راجع به سرطان کرد. وی وجود چکپوینتهای چرخه سلولی را تبیین کرد که تنها در صورت وجود محرکهای خارجی خاصی، امکان تقسیم سلولی را فراهم میکردند. بووری وجود ژنهای سرکوبکننده تومور را پیشنهاد داد که تاثیراتشان توسط سیگنالهای خارجی از بین میرود و در سلولهای توموری پیش رونده وجود ندارند. بووری وجود انکوژنها و تکثیر و تقویت آنها در حین رشد تومور را پیشبینی نمود. وی پیشنهاد داد که پیشرفت تومورها از خوشخیم به بدخیم، شامل افزایش کروموزومهای تحریککننده رشد و از دست رفتن کروموزومهای مهارکننده رشد است. بووری منشا کلونال تومورها و نیز موزائیسم ژنتیکی را پیشبینی کرد. وی افزایش خطر ابتلا به سرطان را در اثر به ارث بردن کروموزمها (ژنها)ی خاصی که باعث توانایی کمتر در مقابله با بدخیمی میشوند را توصیف کرد. وی وقوع سرطان را در اثر به ارث بردن ژنهایی که باعث نقص در میتوز میشدند را بیان نمود. به عقیده بووری، وراثت دو کروموزم ضعیف از هر دو والد منجر به وقوع هوموزیگوتی از لحاظ کروموزوم ناهنجار و درنتیجه سندرومهای سرطان با penetrance بالا میشد. وی نقش التهاب و زخم را در پیشرفت تومور بیان نمود. به علاوه، وی از دست رفتن چسبندگی سلولی در متاستاز و حتی حساسیت سلولهای بدخیم به پرتودرمانی را پیشبینی نمود.
در سال ۱۹۱۴، تئودور بووری نوشتهای را منتشر کرد که و در آن این فرضیه را مطرح نمود که شاید رشد غیرعادی سلولهای توموری به علت غیرطبیعی بودن تعداد کروموزومهای موجود در سلولهای توموری باشد. این پدیده آنوپلوئیدی نامیده میشود. بووری در حال مطالعه بر روی جدایی کروموزمها در تخمک بارور توتیاها بود. وی دریافت که زمانی که یک تخمک با دو سلول اسپرم لقاح مییابد، سلول حاصل به صورت غیرعادی رشد کرده و یا میمیرد. بووری رابطه مهمی را میان تعداد غیرعادی کروموزومها و رشد و تکثیر غیرعادی سلولها شناسایی نمود و نتیجه گرفت که این تغییرات مرتبط با سرطان هستند. بر اساس این مشاهدات، بووری پیشبینیهای متعددی کرد که نسبت به زمان خود بسیار خیرهکننده بودند. در واقع خصوصیت مشترک تقریبا تمام سلولهای توموری تمایل آنها به حفظ تعداد غیرعادیای از کروموزمها است و ناپایداری ژنتیکی نامیده میشود.
نقشه راهی به سمت سرطان

تصویر ۶. قابلیتهای اکتسابی سرطان؛ بسیاری از سرطانها (نه همه آنها)، حین رشد خود مجموعه یکسانی از قابلیتهای عملکردی را به دست میآورند.
سلولها ممکن است از طریق جادهای ناهموار و یا یک آزادراه به سرطان برسند، اما در هر دوحالت طی مسیر، دسته یکسانی از ظرفیتهای توموریژنیک را به دست خواهند آورد. دانشمندان ژنتیک، دستهای از تغییرات فیزیولوژیک را شناسایی کردهاند که سلولها در طول مسیر خود تا سرطان آنها را به دست میآورند. در شرایط عادی، سلولها در پاسخ به سیگنالهای مرتبط با فاکتورهای رشد تقسیم شده و در پاسخ به سیگنالهای anti-growth رشد خود را متوقف میکنند. سیگنالهایی که تقسیم سلولی را تنظیم میکنند غالبا از سلولهای مجاور آزاد میگردند. در پاسخ به آسیبهای ژنتیکی یا محیطی، سلولهای نرمال تحت تاثیر مرگ سلولی برنامهریزی یا آپوپتوز از بین میروند. انتهاهای کروموزومی که تلومراز نامیده میشوند، به گونهای طراحی شده اند که با هر بار تقسیم سلولی کوتاهتر شوند. آنزیمی ویژه به نام تلومراز روی تلومرها عمل کرده و باعث افزایش طول آنها میگردد. این آنزیم در بسیاری از سلولهای نرمال فعال نیست. درنتیجه، بسیاری از سلولهای نرمال تنها به دفعات محدودی تقسیم میشوند تا اینکه تلومرشان کوتاه شده و اطلاعات ژنتیکی حیاتی از بین بروند.
برای اینکه سلولهای نرمال سرطانی شوند، باید از فرایندهای کنترلی که چرخه سلولی و تقسیم را کنترل میکنند، عبور کنند. این مکانیسمها، هالمارکهای سرطان نامیده میشوند: ۱) توانایی تقسیم در غیاب تحریک با فاکتورهای رشد، ۲) توانایی تقسیم در حضور سیگنالهای anti-growth، ۳) ناتوانی در آپوپتوز، ۴) توانایی حفظ طول تلمر علی رغم تقسیمات سلولی مکرر، ۵) تحریک آنژیوژنز، و ۶) توانایی تهاجم به بافتهای اطراف و متاستاز به سایر نقاط بدن.
با اینکه سلولها باید بتوانند هر کدام از این ظرفیتها را کسب کنند تا سرطانی شوند، ممکن است برای رسیون به مقصد نهایی مسیرهای مختلفی را طی نمایند. به عبارت دیگر، این ۶ مرحله ممکن است با ترتیبهای متفاوتی طی شوند. البته مرحله متاستاز معمولا آخرین مرحله است. به علاوه، در افرادی که دارای جهش در لایه زایای خود هستند، یا ژنی مرتبط با سرطان را از والدین خود به ارث بردهاند، این مسیر ممکن است کوتاهتر شود. در نهایت، تمام سلولهای داخل یک تومور مجموعه یکسانی از جهشها را به دست نمیآورند. معنی این جمله آن است که تمام تومورها شامل گروههای هتروژنی از سلولها هستند.
جنگ علیه سرطان: استفاده از ژنها به نفع پزشکی شخصیشده
پیشرفت سرطان، نیازمند مجموعههایی پیچیده از تغییرات ژنتیکی است که در طول زمان رخ میدهند. غربالگری ژنتیکی با استفاده از نمونههای خون، میتواند به تشخیص جهشهای لایه زایا در افراد با سابقه خانوادگی سرطان و ارزیابی میزان ریسک در این افراد کمک کند. به علاوه، آنالیز ژنتیکی تومور میتواند در تعیین جهشهای سوماتیک کمککننده باشد. کسب دانش مرتبط با جهشهای لایه زایا و جهشهای سوماتیک مرتبط با تومور، نقش مهمی رادر طراحی درمانی که اختصاصی هر فرد باشد، خواهد داشت. از این رو، با اینکه از زمان اعلان جنگ علیه سرطان تا به امروز پیشرفتهای عظیمی حاصل شدهاند، این جنگ تا مدتها ادامه خواهد داشت.
