بیوفیلمها (Biofilm) مجموعهای از یک یا چند نوع میکروارگانیسم هستند که میتوانند در سطوح مختلف رشد کند. میکروارگانیسمهایی که بیوفیلمها را تشکیل میدهند میتوانند از خانوادهی قارچها، باکتریها یا آغازیان باشند. یکی از آشناترین مثالهای بیوفیلم پلاکهای دندانی هستند؛ لایهای نازک از باکتری که بر سطح دندانها شکل میگیرند. انواع دیگری از بیوفیلمها وجود دارند که میتوانند بر سطوح بیجان نظیر مواد معدنی و فلزات رشد کنند. آنها در زیر آب و روی زمین یافت میشوند؛ میتوانند روی بافتهای گیاهی و حیوانی و یا روی دستگاههایی که به شکل مصنوعی درون بدن ایمپلنت میشوند؛ نظیر ضربانساز قلبی و کاتترها رشد کنند. همهی سطوح نام برده شده یک ویژگی هستند؛ مرطوب بودن!
بنا بر مقالهای که در سال ۲۰۰۷ در Microbe Magazine منتشر شد، این محیطها به شکل دورهای یا دائمی در تماس با آب هستند.
بیوفیلمها برای مدت زمانی بیسار طولانی در این محیطها رشد کردهاند. بقایای فسیلی در نزدیک به ۳.۲۵ بیلیون سال گذشته یافت شدهاند. برای مثال، فسیلهای بیوفیلمی که ۳.۲ بیلیون سال گذشته در سنگهای اعماق اقیانوس در شراطی هیدروترمال رشد کردهاند، یافت شدهاند.
تشکیل بیوفیلمها
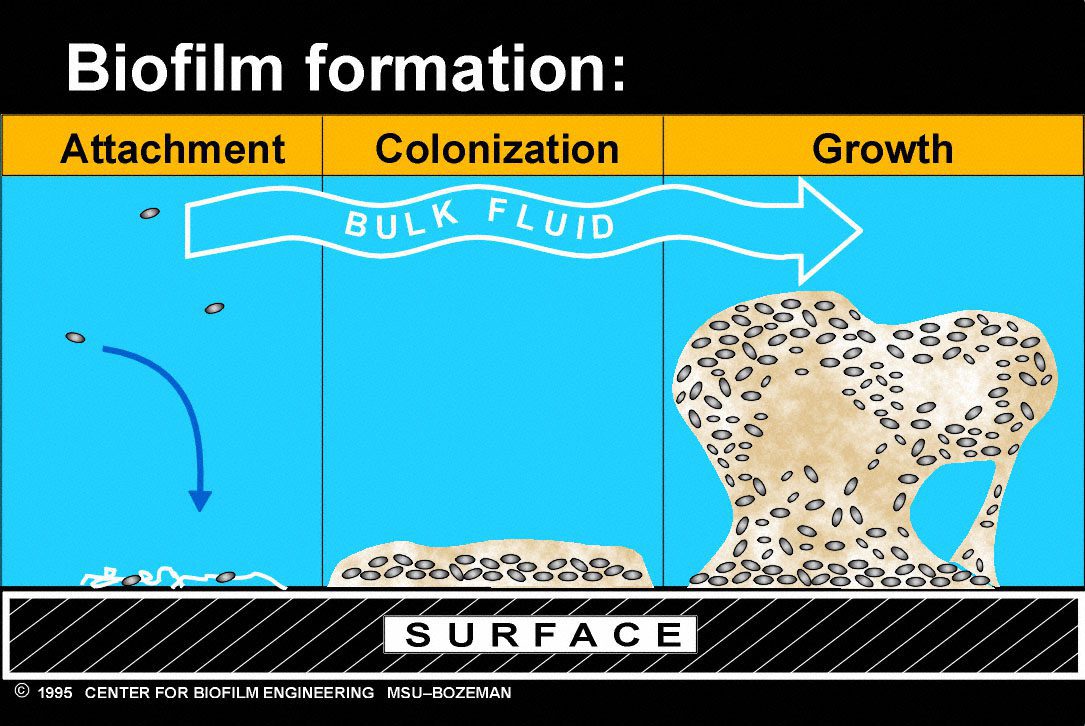
تشکیل بیوفیلمها زمانی آغاز میشود که میکروارگانیسمهای آزاد و شناور با سطح مناسبی برای رشد برخورد میکنند و در آن، ریشه میدوانند. برای عملی شدن مرحلهی اول، یعنی چسبیدن به سطح که در اصطلاح، Clonization نامیده میشود، ترشح موادی چسبناک از میکروارگانیسم ضروری است. این ماده، EPS یا مادهی پلیمری خارجسلولی نام دارد و شامل شبکههایی از قند، پروتئین و اسیدهای نوکلئیک است که امکان چسبیدن میکروارگانیسمها را پس از تکثیر فراهم میکند.
پس از چسبیدن، دورهای از رشد میکروارگنیسم آغاز میشود؛ لایههای بیشتری از جاندار و EPS ایجاد میشود که میتوانند اشکال سهبعدی خاصی را به وجود آورند. کانالهای آبی بین میکروارگانیسمها امکان تبادل مواد غذایی و محصولات دفعی را فراهم میکند.
شرایط محیطی متعددی میتوانند گستردگی این شبکه را تعیین کنند. همچنین، این فاکتورها میتوانند تعیین کنند آیا بیوفیلم تنها از چند لایهی سلولی تشکیل شود یا چیزی بسیار بیشتر. هرچند، به گفتهی رابین گِرلاک، پروفسور دپارتمان مهندسی شیمیایی و بیولوژیک در دانشگاه ایالت مونتانا عقیده دارد که این اعمال، بیشتر بر عهدهی خود میکروارگانیسم هستند. برای مثال، میکروارگانیسمی که مقادیر فراوانی EPS تولید میکند، حتی در صورتی که از مواد غذایی کافی برخوردار نباشد، میتواند بسیار گسترده شود.
از سویی دیگر، برای میکروارگانیسمهای وابسته به اکسیژن، میزان موجودِ آن میتواند تعیینکنندهی میزان رشد باشد. یکی دیگر از فاکتورهای محیطی، مفهومی با نام استرسِ برشی است؛ در صورتی که بیوفیلم در محیطی قرار داشته باشد که جریان آب پر فشاری در آنجا برقرار است، احتمال لایههای آن بسیار نازک خواهند بود.
در آخر، سلولهای موجود در بیوفیلم میتوانند خود را از شبکه آزاد کنند و در محیطی جدیدی به رشد خود ادامه دهند. بنابر مرکز مهندسی بیوفیلمها، این امر که با نام “پراکندگی بذر” شناخته میشود.
چرا بیوفیلم شکل میگیرد؟
برای میکروارگانیسمها، زندگی کردن در یک بیوفیلم با مزایای خاصی همراه است. اجتماعاتِ میکروبی معمولاً نسبت به استرسها بسیار مقاومترند. فاکتورهای استرسزای بالقوه، نظیر کمبود آب، افزایش یا کاهش pH محیط یا وجود مواد سمی برای میکروب؛ نظیر آنتیبیوتیکها، آنتیمیکروبها یا فلزات سنگین را شامل میشوند.
توجیهات بسیاری برای سختی و مقاومت بالای بیوفیلمها وجود دارد. برای مثال؛ لایهی EPS که آنها را میپوشاند، به عنوان یک عامل فیزیکی در برابر عوامل ذکر شده عمل میکند. این لایه میتواند با کمبود آب کمک کند یا در برابر اشعهی UV که میکروارگانیسمها را تهدید میکند، مقاومت ایجاد کند. بهعلاوه، مواد مضر نظیر فلزات و آنتیبیوتیکها با نزدیک شدن به EPS یا خنثی میشوند یا با اتصال به آن، از کار میافتند. به علاوه، این مواد پیش از رسیدن به سلولهای عمقیتر بیوفیلم، غلظت اثرگذار خود را در مواجه با سلولهای سطحی از دست میدهند.
با همهی این اوصاف، برای برخی از آنتیبیوتیکها امکان نفوذ به EPS و هجوم به لایههای مختلف بیوفیلم وجود دارد. در این جا نیز مکانیسم دفاعی دیگری به کار میآید: وجود باکتریهایی که از نظر فیزیولوژیک به خواب رفتهاند. همهی آنتیبوتیکها برای اثرگذاری، به فعالیتهای سلولی میکروبها نیازمندند. در صورتی که باکتری غیرفعال باشد، چیز زیادی برای آنتیبیوتیک باقی نمیماند.
یکی دیگر از روشهای محافظت در برابر آنتیبیوتیکها، وجود سلولهای باکتری خاصی با نام “پرسیستر (persisters)” است. این سلولها تقسیم نمیشوند و در برابر بسیاری از آنتیبیوتیکها مقاومند. بنا بر مقالهای که در سال ۲۰۱۰ منتشر شد، پرسیسترها با تولید موادی که ساختارهای هدف آنتیبیوتیک را هدف قرار میدهند، در برابر آنها مقاومت میکنند.
در حالت کلی، میکروارگانیسمهایی که با یکدیگر تحت عنوان بیوفیلم زندگی میکنند، از وجود سلولهای مختلف در اجتماع خود مزایایی کسب میکند.
گرلاک میکروارگانیسمها اتوتروف و هتروترف را مثال میزند؛ اتوتروفها، مانند باکتریهای فتوسنتزکننده یا جلبکها، میتوانند غذای خود را از مواد ارگانیک (مواد دارای کربن) بسازند، در حالی که هتروتروفها نمیتوانند غذای خود را تولید کنند و به منابع خارجی کربن نیازمندند. در اجتماعات چندارگانیسمی، این قابلیت به سلولهای مختلفی سود میرساند.
بیوفیلمها و تأثیراتشان بر زندگیِ ما
با توجه به محیطهای گستردهای که بیوفیلمها در آنها حضور دارند، نباید از اثرات مختلفشان روی زندگی انسانها غافل شویم. در ادامه، مثالهایی را مطالعه خواهید کرد.
سلامت و بیماری
پژوهشهایی که تا کنون روی بیوفیلمهای قارچی و باکتریایی انجام شده است، حضور آنان را در بسیاری از مشکلات سلامتی نشان میدهد. در سال ۲۰۰۲، سازمان سلامت جهانی اظهار کرد که بیش از ۸۰ درصد از عفونتهای انسانی توسط بیوفیلمها ایجاد میشوند.
بیوفیلمها میتوانند روی ابزار پزشکی ایمپلنتشده در بدن رشد، نظیر دریچههای قلب مصنوعی، مفصلهای مصنوعی، کاتترها یا ضربانسازها رشد کنند و موجب عفونت شوند.
این واقعه نخستین بار در سال ۱۹۸۰ زمانی که باکتریهایی روی کاتتر و ضربانساز قلبی رشد کرد، مشاهده شد. بیوفیلمها را همچنین با عفونتهای اندوکاردیت، پنومونیا در افراد مبتلا به سیستیک فیبروزیس و سایر عفونتهای خطرناک مرتبط دانستهاند.
علت اینکه امروزه، تشکیل بیوفیلمها به یک نگرانی تبدیل شده است، این است که باکتریهای موجود در این ساختارها مقاومت شدیدی به آنتیبیوتیکها و سایر مواد ضدعفونیکننده نشان میدهند و به سختی میتوان آنها کنترل کرد.
در حقیقت در مقایسه با باکتریِ منفرد، بیوفیلمها تا ۱۵۰۰ برابر به آنتیبیوتیکها مقاومند که درمان عفونتهای ناشی از آنان را به یک چالش اساسی تبدیل میکند.
بنا بر پژوهشی که در سال ۲۰۱۴ در ژورنال Cold Spring Harbor Perspectives منتشر شد، بیوفیلمهای قارچی نیز میتوانند با رشد روی ایمپلتها سبب عفونت شوند. برای مثال، گونههای مخمری از جنس کاندیداها میتوانند روی ایمپلنتهای سینه، ضربانسازها و دریچههای قلب مصنوعی رشد کنند. کاندیدا همچنین میتواند روی بافتهای بدن انسان رشد کرده و به مشکلاتی نظیر واژینیتیس (التهاب واژن) یا کاندیدیازیس اوروفاریژیال (با رشد مخمری در دهان یا گلو) بیانجامد. با این حال، باید در نظر داشت که این بیوفیلمها ویژگی مقاومت دارویی را ندارند.
زیست پالایی (Bioremediation)
در برخی موارد، بیوفیلمها میتوانند مفید باشد. در حالت کلی، زیستپالایی به معنای استفاده از میکروارگانیسمها برای دستیابی به یک محصول خاص، نظیر آنزیمها، یا برای تولید ترکیبات درمانی است. امروزه میتوان از بیوفیلمها برای تصفیهی آب از فلزات سنگینِ آلودهکننده نظیر کروم، مواد منفجره نظیر TNT و یا مواد رادیواکتیو مانند اورانیوم استفاده کرد.
این میکروبها قادر به تخریب یا تغییر آنها، به نحوی که دیگر نتوانند سمیت ایجاد کنند، میباشند. یکی از مثالهای موجود در این زمینه، نیتریفیکاسیون است؛ به معنای تبدیل آمونیای موجود در آب به نیتریت و نیترات از طریق اکسیداسیون. بنابر پژوهشی که در ژورنال Water Research در سال ۲۰۱۳ منتشر شده است، این عمل میتواند توسط باکتریهای اتوتروف انجام شود که به عنوان بیوفیلم روی سطوح پلاستیکی رشد میکنند.
تنها رشد بیوفیلمها در سطحی با اندازهی چند سانتیمتر میتواند مقادیر زیادی از آب را پاکسازی کند.
مادهی منفجرهی TNT که برای بسیاری از ما آشنا است، با نام علمی ۲,۴,۶-Trinitrotoluene به عنوان یک آلودهکنندهی خاک، آب و آبهای زیرزمینی شناخته شده است. ساختار این ماده از بنزن، حلقهی ششوجهیِ آروماتیک که از اتم کربن ساخته شده است، به علاوهی سه گروه نیترو (NO۲) و یک گروه متیل (CH۳) ساخته شده است. بسیاری از میکروارگانیسمها با کاهش سه گروه نیترو این فرآیند را انجام میدهند در حالی که برخی دیگر به حلقهی آروماتیک حمله میکنند.
میکروارگانیسمها از طریق فرآیند کاهش سبب تجزیهی TNT میشوند. محققان دریافتهاند که مخمر Yarrowia lipolytica قادر است از هردو روش، عمدتاً با کاهش حلقهی آروماتیک، آلودگی ناشی از TNT را از بین ببرد.
سلولهای سوختیِ میکروبیال
سلولهای سوختی میکروبیال از باکتری برای تبدیل پسماندهای ارگانیک به الکتریسیته استفاده میکنند.
میکروبهای مورد استفاده روی سطح الکترود مینشینند و الکترونها را منتقل میکنند که در نهایت سبب تولید جریان برق میشود. در مقالهای که در سال ۲۰۱۱ منتشر شد، مشخص شد که برخی باکتریها میتوانند از مواد زائد، جریان برق را تولید کنند که روشی ارزان و تمیز بدین منظور است.
پژوهشهای در حال اجرا
به نظر میرسد که دنیای ما با بیوفیلمها پیوند خورده است. در حقیقت، در اواسط قرن بیستم، کشف به عمل آمد که باکتریهایی که در اطراف ظرف کشت میکروبی رشد کردهاند، از تعداد باکتریهایی که درون مادهی کشت به صورت آزادانه وجود دارند، بسیار بیشتر است.
فهم این ساختارهای پیچیدهی میکروبی از موضوعات بسیار جذاب و جوان در حوزهی پژوهش است.
گرلاک میگوید:
بیوفیلمها اجتماعاتی بینظیرند؛ برخی افراد آنان را به مثابهی ارگانیسمهای چندسلولی میگیرند چرا که بین تکتک سلولها روابط گستردهای وجود دارد. دانش ما دربارهی این ساختارها روز به روز در حال فزونی است. امید است بتوانیم روشهایی برای کنترلِ بهتر آنان کشف کنیم؛ این امر سبب میشود هم ضرر و زیان آنها در حوزهی پزشکی بهتر شناخته شود و هم راههای جدیدی برای بهرهبرداری از آنان کشف شود.
سوالهای جالب در این حوزه هرگز تمام نمیشوند!

مطلب خوب و مفیدی بود