ویروسها از سرماخوردگی گرفته تا ایدز، ما را دچار عفونت میکنند؛ اما مطالعهی جدید نشان میدهد احتمالاً نقشی کلیدی در تکامل هوموساپینسها داشتهاند.
از سرماخوردگی ساده گرفته تا ابولا، ویروس عامل بیماری است؛ اما بررسی جدید نشان میدهد این ویروسها نقشی کلیدی در تکامل انسانهای بهخرد داشتهاند. عامل مسری بودن زیکا، ابولا، آنفولانزا و حتی سرماخوردگیهای ساده همین ویروسها هستند. اما مایهی شگفتی است که بدانیم ما در طول میلیونها سال این مهاجمان حیلهگر را به افسار خود کشیدهایم. از همان سطوح اولیهی زندگی تا همین حالا، ویروسها تأثیر زیادی بر گونهی انسان داشتهاند.
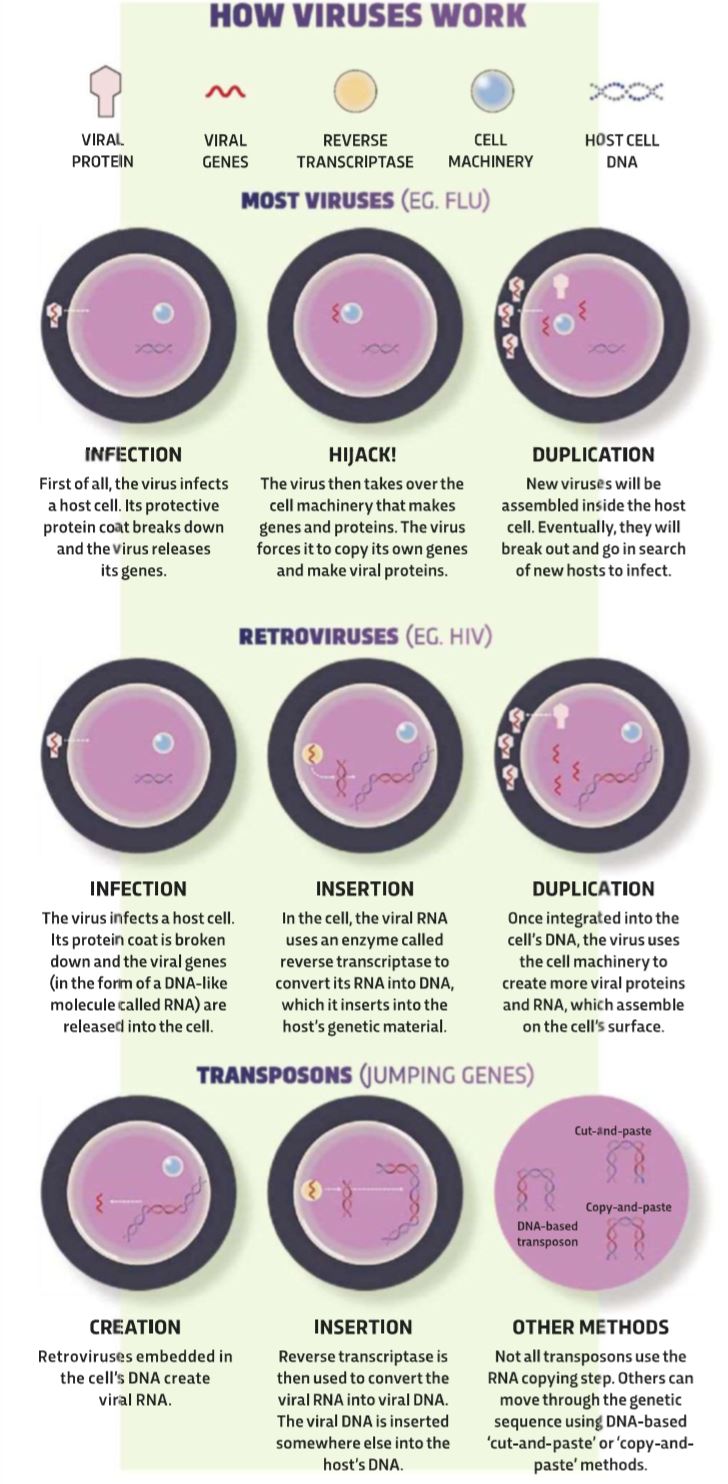
ویروسها کمی بزرگتر از یک رشته ژن (معمولاً در قالب مولکولی به نام (RNA هستند که با پوششی پروتئینی محافظت شده و اساس عملکردشان یکسان است. زمانی که ویروسی یک سلول را آلوده میکند، دستگاه مولکولی سلول را برای همانندسازی ژنها و پروتئینهای خود، تحت کنترل در میآورد. ویروسهای جدید با سرهم کردن این اجزا به وجود میآیند و در نهایت سلولهای دیگر را آلوده خواهند کرد.
پایان داستان زندگی بسیاری از ویروسها، مثل آنفولانزا همین نقطه است؛ اما بسیاری از رتروویروسها مثل HIV حیلهگرانه شروع به نفوذ درون ژنهای ما میکنند. آنها به صورت تصادفی ژن خود را وارد ژنوم ارگانیسم کرده و تا زمان مناسب برای تولید ویروسها، خاموش باقی میمانند؛ اما اوضاع همیشه به این منوال نخواهد بود. ساختارهای ژنتیکی ویروس جاسازی شده، رونویسی گشته و پس از تبدیل به فرم DNA، به جایگاه دیگری از ژنوم وارد میشوند. با تکرار این چرخه، کپیهای بسیاری از DNAی ویروس ساخته میشوند.
در طول میلیونها سال، این توالیهای DNA ویروس به صورت تصادفی خاموش شده و یا تغییر یافته، و توانایی خروج از سلول میزبان را از دست میدهند. در نتیجه، برخی از رتروویروسهای درونزاد توانایی خروج دارند و برخی دیگر از آنها تا آخر عمر در سلول باقی میمانند. اگر هریک از این تغییرات در سلولهای جنسی تخمک و اسپرم اتفاق بیفتد، این تغییر ژنی به نسل بعد هم منتقل میشود و در نهایت به بخشی از ژنوم دائمی ارگانیسم تبدیل خواهد شد.
بیش از نیمی از ژنوم انسان از میلیونها توالی از DNA ویروسی وارد شده به سلول در میلیونها سال قبل یا توالیهای جابهجا شوندهای به نام ترانسپوزونها ساخته شده است. برخی محققان میزان آن را بالای ۸۰ درصد تخمین میزنند؛ زیرا توالیهای بسیار قدیمی را دیگر نمیتوان از نظر ساختار ویروسمانند تشخیص داد و در ژنوم مانند فسیلهای مولکولی مشخص میشوند.
سالهای زیادی بخش عظیمی از ژنهای تکرارشوندهی ویروسی در ژنوم انسان به درد نخور شناخته شده بودند؛ اما بخشی از این ژنهای به درد نخور ژنوم، بسیار کارآمدتر از چیزی هستند که فرض میکردیم. حال محققان با بررسیهای دقیقتر عناصر ویروسی ژنوم، به کشفیات پیچیدهتری دست یافتند. همانطور که ویروسها دشمن ژنتیکی ما هستند، برخی از آنها حال به بردگی ما در آمدهاند.
پیدایش پستانداران
حدود ۱۵ سال قبل، محققان آمریکایی مؤفق به کشف ژنی شدند که تنها در جفت فعال بود و به دلیل کارآیی آن در اتصال سلولهای جفتی به یکدیگر و تشکیل سنسیشیوم، آن را Syncitin نامیدند. جالب آنجا است که این ژن بسیار مشابه ژن شکلدهندهی رتروویروسها است. ژن سینسیتین دیگری نیز بعد از این مورد کشف شد که میتواند علاوه بر تشکیل جفت، مانع از اثر سیستم ایمنی مادر بر جنین درون رحم شود؛ و باز هم به نظر میرسد این ژن از رتروویروسها به ارث رسیده باشد.
اما علیرغم کشف این دو ژن در انسان و دیگر نخستیهای بزرگ، این ژن در سایر پستانداران با اتصالات مشابه سلولهای جفتی وجود ندارد. موشها هم دارای دو ژن سینسیتین هستند: این دو ژن همان کارآیی مشابه در انسانها را دارند؛ اما منشأ آنها به نظر ویروسهای کاملاً متفاوت دیگری هستند. ژن سینسیتین با منشأ ویروسی متفاوت درگربهها و سگها نیز کشف شده است که به نظر میرسد هر دو از اجداد گوشتخوار یکسانی به جا مانده باشند.
مشخصاً تمام گونههای پستانداران میلیونها سال پیش توسط ویروسهای خاصی آلوده شده بودند. در طول سالیان ژنهای ویروسی نقشهایی را در رشد جفتی بر عهده گرفته و تبدیل به بخش دائمی ژنوم ما شدند. جالب است خوکها و اسبها لایهی سلولی مورد بحث در جفت را ندارند که در نتیجهی آن هم هیچ نوع ژن Syncitin به جای ماندهی ویروسی در ژنوم آنها قابل مشاهده نیست؛ بنابراین ممکن است تا کنون با این نوع از ویروسها مواجه نشده باشند.
در حالی که مورد سینسیتین نشاندهندهی تأثیر ژنهای ویروسی در بقای ما است، مثالهای بسیار دیگری مبتنی بر تأثیر سکانسهای کهن ویروسی بر فعالیت ژنومی انسان امروز وجود دارند. تلاشهای فراوان و طولانیمدت نسلشناس آمریکایی، باربارا مککلینتو ، نشان داد “ژنهای پرشی” ممکن است بر ژنوم گیاه ذرت تأثیر بگذارند. مککلینتوک دریافت اندوژنهای رتروویروسی که میلیونها سال است در ژنوم انسان وجود دارند، در ذرت از یک توالی به توالی دیگر به طور تصادفی جابهجا شده و عملکرد ژنهای اطراف خود را تغییر میدهند.
سلولهای ما انرژی بسیاری صرف ممانعت از فعالیت عناصر ویروسی میکنند. این ژنها توسط تگهای شیمیایی به نام علامتهای اپیژنتیکی برچسب زده میشوند. اما همراه با جابهجایی عناصر ویروسی، این خاموشکنندههای ژنی مولکولی نیز با آنها جابجا میگردند. بنابراین اثرات توالیهای ویروسی بر ژنهای مجاورشان، با جابجایی آنها مشخص خواهد شد.
در مقابل، ویروسها در DNAی خود سکانسهای بسیاری برای جذب مولکولهای سوئیچ دهندهی ژنی دارند. در یک رتروویروس فعال، این سوئیچها ژنهای ویروسی را فعال میکنند تا دوباره عفونی شوند. اما زمانی که یک توالی ویروسی به ناحیهی دیگری از ژنوم متصل میشود، ممکن است توانایی خاموش و روشن کردن ژنی از کار بیفتد.
در سال ۲۰۱۶ محققان دانشگاه یوتا دریافتند نوعی ویروس درونزاد، که ۴۵ الی ۶۰ میلیون سال پیش اجداد ما را آلوده کرده بود، با شناسایی مولکولی به نام اینترفرون – نوعی سیگنال خطر که نشاندهندهی وجود عفونت ویروسی در بدن است – ژن AIM2 را فعال میکند. با فعال شدن این ژن، برای جلوگیری از گسترش هر چه بیشتر عفونت فرآیند خودتخریبی آغاز میشود. این نوع از ویروسهای قدیمی به گونهای عامل دوگانه هستند و با کمک به سلول، از آنها در مقابل ویروسهای مهاجم محافظت میکنند.
مثال دیگر از ویروسهایی که در شکلدهی به گونهی ما نقشداشتهاند، در نزدیکی ژنی به نام PRODH یافت شده است. PRODH در سلولهای مغزی ما، خصوصاً در هیپوکامپ، دیده شده است. این ژن در انسانها از طریق کنترل سوئیچی ساخته شده از رتروویروسی قدیمی فعال میشود. شامپانزهها نسخهای از ژن PRODH را دارند؛ اما در مغزهایشان چندان فعال نیست. یکی از توضیحهای احتمالی آن است که میلیونها سال پیش در اجداد گذشتۀمان، ویروسی قدیمی یک کپی از خود را در نزدیکی PRODH جا گذاشته؛ اما این امر در پریماتهای نیایی که به صورت شامپانزههای امروزی تکامل یافتهاند، صورت نگرفته است. امروزه تصور میشود نقایص PRODH در اختلالات خاص مغزی دخالت دارند و بر این اساس، بسیار محتمل است این ژن نقشی هر چند ناچیز در سیمکشی مغز انسان داشته باشد.
به طور مشابهی، تفاوت در سوئیچهای ژنتیکی، مسئول تفاوتهای موجود مابین سلولهایی است که چهرهی انسانی ما را حین رشد در رحم مادر و همچنین چهرهی شامپانزهها را رقم میزنند. اگرچه ژنهای ما کمابیش مشابه ژنهای شامپانزهها هستند، مطمئناً ظاهری یکسان با آنها نداریم! با این حساب، تفاوت باید در کنترل سوئیچها باشد. اگر توالیهای DNA را مبنای قضاوت قرار دهیم، بسیاری از سوئیچهایی که در سلولهای شکلدهندهی صورت ما فعال هستند، اساساً منشأ ویروسی دارند؛ به این معنا که زمانی در سیر تکامل، در ژنوممان جا خوش کردهاند تا گونهی امروزی با چهرهی مسطح باشیم.
رامکنندگان ویروسها
به مانند جستوجوی نمونههای ویروسی قدیمی که اساس زیستی ما را تغییر دادهاند، دانشمندان در جستوجوی مکانیسمهای کنترلی هستند که پایهی اصلی اثرات آنها را موجب میشوند. متهمان کلیدی در این باره مولکولهای خاموشگر خاصی تحت عنوان پروتئینهای زینک فینگر کرَب (KRAB ZFPs) هستند که به سکانسهای ویروسی در ژنوم چسبیده و آنها را در جای خود محکم نگه میدارند. پروفسور دیدییر ترونو (Didier Trono) و تیمش از دانشگاه لوزان سوئیس، بیش از ۳۰۰ پروتئین زینک فینگر کرب متفاوت در ژنوم انسان یافتهاند که هر یک به نظر میرسد سکانس هدفِ مشتق از ویروس متفاوتی را ترجیح میدهند. آنها بدین ترتیب سیستم مولکولی روشن و خاموش کنندهی ژنها را تحت کنترل میگیرند. Trono توضیح میدهد این پروتئینها، به عنوان کشندههای رتروویروسهای درونزاد در نظر گرفته میشدند؛ اما آنها در واقع بهرهبرداران این اجزا هستند که به ارگانیسم امکان میدهند استفادهی حداکثری از توالیهای ویروسی داشته باشد.
ترونو و تیمش باور دارند پروتئینهای زینک فینگر، در واقع حلقهی ارتباطی گمشده مابین توالیهای ویروسی آسیبزا و آنهایی هستند که در قالب کنترل سوئیچ رام شدهاند. آنها شواهدی دارند مبنی بر این که پروتئینها در معیت اجزای ویروسی، نوعی مسابقهی تسلیحاتی ترتیب دادهاند که در ابتدا آنها را متوقف ساخته اما نهایتاً به نیرومندتر شدنشان منتج میشود. چنان که ترونو بیان میکند: “کاری که در واقعیت انجام میدهند، رام کردن این اجزا است. البته نه فقط به این معنا که ویروسها را به فعالیت وادار کنند؛ بلکه آنها را برای میزبان مثمر ثمر سازند. آن هم طوری که روشی ظریف و دقیق برای تنظیم فعالیت ژن در تمامی سلولها و شرایط احتمالی فراهم کنند.”
در تأیید این دیدگاه، یافتهای نشان میدهد گروههای مجزای پروتئینهای زینک فینگر در انواع مختلف سلولی فعال هستند. آنها همچنین در گونههای مختلف به صورت الگوهای خاص به چشم میخورند. اگر این پروتئینها تنها متوقف ساختن ویروسها را عهدهدار بودند، باید آرایشی مشابه در تمامی سلولها داشتند.علاوه بر این، در این صورت چرا باید به صورت متصل به هزاران جزء ویروسی قدیمی یافت میشدند؟ همان اجزایی که توسط ترونو و تیمش شناسایی شدهاند. پس چون جلوگیری از فعالیت ویروسی قدیمی فایده و حتی لزومی ندارد، باید نقش مهمی در کنترل فعالیت ژنها داشته باشند.
با این که نظریهی ترونو همچنان تا حدی بحثبرانگیز است، او پروتئینهای زینک فینگر کرب را به عنوان کارفرمایی سختگیر برای ویروسها میپندارد. کارفرمایی که این اجزا را در جهت اجرای فرامین ما در اختیار داشته و آنها را به کنترل سوئیچهای ژنتیکی بدل میکند. این امر میتواند در طول میلیونها سال، محرکی نیرومند برای ایجاد گونههای جدید باشد. به عنوان مثال، اگر ویروسی به طور تصادفی وارد یکی از موجودات اجدادی و نه سایرین شده و با گذر زمان توسط این پروتئینها رام شده باشد، میتواند سوئیچهای کنترلی جدیدی ایجاد کند؛ سوئیچهای کنترلگری که قادرند تأثیری شگرف بر ظاهر یا رفتار موجود داشته باشند.
جالب آن که این اجزای پرشی حین دورههای تغییرات محیطی فعالتر میشوند. در واقع با دشوار شدن شرایط، گونهها در دو راهی انقراض یا پیدا کردن راهی برای انطباق قرار میگیرند. حال فعال شدن این اجزای متحرک با ایجاد تغییرات سازمانی در ژنوم، واریاسیونهای ژنتیکی جدیدی ایجاد میکند که پشتوانهای غنی در مقابل انتخاب طبیعی محسوب میشود.
دوست یا دشمن؟
واضح است که ویروسهای گیر افتاده در ژنوم ما، در سیر زمانی تکامل فوایدی قابل توجه برای ما به ارمغان داشتهاند؛ اما تماماً نیز مفید نیستند. تقریباً یکی از هر بیست نوزاد انسان، با پرش ویروسی جدیدی در ناحیهای از ژنوم متولد میشود. این پرش میتواند ژن مهمی را غیرفعال کرده و موجب بروز بیماری شود. شواهد فزایندهای مبتنی بر ارتباط ترانسپوزونهای پرشی با آشفتگی ژنتیکی داخل سلولهای سرطانی وجود دارد. در این راستا، مطالعات شاخصی مدعی آنند که سلولهای مغزی، محل بسیار خوبی برای فعالسازی مجدد ژنهای پرشی هستند. موضوعی که احتمالاً زمینهی افزایش تنوع سلولهای عصبی و افزایش نیروی ذهن ماست؛ اما به طور بالقوه اختلالات مرتبط با پیری حافظه و بیماریهایی همچون اسکیزوفرنی را موجب میشود.
پس آیا این ویروسهای داخل DNA، دشمن ما هستند یا دوست ما؟ پائولو میتا (Paolo Mita)، محقق فوقدکترا در زمینهی ترانسپوزونها از دانشکدهی پزشکی دانشگاه نیویورک، معتقد است تا حدودی هر دو صحیح است. او توضیح میدهد: “من آنها را دوست/دشمن انسان مینامم؛ چرا که وقتی به نقششان در طول عمر یک فرد نگاه میکنیم، بیشتر به نظر میرسد در صورت تحرک، اثرات منفی خواهند داشت. اصطلاح کوتاه آن که دشمن ما هستند. اما از طرف دیگر، با در نظر داشتن گذر زمان، این اجزا نیروی قدرتمند تکامل بوده و هنوز در گونههای امروزی ما فعال هستند. تکامل فقط راهی است جهت پاسخدهی ارگانیسمها به تغییرات محیط. در این حالت، آنها قطعاً دوستان ما هستند؛ چرا که به عملکرد فعلی ژنوم ما شکل دادهاند.
و آیا ویروسهایی مانند HIV که امروز ما را آلوده میکنند، تأثیری بر تکامل ما در آینده خواهند داشت؟ میتا پاسخ میدهد: “البته! چرا که نه؟ اما نسلهای زیادی طول خواهد کشید تا بتوانیم برگردیم و اذعان کنیم که این تکامل صورت گرفته است. با این حال، میتوانیم بقایای مسابقات تسلیحاتی قبلی میان رتروویروسهای درونزاد و سلولهای میزبان را ببینیم. این جدالی مستمر است و فکر نمیکنم روزی متوقف شود.”